Все ферментативные процессы протекают в водной среде.
В природной воде всегда содержится различное количество разнообразных растворенных солей. Одни из них не оказывают никакого влияния на действие ферментов и определяют только вкусовые качества воды; другие, обладая теми или иными вкусовыми свойствами, оказывают глубокое влияние на действие ферментов.
К солям, растворенным в воде и оказывающим большое влияние на действие ферментов, относятся соли угольной кислоты - карбонаты и бикарбонаты. Из них наиболее часто в природной воде встречаются: Na2CO3, NaHCO3, Ca(HCO3)2, MgCO3, Mg(HCO3)2, K2CO3, KHCO3.
Эти соли образованы сильным основанием (катионы Na, К, Mg, Ca) и слабой угольной кислотой (анион).
Все они обладают в растворе щелочными свойствами, хотя с химической стороны они относятся к средним или даже кислым солям.
Любая соль в воде распадается на ионы, и сама вода находится в ионизированном состоянии; так, например, для раствора NaHCO3 в воде будет наблюдаться гидролитическая диссоциация:
NaHCO3 + H2O ↔ (Na’ OH’) + (HCO’3 H’)
Таким образом, в растворе будет находиться сильно диссоциированная щелочь - едкий натр (NaOH) и слабодиссоциированная угольная кислота (H2CO3). Свойства такого раствора будут определяться свойствами сильной щелочи - едкого натра, поэтому раствор будет иметь щелочную реакцию.
Все названные соли угольной кислоты при растворении в воде обусловливают щелочную реакцию воды и вследствие этого отрицательно влияют на ферменты при затирании солода. Поэтому вода, содержащая большое количество солей угольной кислоты, непригодна для пивоварения.
В солоде под действием ряда ферментов накапливаются аминокислоты и кислые фосфаты, которые и создают кислую среду, благоприятную для действия ферментов. При затираниисолода в щелочной воде, содержащей карбонаты, между фосфатами и карбонатами происходит реакция, в результате которой образуются нейтральные и щелочные соли фосфорной кислоты, кислотность солода понижается и создаются неблагоприятные условия для действия ферментов.
Допустим, что в солоде имеется кислый фосфорнокислый калий, а в воде - двууглекислый калий. Между ними произойдет следующая реакция:
KH2PO4 + KHCO3 → K2HPO4 + H2CO2
Угольная кислота (как слабодиссоциированная) немедленно распадется на угольный ангидрид и воду; угольный ангидрид (как газ) выделится, и тогда в среде останется К2НРО4 - соль, обладающая сильно щелочными свойствами в растворе. pH KH2PO4 около 4, a pH K2HPO4 - около 9.
Аналогичная реакция протекает между фосфатами и бикарбонатами кальция:
2(KH2PO4) + Ca(HCO3)2 = K2HPO4 + CaHPO4 + 2Н2О + 2СО2
При этой реакции соли кальция остаются в растворе, но они являются вторичными фосфатами, имеющими более щелочные свойства. Для того чтобы поднять кислотность раствора на прежний уровень, необходимо добавить в него фосфорную или другую сильную кислоту. В технологии пивоварения для этой цели применяется молочная кислота. Реакция с молочной кислотой, в сущности, сводится к непосредственному связыванию карбонатов кальция и вытеснению угольной кислоты с образованием растворимой нейтральной соли молочной кислоты - лактата кальция:
Ca(HCO3)2 + 2СН3СНОНСООН → Ca(СН3СНОНСОО)2 + 2Н2О + 2СО2
Все карбонаты воды связывают фосфаты солода, понижают кислотность солода; для устранения их вредного влияния необходимо обязательно подкислять воду или же удалить карбонаты из воды.
В обычной воде большинство карбонатов представлено солями кальция и магния - CaHCO3, MgCO3, Mg(HCO3)2. Эти соли составляют так называемую устранимую, или временную, жесткость воды.
Кроме устранимой, или временной, жесткости воды, различают еще постоянную жесткость. Постоянная жесткость в воде обусловлена кальциевыми и магниевыми солями серной, соляной кислоты - CaSO4, MgSO4, CaCl2, MgCl2 и других кислот.
Двууглекислые соли кальция могут быть легко удалены из воды путем перевода этих солей в углекислые, если к воде добавить едкую известь, т. е. Ca(OH)2.
В двууглекислом кальции Ca(HCO3)2 при этом замещается на кальций второй атом водорода угольной кислоты:
Ca(HCO3)2 + Ca(OH)3 = 2СаСО3 + 2Н3О.
В результате произойдет нейтрализация кислоты и щелочи, образуются вода и мел. Мел, как практически нерастворимое вещество, выпадет в осадок.
Таким образом, первый путь устранения временной жесткости сводится к добавлению к жесткой воде извести и последующему отстаиванию воды.
Этот способ требует громоздкого оборудования, строгого расчета задаваемого количества извести и длительной выдержки воды для отстаивания мела. Однако, несмотря на все неудобства, этот способ при очень большой устранимой жесткости воды дает хорошие результаты и может с успехом применяться в пивоварении.
Другой способ устранения временной жесткости воды основан на свойстве двууглекислых солей при кипячении разлагаться на свободную угольную кислоту и среднюю кальциевую соль угольной кислоты:
Ca(HCO3)2 → CaCO3 + CO2 + H2O.
Процесс разложения двууглекислого кальция может протекать только при очень интенсивном кипячении и удалении углекислого газа. Если газ не удаляется, то реакция разложения не произойдет и мел не будет выпадать в осадок.
Этот способ, простой по технике выполнения, но очень дорогостоящий и требующий громоздких специальных установок, на практике крайне редко используется.
Указанными способами устраняется временная жесткость воды, обусловленная двууглекислыми солями кальция. Двууглекислые соли магния, хотя и ведут себя с химической стороны аналогично двууглекислым солям кальция, но легко растворимы в холодной воде, поэтому временная жесткость, вызванная наличием в воде солей магния, не может быть устранена путем обработки такой воды едкой известью на холоду. Однако частично магниевая временная жесткость может быть устранена кипячением воды и быстрой фильтрацией ее. При этом двууглекислый магний переходит в углекислый, в горячем состоянии плохо растворимый в воде. Этот способ настолько сложен, что практически никогда не применяется в пивоваренной промышленности.
Постоянная жесткость воды может быть устранена только на специальных ионообменных установках. В качестве ионообменных веществ употребляются специальные смолы.
В принципе процесс устранения жесткости сводится к тому, что кислые смолы (Н-смолы) связывают катионы Ca, Mg, Na, К и т. д. и в воде остаются соответствующие анионы тех кислот, которые входили в состав солей, в нашем случае - угольной и серной. Таким образом, жесткая вода, пропущенная через кислые смолы (Н-смолы), освобождается от катионов и становится кислой. Если такую воду пропустить через другие смолы, поглощающие анионы, то она освободится и от кислот и будет близка к чистой дистиллированной воде.
Ионообменный способ очистки воды вофатитом (рис. 67) широко используется в разных отраслях промышленности, в том числе и в пивоваренной, хотя полной очистки воды от солей для производства пива не требуется. В некоторых особых случаях, когда постоянная жесткость воды очень велика и обусловлена сернокислыми и хлористыми солями кальция, магния и натрия, придающими воде горько-кислый вкус, этот способ является единственно возможным для исправления состава воды.
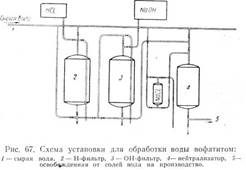
Вофатиг - искусственная смола, получаемая из фенолов и дубильных веществ или из ароматических аминов конденсацией с формальдегидом.
Вофатиты обладают сильными абсорбционными свойствами: анионы связываются ОН-вофатитом [(OH)2W], а катионы - Н-вофатитом (H2W).
Действие вофатитов видно из следующих реакций:
1) Ca(НСО2)2 + H2W = 2Н2О + 2СО2+ CaW
CaSO4 + H2W = H2SО4 + CaW
2NaCl + H2W = 2НС1 + Na2W
(Н-вофатит регенерируется соляной кислотой).
2) H2SO4 + (ОН)2 W = 2Н2О + SO4W
2НСl + (OH)2W = 2Н2О + Cl2W
(ОН-вофатит регенерируется едким натром).
Практически обрабатываемую воду пропускают через фильтры, заполненные двумя марками вофатита. Проходя через катионитовый фильтр, вода освобождается от всех катионов, но реакция ее становится кислой, поэтому очищенную воду дополнительно обрабатывают (OH)2W.
Отработавший вофатит легко регенерируют, пропуская через него 5%-ный раствор HCl или 2-4%-ный раствор NaOH. Остаток реактивов смывают водой.
В результате реакций с вофатитом выделяется углекислота в агрессивной форме, поэтому трубопроводы и сборники для воды изготавливают из соответствующих пластмасс (винидур).
Кроме ионообменной очистки воды, основанной на обмене катионов на водород (H) и анионов на гидроксил (ОН), существует пермутитовый способ смягчения воды, основанный на способности пермутитов обменивать свой катион натрия на катионы кальция и магния воды. При пермутитовом способе из жесткой воды извлекаются кальций и магнии и вместо них вводится натрий; вода становится щелочной в случае углекислых солей и нейтральной, по горько-соленой на вкус в случае сернокислых и хлористых солен. Например:
Na2P[12] + Ca (HCO3)2 = CaP + 2NaHCО3
для двууглекислых солей;
Na2P + MgSO4 = MgP + Na2SO4
для сернокислых солей:
Na2P + MgCl2 = MgP + 2NaCl
для хлористых солей.
Таким образом, пермутитовый способ умягчения воды для технологических нужд пивоваренного производства совершенно непригоден. Он может быть использован для воды, идущей на питание котлов с целью предотвращения накипи в котлах.
Кроме этих способов устранения жесткости воды, основанных на переводе растворимых кальциевых солей в нерастворимые и удалении их в форме осадков, существует способ уменьшения вредного влияния кальциевых солей угольной кислоты путем замещения угольной кислоты молочной, присутствие которой совершенно безвредно.
При добавлении молочной кислоты в жесткую воду, содержащую в растворе Ca(HCO3)2 и MgCO3 или Mg(HCO3)2, происходит реакция замещения. Молочная кислота, как более сильная, замещает угольную, а угольная, как нестойкая, распадается на углекислый газ и воду:
Ca(HCO3)2 + 2СН3СНОНСООН = Ca(СН3СНОНСОО)2 + 2Н2О + 2СО2
MgCO3 + 2СН3СНОНСООН = Mg(СН3СНОНСОО)2 + H2O + CO2
Как видно из приведенных реакций, количество кальция или магния в воде при этом не уменьшается, удаляется лишь угольная кислота, но зато кальциевая соль молочной кислоты (лактат кальция) имеет нейтральную или даже слегка кислую реакцию и вследствие этого не оказывает существенного влияния на действие ферментов.
Способ умягчения воды, точнее - способ устранения ее щелочности путем подкисления молочной кислотой, находит самое широкое применение и по своей простоте не сравним ни с каким иным способом умягчения воды для пивоваренного производства. (Более подробно затирание на жесткой воде с применением молочной кислоты будет описано ниже, в разделе о затирании солода).
Кроме солей кальция и магния, в природной воде часто содержатся соли железа, обычно в виде двууглекислого железа.
В присутствии воздуха двухвалентное железо легко переходит в трехвалентное, образуя гидрат окиси железа, чрезвычайно плохо растворимый в воде и выпадающий в форме бурого хлопьевидного осадка. Очистка воды от железа не представляет трудностей и сводится к тому, что вода, содержащая железо, сильно распыляется на градирне и затем отстаивается.
Итак, для производства пива необходима вода, содержащая минимальное количество углекислых солен кальция, магния и натрия, как солей щелочных, понижающих кислотность среды и вследствие этого отрицательно влияющих на осахаривание затора.
Для производства пива допустима вода с небольшим количеством сернокислых и хлористых солей. Большое количество этих солей ухудшает вкус напитка.
Практически принято считать пригодной для производства светлых сортов пива воду мягкую и средней жесткости. Состав мягкой и жесткой воды приведен в табл. 46.
Жесткая в указанных пределах вода может быть использована для производства светлых сортов пива при обязательном умягчении ее путем известкования или подкисления во время затирания молочной кислотой.
Для производства темных сортов пива жесткая вода может быть использована без обработки, так как темный солод имеет большую кислотность и содержит большое количество фосфатов и аминокислот, обладающих хорошим буферным действием в отношении pH, вполне перекрывающим отрицательное действие карбонатов воды.
Таблица 46
| Показатели
| Мягкая
| Жесткая
|
| Содержание в г/100 л воды
|
| Сухой остаток
| 5,12
| 28,40
|
| Окись кальция
| 0,98
| 10,60
|
| Окись магния
| 0,12
| 3,0
|
| Углекислота
| 1,0
| 11,15
|
| Серная кислота
| 0,43
| 0,76
|
| Аммиак и азотистая кислота
| Не должны содержаться
|
| Азотная кислота
| Следы
| Следы
|
| Хлор
| 0,2
| 0,2
|
| Жесткость в мг - экв
|
| Общая
| 0,56
| 5,28
|
| Устранимая
| 0,45
| 5,06
|
| Остаточная
| 0,11
| 0,22
|
Пивоваренные заводы СССР работают на воде самой разнообразной жесткости; в связи с этим изготовляемое пиво имеет свои специфические особенности.
Ленинградские пивоваренные заводы применяют мягкую невскую воду. Пиво этих заводов, как правило, очень светлое, умеренно охмеленное.
Жигулевский пивоваренный завод работает на жесткой сульфатной воде, и его пиво более темного цвета и кажется более сильно охмеленным.
На Николаевском пивоваренном заводе используется вода с большим содержанием хлоридов; пиво соответственно имеет горько-солоноватый привкус.
На Ижевском пивоваренном заводе на производство идет чрезвычайно жесткая карбонатная вода, поэтому пиво имеет большую цветность и отчетливо выраженную грубую хмелевую горечь.
Состав воды, таким образом, очень сильно сказывается не только на технологии получения сусла, но и на цвете и вкусовых качествах пива. Общим положением является правило: там, где на изготовление пива используется мягкая вода, получается светлое пиво с нежной и яркой хмелевой горечью и ароматом; там же, где пиво готовят на жесткой карбонатной воде, оно всегда получается темным с более сильной, грубой хмелевой горечью.
Жесткие воды для приготовления светлых сортов пива должны обязательно исправляться одним из приведенных методов. Наиболее прост и доступен всем заводам метод подкисления молочной кислотой с добавлением гипса, если сульфатная жесткость воды не особенно велика. Подкисление молочной кислотой дает очень хорошие результаты и большой экономический эффект, увеличивая выход экстракта.
Подкисление обычно проводится во время затирания солода путем добавления молочной кислоты в затор в количестве, полностью обеспечивающем перевод карбонатов воды в лактаты. Это количество заранее может быть рассчитано по карбонатной жесткости воды или остаточной щелочности воды. При обработке затора молочной кислотой обязательно контролируется концентрация водородных ионов; pH затора после подкисления должен быть 5,6-5,3. При подкислении затора молочной кислотой для исправления жесткости воды никогда не следует забывать, что солод сам но себе может обладать достаточной кислотностью и в некоторых случаях может сам исправлять жесткость вследствие отщепления фосфорной кислоты из фосфорорганических соединений, фитина и др. Поэтому прежде чем проводить исправление жесткости в производственных масштабах и вводить ее в технологический режим производства, необходимо провести опытное лабораторное затирание с подробным анализом карбонатной жесткости воды, остаточной щелочности и pH затора до и после подкисления. Убедившись в том, что для данного солода и данной воды расчетная норма добавляемой молочной кислоты действительно дает pH 5,5, можно провести подкисление заторов для умягчения воды, улучшения осахаривания затора и качества получаемого сусла.








