

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Оснащения врачебно-сестринской бригады.
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
В атоме ртути 80 электронов, 78 из которых находятся на полностью заполненных оболочках 1s-5d и образуют атомный остов с равными нулю орбитальным моментом и спином. Два внешних (валентных) электрона в основном состоянии образуют конфигурацию 6s2. При возбуждении атома (например, при электрическом разряде в парах ртути) один из этих электронов переходит на вышележащие уровни 6p, 6d,…7s, 7p, 7d… и образуются возбужденные состояния атома. При переходах из них в состояния с меньшими энергиями атом испускает электромагнитное излучение в видимой, ближней ультрафиолетовой и ближней инфракрасной областях. Расположение спектральных линий ртути (см. табл. 6.2 и П3.1) на первый взгляд не обнаруживает простых сериальных закономерностей, подобных атомам водорода (см. работу 5) и натрия (см. работу 6). Однако в спектре ртути можно легко увидеть проявления так называемой тонкой структуры атомных спектров (см. работу 9) – близко расположенные линии (две желтые линии и некоторые ультрафиолетовые линии) и группы линий с определенными соотношениями интервалов между ними (например, у зеленой, сине-фиолетовой и фиолетовой линий). Системы близко расположенных спектральных линий называют мультиплетами, две – дублетом, три – триплетом и т.д. Тонкая структура спектральных линий была открыта и исследована Майкельсоном. Причиной тонкой структуры спектральных линий является тонкая структура уровней энергии (называемых термами) атомов. На рис. 10.1 показано, что всем электронным конфигурациям двух внешних электронов атома ртути (кроме 6s2): 6s7s, 6s6p, 6s7p, 6s6d… соответствуют несколько близких уровней энергии, также называемых мультиплетами.
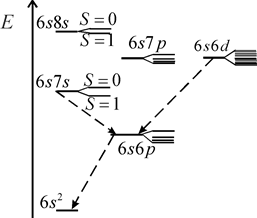
| Рис. 10.1. Схема тонкой структуры некоторых термов ртути с одним из электронов в состоянии 6s и переходы (штриховые стрелки), сопровождающиеся излучением наиболее ярких линий спектра |
Тонкая структура уровней энергии (называемая также мультиплетным расщеплением) – расщепление уровней энергии (термов) электронов в атомах (см. работу 9), молекулах (см. работу 13), кристаллах обусловлено, главным образом, спин-орбитальным взаимодействием (подробнее см. работу 9).
2. Тонкая структура уровней энергии атомов щелочных элементов и иона Hg + с одним внешним электроном
Наиболее простой является тонкая структура спектров атомов с одним внешним электроном – водорода, щелочных элементов (натрия, калия и т.д., см. работу 9), а также ионов с одним внешним электроном, например, Hg+. В таких атомах и ионах внешний электрон движется в поле атомного остова, включающего заряд ядра и остальные электроны, сильно связанные с ядром. Каждая из спектральных линий таких элементов и ионов, является двойной (дублетом). Дублеты, принадлежащие диффузной серии таких элементов и ионов, в действительности состоят из трех линий, две из которых настолько близки, что сливаются в одну размытую линию (отсюда и название диффузная). Примеры длин волн для первых линий главных серий щелочных элементов: лития, натрия, калия приведены в работе 6.
|
|
Сложение орбитального механического момента (момента импульса) электрона и его спинового момента приводит к новому квантовому числу электрона в атоме – числу 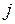 полного момента. В результате сложения орбитального момента
полного момента. В результате сложения орбитального момента 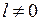 и спина
и спина 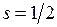 квантовое число полного момента может принимать два значения
квантовое число полного момента может принимать два значения 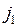 и
и 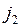
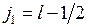 ,
, 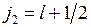 . (10.1)
. (10.1)
При 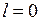 в отсутствие орбитального момента полный момент равен спиновому, а число
в отсутствие орбитального момента полный момент равен спиновому, а число 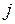 имеет единственное значение
имеет единственное значение 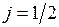 .
.
Каждый энергетический уровень (кроме s-уровней c квантовым числом 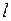 =0) с энергией
=0) с энергией 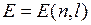 , зависящей от главного квантового числа
, зависящей от главного квантового числа 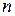 и орбитального квантового числа
и орбитального квантового числа 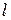 , расщепляется на два близких подуровня с энергиями (подробнее см. работу 9 и формулы (9.3)-(9.13))
, расщепляется на два близких подуровня с энергиями (подробнее см. работу 9 и формулы (9.3)-(9.13))
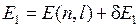 ,
, 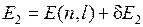 . (10.2)
. (10.2)
Поправка к энергии состояний электрона зависит от 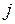 :
: 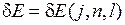 .
.
В результате подуровень с моментом 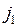 оказывается расположенным ниже подуровня с моментом
оказывается расположенным ниже подуровня с моментом 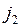 (нормальный дублет), а разность энергий
(нормальный дублет), а разность энергий 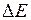 равна
равна
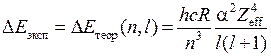 . (10.3)
. (10.3)
где 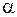 − так называемая постоянная тонкой структуры
− так называемая постоянная тонкой структуры
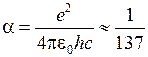 . (10.4)
. (10.4)
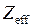 – эффективный заряд атомного остова (в единицах элементарного заряда). Разность энергий
– эффективный заряд атомного остова (в единицах элементарного заряда). Разность энергий 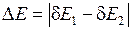 возрастает с ростом атомного номера
возрастает с ростом атомного номера 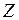 приблизительно пропорционально
приблизительно пропорционально 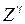 ,
, 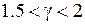 (см. табл. 8.2), поэтому с увеличением атомного номера возрастает и разность длин волн дублетов. У атома ртути она может составлять значительную величину. Заметим, что формулы (10.2), (10.3) применимы, лишь пока расщепление соседних уровней гораздо меньше расстояния между ними.
(см. табл. 8.2), поэтому с увеличением атомного номера возрастает и разность длин волн дублетов. У атома ртути она может составлять значительную величину. Заметим, что формулы (10.2), (10.3) применимы, лишь пока расщепление соседних уровней гораздо меньше расстояния между ними.
|
|
Состояния атома (называемые термами) с квантовыми числами 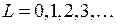 обозначаются, как и состояния электрона, латинскими буквами
обозначаются, как и состояния электрона, латинскими буквами 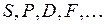 , вверху слева указывается мультиплетность
, вверху слева указывается мультиплетность 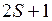 , внизу справа указывается значение
, внизу справа указывается значение 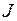 , например
, например 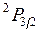 (см. также рис. 8.2).
(см. также рис. 8.2).
При отсутствии второго валентного электрона ион Hg+, состоящий из атомного остова и одного внешнего электрона, имеет структуру энергетических уровней и спектров аналогичные имеющимся у щелочных элементов (см. рис. 8.2). При этом d-уровни внешнего электрона не очень сильно отличаются от соответствующих уровней водородоподобного атома, поскольку движение электрона происходит преимущественно вдали от атомного остова, имеющего заряд +2е (см. подобный рис. 6.2). Орбитальный момент и спин внешнего электрона складываются в полный момент 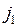 , который в d-состояниях может принимать два значения:
, который в d-состояниях может принимать два значения:
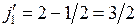 ,
, 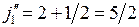 . (10.5)
. (10.5)
Все уровни энергии внешнего электрона представляют собой дублеты, для них применимы формулы (10.2), (10.3), в которых величина 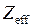 представляет собой эффективный (эквивалентный) заряд атомного остова,
представляет собой эффективный (эквивалентный) заряд атомного остова, 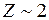 .
.
3. Тонкая структура уровней энергии атома ртути с конфигурациями внешних электронов 6 s 6 d и 6 s 7 d в моделях j - j и L - S -связей.
Рассмотрим подробнее свойства атома ртути с электронными конфигурациями 6s6d и 6s7d, в которых один из электронов в d-состоянии преимущественно находится вдали от остова, а другой в s-состоянии – поблизости от него. Если включить электрон s-состояния в состав расширенного атомного остова, то в начальном приближении все d-уровни энергии внешнего электрона будут по-прежнему представлять собой дублеты. Однако из-за неполной экранировки заряда ядра электроном в состоянии 6s значение 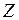 может заметно отличаться от единицы. В более точном приближении необходимо учесть взаимодействие удаленного внешнего d-электрона с s-электроном, в результате энергия атома
может заметно отличаться от единицы. В более точном приближении необходимо учесть взаимодействие удаленного внешнего d-электрона с s-электроном, в результате энергия атома 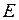 будет зависеть еще и от полного момента атома
будет зависеть еще и от полного момента атома 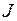 , образующегося при сложении полных моментов двух электронов. По правилу сложения моментов возможны следующие значения
, образующегося при сложении полных моментов двух электронов. По правилу сложения моментов возможны следующие значения 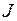 :
:
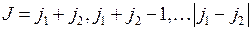 . (10.6)
. (10.6)
Соответствующие состояния обозначаются 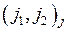 , например
, например 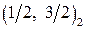 , а связь моментов электронов называется
, а связь моментов электронов называется 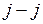 -связью. В модели
-связью. В модели 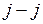 -связи орбитальный момент и спин каждого электрона взаимодействует между собой сильнее, чем с орбитальными моментами и спинами других электронов. Поэтому свойства состояний каждого электрона в значительной степени определяются его полным моментом
-связи орбитальный момент и спин каждого электрона взаимодействует между собой сильнее, чем с орбитальными моментами и спинами других электронов. Поэтому свойства состояний каждого электрона в значительной степени определяются его полным моментом 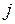 , который при
, который при 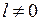 может принимать пару значений
может принимать пару значений
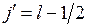 ,
, 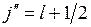 , (10.7)
, (10.7)
а при 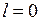 равен
равен 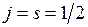 . Затем все моменты
. Затем все моменты 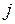 электронов объединяются в полный момент атома
электронов объединяются в полный момент атома 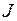 . При этом замкнутые полностью заполненные оболочки дают нулевой вклад в полный момент. Модель
. При этом замкнутые полностью заполненные оболочки дают нулевой вклад в полный момент. Модель 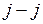 -связи приближенно работает для некоторых состояний электронов в атомах тяжелых (в том числе Hg) и инертных элементов.
-связи приближенно работает для некоторых состояний электронов в атомах тяжелых (в том числе Hg) и инертных элементов.
|
|
В большинстве других случаев более точные результаты дает так называемая 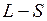 -связь или связь Рассела-Саундерса. В модели
-связь или связь Рассела-Саундерса. В модели 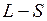 -связи орбитальные моменты взаимодействуют между собой сильнее, чем со спинами. Спины также связаны между собой сильнее, чем с орбитальными моментами. Поэтому все орбитальные моменты складываются в суммарный орбитальный момент
-связи орбитальные моменты взаимодействуют между собой сильнее, чем со спинами. Спины также связаны между собой сильнее, чем с орбитальными моментами. Поэтому все орбитальные моменты складываются в суммарный орбитальный момент 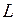 , все спины складываются в полный спин
, все спины складываются в полный спин 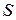 , а затем уже при сложении
, а затем уже при сложении 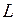 и
и 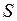 получается полный момент атома
получается полный момент атома 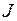 . По правилу сложения моментов для двух электронов в результате сложения ненулевых орбитальных моментов
. По правилу сложения моментов для двух электронов в результате сложения ненулевых орбитальных моментов 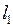 и
и 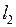 могут получиться следующие значения
могут получиться следующие значения 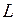
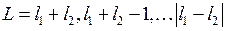 . (10.8)
. (10.8)
В результате сложения спинов 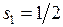 и
и 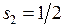 могут получиться два значения
могут получиться два значения 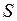
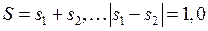 . (10.9)
. (10.9)
При сложении ненулевого 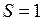 спина с моментом
спина с моментом 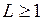 полный момент
полный момент 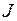 может принимать одно из трех значений
может принимать одно из трех значений
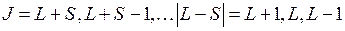 , (10.10)
, (10.10)
а при 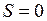 момент имеет единственное значение
момент имеет единственное значение 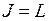 . Состояния (термы) с квантовыми числами
. Состояния (термы) с квантовыми числами 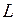 ,
, 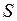 и
и 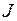 обозначаются аналогично состояниям атомов щелочных элементов (см. рис. 9.1, 10.4) с указанием мультиплетности
обозначаются аналогично состояниям атомов щелочных элементов (см. рис. 9.1, 10.4) с указанием мультиплетности 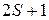 (вверху слева) и полного момента
(вверху слева) и полного момента 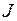 (внизу справа), например
(внизу справа), например 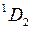 для
для 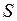 =0,
=0, 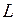 =2,
=2, 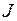 =2 и
=2 и 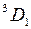 для
для 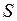 =1,
=1, 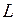 =2,
=2, 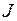 =1.
=1.
В модели 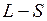 -связи энергия терма
-связи энергия терма 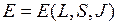 зависит от квантовых чисел
зависит от квантовых чисел 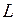 ,
, 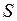 и
и 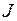 сложным образом. Для определения основного состояния (с наименьшей энергией) применяются эмпирические правила Хунда:
сложным образом. Для определения основного состояния (с наименьшей энергией) применяются эмпирические правила Хунда:
1. Из термов, принадлежащих данной электронной конфигурации, наименьшей энергией обладает терм с наибольшим возможным значением 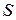 и с наибольшим возможным при таком
и с наибольшим возможным при таком 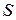 значении
значении 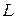 .
.
2. Мультиплеты, в которых с увеличением 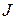 энергия возрастает, называются правильными (нормальными); они образуются, если электронами заполнено не более половины оболочки. Мультиплеты, в которых энергия возрастает с уменьшением
энергия возрастает, называются правильными (нормальными); они образуются, если электронами заполнено не более половины оболочки. Мультиплеты, в которых энергия возрастает с уменьшением 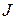 , называются обращенными; они образуются, если электронами заполнено более половины оболочки.
, называются обращенными; они образуются, если электронами заполнено более половины оболочки.
Полное число термов для данной электронной конфигурации одинаково для обоих типов связи. Различие между результатами их применения заключается в расположении и расстояниях между уровнями энергии термов.
Термы конфигурации 6snd ( 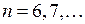 ) приведены в табл. 10.1.
) приведены в табл. 10.1.
Таблица 10.1
| Второй электрон в состоянии 6s | Первый электрон в состоянии nd ( | |||
|
|
| |||
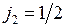
| 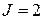
| 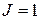
| 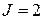
| 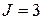
|
Обозначение по 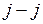 -связи -связи
| 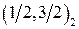
| 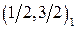
| 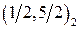
| 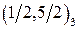
|
Обозначение по 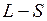 -связи -связи
| 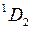
| 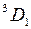
| 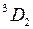
| 
|
Относительное расположение четырех атомных уровней (термов) конфигурации 6snd показано на рис. 10.2а. Группировка термов в терминах 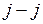 -связи является более упорядоченной по сравнению с группировкой по параметрам
-связи является более упорядоченной по сравнению с группировкой по параметрам 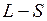 -связи. Это свидетельствует о лучшей применимости
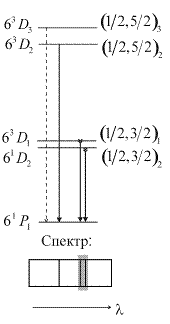
-связи. Это свидетельствует о лучшей применимости 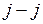 -связи в данном случае. Пример образования желтого дублета ртути, образующегося при переходе на принадлежащий электронной конфигурации 6s6p уровень
-связи в данном случае. Пример образования желтого дублета ртути, образующегося при переходе на принадлежащий электронной конфигурации 6s6p уровень 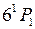 , показан на рис. 10.2б.
, показан на рис. 10.2б.
|
|
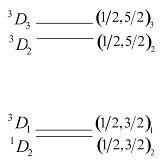 а
а
|  б
б
| Рис. 10.2. а) Относительное расположение четырех атомных уровней (термов) конфигурации 6snd; б) схема образования желтого дублета ртути, штриховой линией показан запрещенный переход. |
Разрешенные правилами отбора 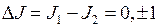 переходы показаны сплошными линиями. Штриховой линией показан переход с
переходы показаны сплошными линиями. Штриховой линией показан переход с 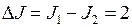 , запрещенный правилами отбора. Еще два примера подобных переходов, приводящих к образованию близко расположенных линий в ультрафиолетовой части спектра показаны на рис. 10.3. Они образуются при переходе на уровни
, запрещенный правилами отбора. Еще два примера подобных переходов, приводящих к образованию близко расположенных линий в ультрафиолетовой части спектра показаны на рис. 10.3. Они образуются при переходе на уровни 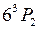 , и
, и 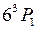 также принадлежащий электронной конфигурации 6s6p.
также принадлежащий электронной конфигурации 6s6p.
| Рис. 10.3. Схемы образования ультрафиолетовых триплета (а) и дублета (б) ртути, штриховой линией показан запрещенный переход. | 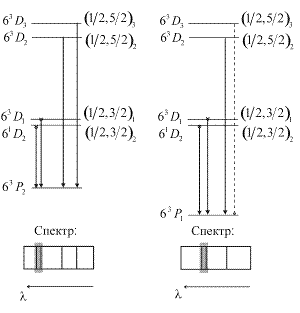 а б
а б
|
4. Тонкая структура уровней энергии атома ртути с конфигурацией внешних электронов 6 s 6 p в модели L - S -связи
Рассмотрим тонкую структуру уровней энергии двух электронов конфигураций 6snp в модели L-S-связи. В результате сложения спинов 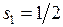 и
и 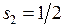 могут получиться два значения
могут получиться два значения 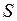 (10.9). При сложении ненулевого момента
(10.9). При сложении ненулевого момента 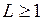 и
и 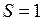 полный момент
полный момент 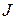 может принимать одно из трех значений (10.10). Конфигурации 6snp,
может принимать одно из трех значений (10.10). Конфигурации 6snp, 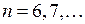 соответствуют 4 терма, энергии которых образуют 4 подуровня (см. табл. 10.2),
соответствуют 4 терма, энергии которых образуют 4 подуровня (см. табл. 10.2),
Таблица 10.2
| L | S | |||
| 0 | 1 | |||
| 1 | J=1 | J=2 | J=1 | J=0 |
Обозначение по 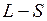 -связи -связи
| 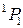
| 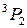
| 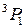
| 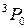
|
Правило Ланде дает закон изменения расстояний между уровнями с квантовыми числами 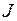 ,
, 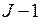 при заданных значениях
при заданных значениях 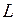 ,
, 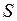
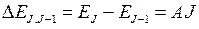 . (10.11)
. (10.11)
Для правильных (нормальных) мультиплетов 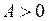 , для обращенных
, для обращенных 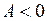 . Схема некоторых термов ртути с одним электронов в состоянии 6s показана на рис. 10.4. Наиболее яркие линии ртути: зеленая, сине-фиолетовая и фиолетовая (более интенсивная среди двух соседних линий) излучаются при переходе из терма 73S1 в термы правильного (нормального) триплета
. Схема некоторых термов ртути с одним электронов в состоянии 6s показана на рис. 10.4. Наиболее яркие линии ртути: зеленая, сине-фиолетовая и фиолетовая (более интенсивная среди двух соседних линий) излучаются при переходе из терма 73S1 в термы правильного (нормального) триплета  ,
, 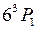 ,
, 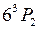 .
.
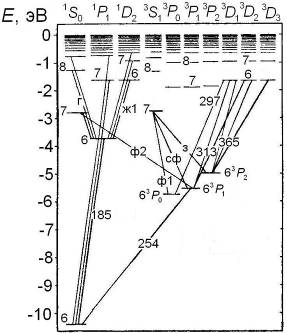
| Рис. 10.4. Схема некоторых термов ртути и переходов между ними, в разрывах стрелок указаны длины волн (в нм) или цвета спектральных линий: ж1 – одна из желтых линий, з – зеленая, г – голубая, сф – сине-фиолетовая, ф1 – более яркая фиолетовая, ф2 – более слабая фиолетовая |
|
|
|

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!