Рассмотренная выше модель ротатора соответствует двухатомной молекуле с нулевыми полным спином электронной подсистемы 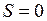 и нулевой проекцией полного орбитального электронного момента на ось молекулы
и нулевой проекцией полного орбитального электронного момента на ось молекулы 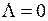 . Состояния молекулы ОН являются более сложными. Внутренние электроны атома кислорода при образовании молекулы ОН почти не меняют своего состояния и остаются на атомных орбиталях 1s (АО, см. работы 5, 6). Вместе с атомным ядром кислорода они образуют атомный остов (см. работы 6, 9). Внешние валентные электроны атомов водорода и кислорода обобществляются и в соответствии с принципом Паули занимают молекулярные состояния (оболочки), аналогичные атомным оболочкам и называемые молекулярными орбиталями (МО).
. Состояния молекулы ОН являются более сложными. Внутренние электроны атома кислорода при образовании молекулы ОН почти не меняют своего состояния и остаются на атомных орбиталях 1s (АО, см. работы 5, 6). Вместе с атомным ядром кислорода они образуют атомный остов (см. работы 6, 9). Внешние валентные электроны атомов водорода и кислорода обобществляются и в соответствии с принципом Паули занимают молекулярные состояния (оболочки), аналогичные атомным оболочкам и называемые молекулярными орбиталями (МО).
Межъядерное равновесное расстояние в молекуле гидроксила ОН сравнительно невелико (около 0,1 нм), поэтому молекулярные орбитали (МО) валентных электронов близки к атомным орбиталям (АО) в поле “объединенного ядра”, который получился бы при слиянии ядер О и Н в одно ядро. Для МО используются такие же обозначения, как и для молекулы водорода (см. работу 11): 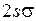 ,
, 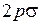 ,
, 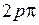 . По принципу Паули на
. По принципу Паули на  -орбиталях может находиться не более двух электронов (с противоположными спинами), на остальных орбиталях – не более четырех, для каждого из двух значений проекции спина на ось молекулы (
-орбиталях может находиться не более двух электронов (с противоположными спинами), на остальных орбиталях – не более четырех, для каждого из двух значений проекции спина на ось молекулы ( 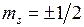 ) возможны два состояния с проекциями момента на ось (
) возможны два состояния с проекциями момента на ось ( 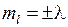 ), которым соответствуют два направления вращения электрона вокруг оси молекулы (см. рис. 11.1) в качественной классической картине. В основном состоянии молекулы ОН семь валентных электронов (1 от атома Н и 6 от атома О) имеют электронную конфигурацию
), которым соответствуют два направления вращения электрона вокруг оси молекулы (см. рис. 11.1) в качественной классической картине. В основном состоянии молекулы ОН семь валентных электронов (1 от атома Н и 6 от атома О) имеют электронную конфигурацию
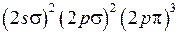 . (13.14)
. (13.14)
Схематичное изображение такого заселения электронами молекулярных уровней энергии показано на рис. 13.4а.
Рис. 13.4. Схематичное изображение заселения электронами уровней энергии молекулы ОН: основного терма 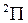 (а) и возбужденного терма (а) и возбужденного терма 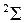 (б) (б)
| 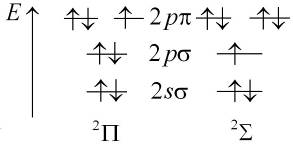 а б
а б
|
Направленными вниз и вверх стрелками условно показаны два возможных значения проекции спина электрона на ось молекулы  . Полностью заполненные молекулярные оболочки
. Полностью заполненные молекулярные оболочки 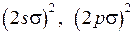 (как и в атомах) имеют нулевой полный спин
(как и в атомах) имеют нулевой полный спин 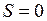 и нулевую полную проекцию орбитального момента на ось молекулы
и нулевую полную проекцию орбитального момента на ось молекулы 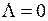 . Электронная конфигурация
. Электронная конфигурация 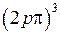 при добавлении четвертого электрона достраивается до замкнутой оболочки с равными нулю проекцией орбитального момента
при добавлении четвертого электрона достраивается до замкнутой оболочки с равными нулю проекцией орбитального момента 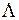 =0 и спином
=0 и спином 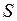 =0. Вакансию (отсутствие) электрона на оболочке
=0. Вакансию (отсутствие) электрона на оболочке 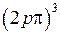 называют дыркой аналогично дырке в полупроводниках (см. работу 15) и дырке в атомной оболочке иона инертного элемента, (см. работу 10) и приписывают ей те же значения орбитального момента и спина, что и у добавляемого электрона
называют дыркой аналогично дырке в полупроводниках (см. работу 15) и дырке в атомной оболочке иона инертного элемента, (см. работу 10) и приписывают ей те же значения орбитального момента и спина, что и у добавляемого электрона 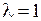 ,
, 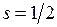 . Поэтому свойства основного состояния молекулы ОН определяются дыркой на оболочке
. Поэтому свойства основного состояния молекулы ОН определяются дыркой на оболочке 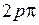 :
: 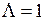 ,
, 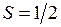 . Молекулярные термы с проекцией полного момента на ось молекулы
. Молекулярные термы с проекцией полного момента на ось молекулы 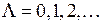 обозначаются заглавными греческими буквами
обозначаются заглавными греческими буквами 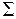 ,
, 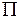 ,
, 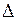 ,…, основной терм молекулы ОН имеет обозначение
,…, основной терм молекулы ОН имеет обозначение 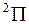 . Как и в обозначениях атомных термов, вверху слева от символа указывается мультиплетности
. Как и в обозначениях атомных термов, вверху слева от символа указывается мультиплетности 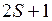 (для основного состояния
(для основного состояния 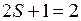 ). При переходе электрона с молекулярной орбитали
). При переходе электрона с молекулярной орбитали 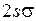 на орбиталь
на орбиталь 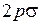 образуется возбужденное состояние молекулы ОН с конфигурацией
образуется возбужденное состояние молекулы ОН с конфигурацией
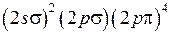 , (13.15)
, (13.15)
которой соответствует терм 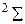 (см. рис. 13.4б).
(см. рис. 13.4б).
Полный электронный момент 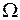 молекулы образуется при сложении орбитального момента
молекулы образуется при сложении орбитального момента 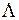 и спина
и спина 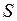 по правилу сложения моментов
по правилу сложения моментов
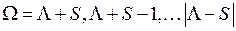 , (13.16)
, (13.16)
аналогично сложению моментов в атомах (см. работы 9, 10). Значение 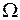 , как и для атомов, при обозначении терма указывается справа внизу, например, полное обозначение терма возбужденного состояния
, как и для атомов, при обозначении терма указывается справа внизу, например, полное обозначение терма возбужденного состояния 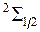 . У терма основного состояния
. У терма основного состояния 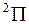 возможны два значения
возможны два значения 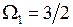 и
и 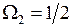 . Дублет
. Дублет 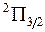 ,
, 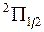 , подобен дублетам
, подобен дублетам 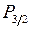 ,
, 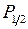 атома натрия и иона неона Ne+ (см. работы 9, 10). Поскольку самая верхняя МО
атома натрия и иона неона Ne+ (см. работы 9, 10). Поскольку самая верхняя МО 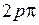 терма
терма 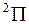 заполнена более чем наполовину, у молекулы ОН образуется обращенный дублет (как и у иона Ne+) – энергия терма
заполнена более чем наполовину, у молекулы ОН образуется обращенный дублет (как и у иона Ne+) – энергия терма 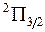 меньше, чем терма
меньше, чем терма 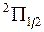 .
.
Колебательная энергия молекулы принимает дискретный ряд значений. Для низколежащих уровней применима формула линейного осциллятора
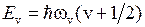 ,
, 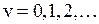 , (13.17)
, (13.17)
где 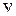 − колебательное квантовое число. Более точная формула для энергий колебательных уровней имеет вид
− колебательное квантовое число. Более точная формула для энергий колебательных уровней имеет вид
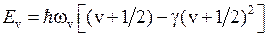 ,
, 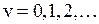 ,
, 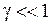 , (13.18)
, (13.18)
где параметр 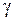 называется коэффициентом ангармоничности. Значения длин волн
называется коэффициентом ангармоничности. Значения длин волн 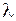 и относительные вероятности
и относительные вероятности 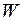 электронно-колебательных переходов
электронно-колебательных переходов 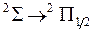 из состояния с колебательным квантовым числом
из состояния с колебательным квантовым числом 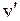 в состояния с колебательным квантовым числом
в состояния с колебательным квантовым числом 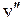 молекулы ОН приведены в табл. 13.1.
молекулы ОН приведены в табл. 13.1.
Таблица 13.1
| 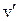
| 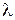 , нм , нм
| Относительная вероятность 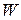
|
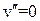
| 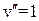
| 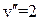
| 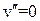
| 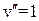
| 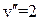
|
| 0
1
2
| 305,4
281,1
260,8
| 342,8
312,2
287,5
|
348,4
318,5
| 1,0
0,15
0,001
| 0,06
0,75
0,27
| 0,005
0,09
0,55
|
Из табл. 13.1 видно, что спектры нескольких наиболее вероятных колебательных переходов перекрываются вблизи 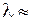 300 нм, что делает спектр излучения молекулы ОН весьма сложным.
300 нм, что делает спектр излучения молекулы ОН весьма сложным.
Вращательные энергии электронных состояний молекулы ОН 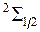 и
и 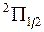 ,
, 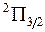 задаются формулами более сложными, чем (13.3), что еще более усложняет вид спектра ОН [20, 24, 25]. В нем будут присутствовать несколько интенсивных перекрывающихся полос с четкими интенсивными кантами со стороны более коротких длин волн (см. рис. 13.5).
задаются формулами более сложными, чем (13.3), что еще более усложняет вид спектра ОН [20, 24, 25]. В нем будут присутствовать несколько интенсивных перекрывающихся полос с четкими интенсивными кантами со стороны более коротких длин волн (см. рис. 13.5).

Рис. 13.5. Полосатый спектр изучения молекулы ОН вместе со сплошным спектром молекулы Н2 и линиями ртути и натрия
Одна из вращательных полос спектра небольшой интенсивности, называемая полосой R21, полностью располагается справа от кантов (см. рис. 13.6). Для измерений доступны несколько ее линий, начиная с первой.

| Рис. 13.6. Увеличенное изображение фотопластинки с фрагментом полосатого спектра молекулы ОН со слабой полосой R21
|
Малая интенсивность этой полосы обусловлена небольшой вероятностью соответствующих переходов из-за изменения при них взаимной ориентации полного (орбитального и спинового) момента электрона и орбитального момента вращения ядер. По правилу отбора полный момент молекулы, складывающийся из этих двух моментов, при излучении фотона уменьшается на единицу. Но из-за дополнительного изменения электронного момента орбитальный момент вращения ядер и их вращательная энергия уменьшаются сильнее по сравнению с остальными R-, P- и Q- ветвями, у которых изменение орбитального момента соответствует 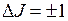 . Это приводит к дополнительному увеличению энергии излучаемых фотонов. В результате линии ветви R21 сдвигаются в сторону более коротких длин волн, выходят из области перекрытия интенсивных ветвей и могут дать полезную информацию о свойствах молекулы ОН.
. Это приводит к дополнительному увеличению энергии излучаемых фотонов. В результате линии ветви R21 сдвигаются в сторону более коротких длин волн, выходят из области перекрытия интенсивных ветвей и могут дать полезную информацию о свойствах молекулы ОН.
Изменение вращательной энергии 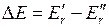 для первых линий ветви R21 (при слабом вращении) дается выражением (подробнее см. в [20,24,25,26])
для первых линий ветви R21 (при слабом вращении) дается выражением (подробнее см. в [20,24,25,26])
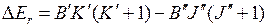 , (13.19)
, (13.19)
где квантовые числа начального и конечного состояний принимают значения
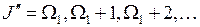
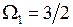 , (13.20)
, (13.20)
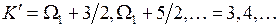 . (13.21)
. (13.21)
После упрощения с учетом 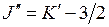 получим
получим
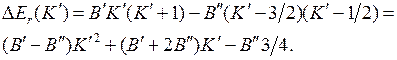 , (13.22)
, (13.22)
Обозначим 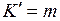 ,
, 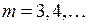 , тогда при
, тогда при 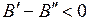 энергии фотонов равны
энергии фотонов равны
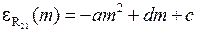 ,
, 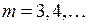 ,
, 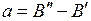 ,
, 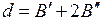 , (13.23)
, (13.23)
а точки с координатами ( 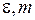 ) располагаются на параболе, подобной R-ветви на рис. 13.3б. Первая линия удалена от начала полосы (точки с
) располагаются на параболе, подобной R-ветви на рис. 13.3б. Первая линия удалена от начала полосы (точки с 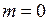 ) на промежуток примерно равный 3d. Расстояния между соседними линиями полосы (разности энергий фотонов), изменяются по линейному закону
) на промежуток примерно равный 3d. Расстояния между соседними линиями полосы (разности энергий фотонов), изменяются по линейному закону
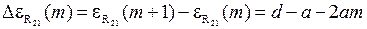 . (13.24)
. (13.24)





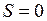 и нулевой проекцией полного орбитального электронного момента на ось молекулы
и нулевой проекцией полного орбитального электронного момента на ось молекулы 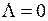 . Состояния молекулы ОН являются более сложными. Внутренние электроны атома кислорода при образовании молекулы ОН почти не меняют своего состояния и остаются на атомных орбиталях 1s (АО, см. работы 5, 6). Вместе с атомным ядром кислорода они образуют атомный остов (см. работы 6, 9). Внешние валентные электроны атомов водорода и кислорода обобществляются и в соответствии с принципом Паули занимают молекулярные состояния (оболочки), аналогичные атомным оболочкам и называемые молекулярными орбиталями (МО).
. Состояния молекулы ОН являются более сложными. Внутренние электроны атома кислорода при образовании молекулы ОН почти не меняют своего состояния и остаются на атомных орбиталях 1s (АО, см. работы 5, 6). Вместе с атомным ядром кислорода они образуют атомный остов (см. работы 6, 9). Внешние валентные электроны атомов водорода и кислорода обобществляются и в соответствии с принципом Паули занимают молекулярные состояния (оболочки), аналогичные атомным оболочкам и называемые молекулярными орбиталями (МО).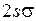 ,
, 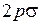 ,
, 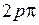 . По принципу Паули на
. По принципу Паули на  -орбиталях может находиться не более двух электронов (с противоположными спинами), на остальных орбиталях – не более четырех, для каждого из двух значений проекции спина на ось молекулы (
-орбиталях может находиться не более двух электронов (с противоположными спинами), на остальных орбиталях – не более четырех, для каждого из двух значений проекции спина на ось молекулы ( 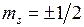 ) возможны два состояния с проекциями момента на ось (
) возможны два состояния с проекциями момента на ось ( 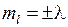 ), которым соответствуют два направления вращения электрона вокруг оси молекулы (см. рис. 11.1) в качественной классической картине. В основном состоянии молекулы ОН семь валентных электронов (1 от атома Н и 6 от атома О) имеют электронную конфигурацию
), которым соответствуют два направления вращения электрона вокруг оси молекулы (см. рис. 11.1) в качественной классической картине. В основном состоянии молекулы ОН семь валентных электронов (1 от атома Н и 6 от атома О) имеют электронную конфигурацию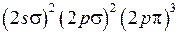 . (13.14)
. (13.14)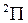 (а) и возбужденного терма
(а) и возбужденного терма 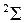 (б)
(б)
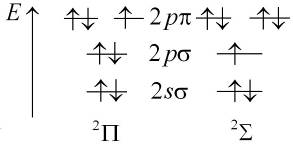 а б
а б
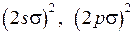 (как и в атомах) имеют нулевой полный спин
(как и в атомах) имеют нулевой полный спин 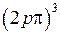 при добавлении четвертого электрона достраивается до замкнутой оболочки с равными нулю проекцией орбитального момента
при добавлении четвертого электрона достраивается до замкнутой оболочки с равными нулю проекцией орбитального момента 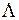 =0 и спином
=0 и спином 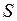 =0. Вакансию (отсутствие) электрона на оболочке
=0. Вакансию (отсутствие) электрона на оболочке 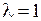 ,
, 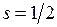 . Поэтому свойства основного состояния молекулы ОН определяются дыркой на оболочке
. Поэтому свойства основного состояния молекулы ОН определяются дыркой на оболочке 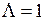 ,
, 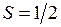 . Молекулярные термы с проекцией полного момента на ось молекулы
. Молекулярные термы с проекцией полного момента на ось молекулы 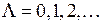 обозначаются заглавными греческими буквами
обозначаются заглавными греческими буквами 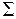 ,
, 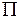 ,
, 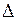 ,…, основной терм молекулы ОН имеет обозначение
,…, основной терм молекулы ОН имеет обозначение 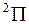 . Как и в обозначениях атомных термов, вверху слева от символа указывается мультиплетности
. Как и в обозначениях атомных термов, вверху слева от символа указывается мультиплетности 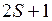 (для основного состояния
(для основного состояния 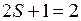 ). При переходе электрона с молекулярной орбитали
). При переходе электрона с молекулярной орбитали 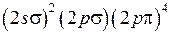 , (13.15)
, (13.15)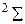 (см. рис. 13.4б).
(см. рис. 13.4б).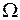 молекулы образуется при сложении орбитального момента
молекулы образуется при сложении орбитального момента 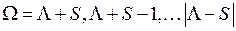 , (13.16)
, (13.16)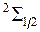 . У терма основного состояния
. У терма основного состояния 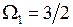 и
и 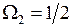 . Дублет
. Дублет 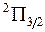 ,
, 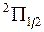 , подобен дублетам
, подобен дублетам 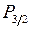 ,
, 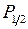 атома натрия и иона неона Ne+ (см. работы 9, 10). Поскольку самая верхняя МО
атома натрия и иона неона Ne+ (см. работы 9, 10). Поскольку самая верхняя МО 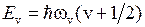 ,
, 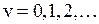 , (13.17)
, (13.17)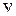 − колебательное квантовое число. Более точная формула для энергий колебательных уровней имеет вид
− колебательное квантовое число. Более точная формула для энергий колебательных уровней имеет вид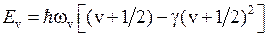 ,
, 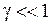 , (13.18)
, (13.18)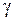 называется коэффициентом ангармоничности. Значения длин волн
называется коэффициентом ангармоничности. Значения длин волн 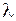 и относительные вероятности
и относительные вероятности 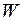 электронно-колебательных переходов
электронно-колебательных переходов 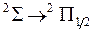 из состояния с колебательным квантовым числом
из состояния с колебательным квантовым числом 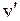 в состояния с колебательным квантовым числом
в состояния с колебательным квантовым числом 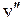 молекулы ОН приведены в табл. 13.1.
молекулы ОН приведены в табл. 13.1.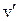
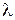 , нм
, нм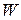
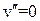
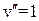
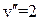
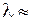 300 нм, что делает спектр излучения молекулы ОН весьма сложным.
300 нм, что делает спектр излучения молекулы ОН весьма сложным.

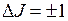 . Это приводит к дополнительному увеличению энергии излучаемых фотонов. В результате линии ветви R21 сдвигаются в сторону более коротких длин волн, выходят из области перекрытия интенсивных ветвей и могут дать полезную информацию о свойствах молекулы ОН.
. Это приводит к дополнительному увеличению энергии излучаемых фотонов. В результате линии ветви R21 сдвигаются в сторону более коротких длин волн, выходят из области перекрытия интенсивных ветвей и могут дать полезную информацию о свойствах молекулы ОН.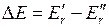 для первых линий ветви R21 (при слабом вращении) дается выражением (подробнее см. в [20,24,25,26])
для первых линий ветви R21 (при слабом вращении) дается выражением (подробнее см. в [20,24,25,26])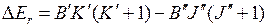 , (13.19)
, (13.19)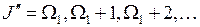
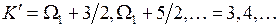 . (13.21)
. (13.21)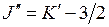 получим
получим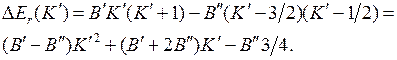 , (13.22)
, (13.22)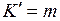 ,
, 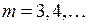 , тогда при
, тогда при 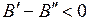 энергии фотонов равны
энергии фотонов равны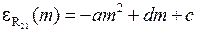 ,
, 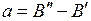 ,
, 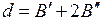 , (13.23)
, (13.23) ) располагаются на параболе, подобной R-ветви на рис. 13.3б. Первая линия удалена от начала полосы (точки с
) располагаются на параболе, подобной R-ветви на рис. 13.3б. Первая линия удалена от начала полосы (точки с 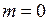 ) на промежуток примерно равный 3d. Расстояния между соседними линиями полосы (разности энергий фотонов), изменяются по линейному закону
) на промежуток примерно равный 3d. Расстояния между соседними линиями полосы (разности энергий фотонов), изменяются по линейному закону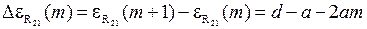 . (13.24)
. (13.24)


