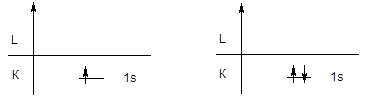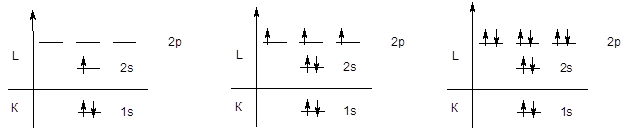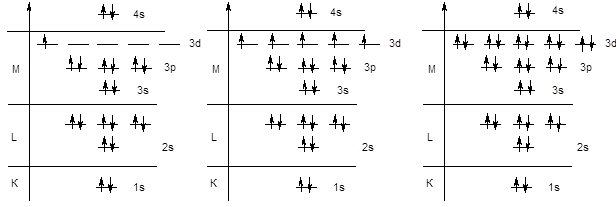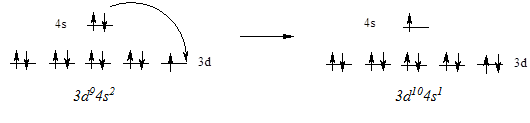Как уже отмечалось, строгое решение уравнения Шредингера возможно только для одноэлектронных частиц. По этой причине для описания электронных оболочек многоэлектронных атомов приходится прибегать к ряду упрощений и приближений.
Принцип водородного приближения. Согласно этому принципу электронную оболочку многоэлектронного атома можно описать набором орбиталей, а соответственно набором квантовых чисел атома водорода.
Принцип минимальной энергии - электроны заполняют орбитали в порядке увеличения их энергии.
В отличие от атома водорода, в многоэлектронном атоме реализуется межэлектронное отталкивание. Это взаимодействие является причиной двух эффектов, влияющих на распределение электронов в электронной оболочке.
Эффект экранирования ядра. В многоэлектронном атоме электроны внешнего электронного слоя испытывают отталкивание со стороны электронов более глубоких внутренних слоев, в результате чего энергия валентных электронов повышается, а их связь с ядром ослабевает. Так, для атома натрия ядро с зарядом +11 экранируют 10 электронов, находящихся на 1s-, 2s- и 2р-подуровнях. Если бы в атоме натрия имел место только эффект экранирования, на валентный электрон действовал бы заряд +1.
Эффект проникновения электрона к ядру. Вероятностная модель атома предполагает, что электрон может находиться на любом расстоянии от ядра, хотя и с разной вероятностью. Наиболее вероятное расстояние между ядром и электроном определяется положением главного максимума на кривой радиальной вероятности. Однако любой электрон, в том числе и валентный, часть времени пребывает на меньших расстояниях от ядра, как бы погружаясь во внутренние слои электронов. При этом энергия электрона уменьшается, а притяжение его ядром усиливается.
Кажущийся заряд ядра, соответственно которому ядро действует на внешние электроны, называется эффективным зарядом ядра (Z эф):
Zэф = Z - S,
где Z - истинный заряд ядра, а S - константа экранирования, значение которой определяется характером внутренних подуровней, заполненных электронами. Для атома натрия, например, Z эф = 2,06 эл.ед.
Графики радиального распределения вероятности (рис. 2) наглядно показывают величину эффекта проникновения: чем больше максимумов, тем больше эффект. Число максимумов на кривой радиальной вероятности равно (n-l). В результате эффект проникновения электрона к ядру максимален для s-электронов, меньше для р-электронов и еще меньше для d-электронов. Поскольку проникновение электрона к ядру понижает энергию орбитали, энергия подуровней многоэлектронного атома при одинаковом значении n будет возрастать в ряду Ens<Enp<End....
Если сравниваемые подуровни принадлежат разным уровням, то для оценки их энергии необходимо одновременно учитывать главное и орбитальное квантовые числа. Оба эти фактора для большинства атомов позволяют учесть правила, сформулированные В.М. Клечковским: энергетические подуровни многоэлектронного атома заполняются электронами в порядке возрастания суммы главного и орбитального квантовых чисел; при равных значениях суммы (n + l ) сначала заполняется подуровень с меньшим значением главного квантового числа.
Рассчитаем суммы (n + l) для орбиталей первых четырех энергетических уровней и определим порядок возрастания их энергии:
| Уровень
| Орбиталь
| n
| l
| n + l
| Уровень
| Орбиталь
| n
| l
| n + l
|
|
| 1s
|
|
|
|
| 4s
|
|
|
|
| 4p
|
|
|
|
|
| 2s
|
|
|
| 4d
|
|
|
|
| 2p
|
|
|
| 4f
|
|
|
|
|
| 3s
|
|
|
|
| 5s
|
|
|
|
| 5p
|
|
|
|
| 3p
|
|
|
| 5d
|
|
|
|
| 3d
|
|
|
| 5f
|
|
|
|
Согласно правилам Клечковского энергия орбиталей будет увеличиваться в следующем порядке:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d...
Энергетическая диаграмма электронных орбиталей имеет вид:

Принцип запрета Паули - невозможно существование двух электронов с одинаковым набором квантовых чисел. Квантовые числа n, l и ml являются характеристикой орбитали и автоматически передаются ее электронам, а спиновое квантовое число электрона фиксировано (s = 1/2). Отсюда следует, что электроны, расположенные на одной орбитали, могут различаться только значением магнитного спинового квантового числа. Поскольку спиновое магнитное квантовое число электрона принимает два значения (ms = ±1/2), на одной орбитали могут одновременно находиться только два электрона с разной ориентацией спина. Ограниченная емкость орбитали влечет за собой ограниченную емкость энергетических подуровней и уровней:
| Подуровень
| Число
электронов
| Уровень
| Число
Электронов
|
| s
|
| 1 (K-слой)
|
|
| p
|
| 2 (L-слой)
|
|
| d
|
| 3 (M-слой)
|
|
| f
|
| 4 (N-слой)
|
|
Правило Хунда - при заполнении энергетического подуровня электроны стремятся занять максимальное число орбиталей, ориентируя спин параллельно. Например, при реализации конфигурации p3 электроны занимают орбитали следующим образом:

Исходя из рассмотренных принципов, рассмотрим строение электронных оболочек атомов элементов периодической системы Д.И. Менделеева.
Первый периодпредставлен двумя элементами - водородом и гелием, у которых заполняется первый энергетический уровень.
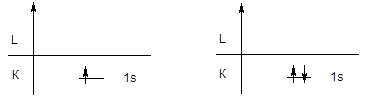
H 1s1 He 1s2
При составлении электронной формулы атома или другой атомной частицы числом указывается главное квантовое число, буквой - орбитальное квантовое число и верхним индексом - число электронов на подуровне.
Поскольку емкость первого уровня ограничена двумя электронами, следующий элемент - литий начинаетвторой период, у элементов которого происходит последовательное заполнение второго энергетического уровня, начиная с конфигурации 1s22s1 (Li) и заканчивая конфигурацией 1s22s22p6 (Ne).
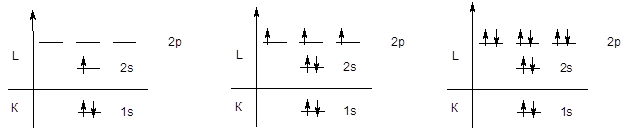
Li 1s22s1 ...... N 1s22s22p3 ....... Ne 1s22s22p6
Аналогичным образом происходит заполнение s и p-подуровней третьего энергетического уровня у элементов третьего периода.

Na KL3s1 ...... P KL3s23p3 ...... Ar KL3s23p6
Далее следовало ожидать заполнения орбиталей 3d-подуровня, однако у элементов четвертого периода начинается заполнение четвертого уровня, поскольку энергия 4s-подуровня ниже, чем энергия 3d-орбиталей - K (KL3s23p64s1), Ca (KL3s23p64s2). После заполнения 4s-орбитали, в соответствии с правилами Клечковского, начинается заполнение 3d-подуровня. Поскольку d-подуровень вмещает 10 электронов, этот процесс охватывает 10 элементов от скандия до цинка.
Следует обратить внимание на то обстоятельство, что в электронной формуле указывается не порядок заполнения подуровней, а их конфигурация. Поэтому подуровень 3d записывается перед подуровнем 4s, хотя последний заполняется раньше.
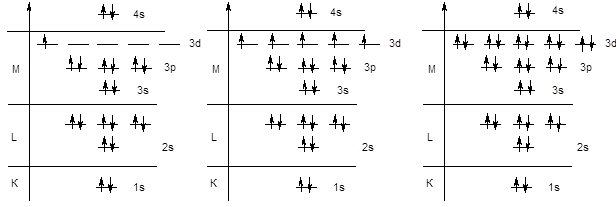
Sc KL3s23p63d14s2 .... Mn KL3s23p63d54s2 .... Zn KL3s23p63d104s2
Аналогичным образом происходит заполнение орбиталей атомов элементов пятого периода. У элементов шестого периода после заполнения подуровня 6s начинается заполнение 5d-орбиталей (La KLM4s24p64d105s25p65d16s2) вместо ожидаемого заполнения подуровня 4f (нарушение правил Клечковского). Тем не менее, у последующих за лантаном элементов (лантанидов), происходит закономерное заполнение 4f-орбиталей от 4f2 у церия до 4f14 у иттербия.
Нарушение ожидаемого порядка заполнения атомных орбиталей наблюдается в ряде мест периодической системы. Например, атом меди имеет электронную конфигурацию KL3s23p63d104s1 вместо ожидаемой KL3s23p63d94s2. Эта и аналогичные ей аномалии связаны со стремлением атома приобрести полностью (d10) или наполовину (d5) завершенный энергетический подуровень, обладающий повышенной устойчивостью. При этом электрон внешнего энергетического уровня как бы проваливается на предыдущий подуровень, что и обусловило название явления - провал электрона.
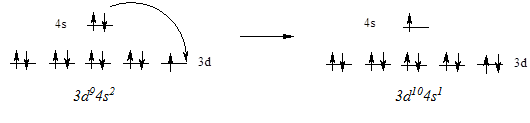
ХИМИЧЕСКАЯ СВЯЗЬ