Основы теории кристаллического поля были заложены в 1929 году Бете. В дальнейшем она была развита в работах Ван-Флека, Хартмана и Оргела. Эта теория применима как для кристаллов, так и для координационных соединений.
Теория кристаллического поля (ТКП) предполагает, что основным фактором, стабилизирующим координационное соединение, является электростатическое взаимодействие центрального атома с лигандами, являющимися либо отрицательно заряженными ионами, либо полярными молекулами. При описании этого взаимодействия центральный атом рассматривается с детальным учетом его электронной структуры. Лиганды же фигурируют как бесструктурные источники внешнего электростатического поля определенной симметрии. Электростатическое воздействие лигандов изменяет энергию орбиталей центрального атома, что в свою очередь влияет на свойства координационного соединения.
Рассмотрим взаимодействие d-орбиталей центрального атома с электростатическим полем, создаваемым лигандами в октаэдрическом комплексе. Поместим центральный атом в центре координат, а лиганды - на координатных осях.

При надлежащем выборе системы координат орбитали  и
и 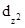 центрального иона направлены вдоль осей координат прямо к лигандам. Очевидно, что это приведет к повышению энергии этих d-орбиталей в результате увеличения отталкивания между электронами и несущими отрицательный заряд лигандами. Орбитали dxy, dyz, dxz, ориентированные по биссектрисам координатных углов, "лобового" взаимодействия с лигандами не испытывают, и их энергия будет снижаться.
центрального иона направлены вдоль осей координат прямо к лигандам. Очевидно, что это приведет к повышению энергии этих d-орбиталей в результате увеличения отталкивания между электронами и несущими отрицательный заряд лигандами. Орбитали dxy, dyz, dxz, ориентированные по биссектрисам координатных углов, "лобового" взаимодействия с лигандами не испытывают, и их энергия будет снижаться.

Таким образом, если внести ЦА в поле сферической симметрии, энергия всех d-орбиталей повысится одинаково, в результате чего пятикратное вырождение уровня сохранится. Если же сосредоточить отрицательные заряды в вершинах октаэдра, пятикратно вырожденный d-подуровень расщепится на два (рис. 18). Энергия  и
и 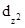 орбиталей, ориентированных по координатным осям и сильно сближающихся с лигандами, повысится, они образуют двукратно вырожденный уровень eg. Орбитали dxy, dxz и dyz образуют трехкратно вырожденный уровень t2g, энергия которого ниже энергии уровня eg. Расщепление d-подуровня не сказывается на общей энергии пяти d-орбиталей, поскольку повышение энергии системы за счет двух eg-орбиталей равно понижению энергии тремя орбиталями уровня t2g. Разность энергии уровней eg и t2g называется параметром расщепления (Dокт или 10Dq).
орбиталей, ориентированных по координатным осям и сильно сближающихся с лигандами, повысится, они образуют двукратно вырожденный уровень eg. Орбитали dxy, dxz и dyz образуют трехкратно вырожденный уровень t2g, энергия которого ниже энергии уровня eg. Расщепление d-подуровня не сказывается на общей энергии пяти d-орбиталей, поскольку повышение энергии системы за счет двух eg-орбиталей равно понижению энергии тремя орбиталями уровня t2g. Разность энергии уровней eg и t2g называется параметром расщепления (Dокт или 10Dq).

Рис. 18. Расщепление d-подуровня центрального атома
в октаэдрическом поле.
Рассмотрим расщепление d-подуровня в тетраэдрическом поле. Впишем в куб тетраэдр, ориентируя координатные оси к центру граней этого куба (рис. 19), и расположим в принятой системе координат d-орбитали. По характеру взаимодействия с полем лигандов они разделятся на две группы. Орбитали  и
и 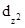 (уровень e) будут ориентированы между лигандами, их энергия понизится. Орбитали dxy, dxz и dyz (уровень t2) направлены ближе к лигандам, энергия этих орбиталей повысится. Энергетическая диаграмма расщепления d-уровня в тетраэдрическом поле приведена на рис. 20.
(уровень e) будут ориентированы между лигандами, их энергия понизится. Орбитали dxy, dxz и dyz (уровень t2) направлены ближе к лигандам, энергия этих орбиталей повысится. Энергетическая диаграмма расщепления d-уровня в тетраэдрическом поле приведена на рис. 20.


Рис. 20. Расщепление d-подуровня в тетраэдрическом поле лигандов.
Параметр расщепления является важной характеристикой комплекса. Его значения для различных комплексов колеблются в пределах от 100 до 400 кДж/моль и зависят от следующих факторов:
1. Симметрия кристаллического поля. Так, Dтетр = 4/9 Dокт.
2. Природа центрального атома. Различным центральным атомам при одинаковой симметрии кристаллического поля и одинаковых лигандах отвечают разные значения параметра расщепления. Так, для октаэдрического поля значения Dокт возрастают в ряду:
Mn(II) < Co(II) ≈ Ni(II) < V(II) < Fe(III) < Cr(III) < Mn(IV) <
< Mo(III) < Rh(III) < Ir(III) < Re(IV) < Pt(IV)
3. Природа лиганда. Значения параметра расщепления возрастают в ряду:
I- < Br- < Cl- < S CN- < F- < OH- < H2O < N CS- < C N - < NH3 <
< en < N O  < C N-
< C N-
Этот ряд называется спектрохимическим рядом лигандов (подчеркнут донорный атом лиганда).
Рис. 19. Ориентация d-орбиталей в
тетраэдрическом поле лигандов.
Теория кристаллического поля может быть использована для решения ряда практических задач. Так, эта теория позволяет прогнозировать, будет ли данный комплекс высокоспиновым или низкоспиновым, и количественно оценить магнитные свойства комплексов. Эти вопросы ТКП решает путем сопоставления двух энергетических характеристик: параметра расщепления и энергии образования неподеленной электронной пары на орбитале ЦА.
Рассмотрим этот вопрос на примере комплексных катионов кобальта(III), отвечающих формулам [CoF6]3- и [Co(NH3)6]3+. Оба эти комплекса являются октаэдрическими; параметр расщепления составляет 156 кДж/моль для фторидного и 265 кДж/моль для аммиачного комплекса. Энергия образования электронной пары (P) для иона Со3+ составляет 251 кДж/моль. Для [CoF6]3- DF- < P, в силу чего переход электрона с t2g-уровня на eg-уровень энергетически выгоднее образования электронной пары на t2g-уровне (рис. 21). Комплексный анион [CoF6]3- будет высокоспиновым (случай слабого поля). Для [Co(NH3)6]3+  > P, в результате чего энергетически выгодным становится спаривание электронов на t2g-орбиталях ЦА (рис.21) и образование низкоспинового комплекса (случай сильного поля).
> P, в результате чего энергетически выгодным становится спаривание электронов на t2g-орбиталях ЦА (рис.21) и образование низкоспинового комплекса (случай сильного поля).

Высокоспиновый Низкоспиновый
комплекс [CoF6]3- комплекс[Co(NH3)6]3+
Рис. 21. Распределение электронов октаэдрических комплексах кобальта(III).
Теория кристаллического поля позволяет ответить на вопрос, почему координационные соединения могут быть окрашенными. Окраска химического соединения связана со способностью последнего поглощать кванты лучистой энергии, соответствующие электронным переходам в частице. Чаcтица при этом приобретает цвет, дополнительный к поглощенному. Энергии, соответствующие параметру расщепления, отвечают энергии квантов видимой части спектра, отсюда можно ожидать, что координационные соединения будут окрашены, если в них возможны электронные переходы типа t2g ® еg.
Например, титан(III) и титан(IV) образуют октаэдрические аквакомплексы. Комплексный катион [Ti(H2O)6]3+ окрашен в пурпурно-фиолетовый цвет, [Ti(H2O)6]4+ - бесцветен. Ион Тi3+ имеет конфигурацию d1 и для него возможен переход t2g ® еg с энергией, равной параметру расщепления (238 кДж/моль). Такой переход отвечает поглощению квантов желто-зеленой части спектра, что обусловливает фиолетовую окраску комплекса. Тогда как катион Тi4+ имеет конфигурацию d0, и переход t2g ®еg для него невозможен. По той же причине бесцветны комплексы центральных атомов с конфигурацией d10 (Zn2+, Cd2+ и др.).
Теории кристаллического поля присущи и определенные недостатки. Главным из них является то, что эта теория сводит взаимодействие в комплексе к электростатическому и пренебрегает возможностью образования ковалентных связей между центральным атомом и лигандами.
РАСТВОРЫ






 и
и 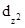 центрального иона направлены вдоль осей координат прямо к лигандам. Очевидно, что это приведет к повышению энергии этих d-орбиталей в результате увеличения отталкивания между электронами и несущими отрицательный заряд лигандами. Орбитали dxy, dyz, dxz, ориентированные по биссектрисам координатных углов, "лобового" взаимодействия с лигандами не испытывают, и их энергия будет снижаться.
центрального иона направлены вдоль осей координат прямо к лигандам. Очевидно, что это приведет к повышению энергии этих d-орбиталей в результате увеличения отталкивания между электронами и несущими отрицательный заряд лигандами. Орбитали dxy, dyz, dxz, ориентированные по биссектрисам координатных углов, "лобового" взаимодействия с лигандами не испытывают, и их энергия будет снижаться.



 < C N-
< C N- > P, в результате чего энергетически выгодным становится спаривание электронов на t2g-орбиталях ЦА (рис.21) и образование низкоспинового комплекса (случай сильного поля).
> P, в результате чего энергетически выгодным становится спаривание электронов на t2g-орбиталях ЦА (рис.21) и образование низкоспинового комплекса (случай сильного поля).



