

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Одной из важнейших задач, решаемых термодинамикой, является установление принципиальной возможности (или невозможности) самопроизвольного протекания химического процесса.
Как указывалось ранее, протеканию химического процесса благоприятствует повышение энтропии системы. Повышение энтропии достигается разобщением частиц, разрывом химических связей, разрушением кристаллических решеток, растворением веществ и т.д. Однако все эти процессы неизбежно сопровождаются повышением энтальпии системы, что препятствует протеканию процесса. Очевидно, что для решения вопроса о принципиальной возможности протекания химического процесса необходимо одновременно учесть изменение и энтропии, и энтальпии системы. При постоянной температуре и давлении для этой цели используется термодинамическая функция, называемая свободной энергией Гиббса (иногда просто энергией Гиббса). Свободная энергия Гиббса (G) cвязана с энтальпией и энтропией следующим уравнением:
G = H - TS
Изменение энергии Гиббса при переходе системы из начального состояния в конечное определяется соотношением:
ΔG = ΔH - TΔS
Поскольку уравнение справедливо для процессов, протекающих при постоянных температуре и давлении, функцию G называют изобарно-изотермическим потенциалом. В полученном уравнении величина ΔН оценивает влияние энтальпийного фактора, а величина ТΔS - энтропийного фактора на возможность протекания процесса. По своему физическому смыслу свободная энергия Гиббса - это та часть ΔН, которая при определенных условиях может быть превращена в работу, совершаемую системой против внешних сил. Остальная часть ΔН, равная ТΔS, представляет "несвободную" энергию, которая идет на повышение энтропии системы и в работу превращена быть не может. Свободная энергия Гиббса - это своеобразный потенциал, определяющий движущую силу химического процесса. Подобно физическим потенциалам (электрическому, гравитационному) энергия Гиббса уменьшается по мере самопроизвольного протекания процесса до тех пор, пока не достигнет минимального значения, после чего процесс прекратится.
|
|
Пусть в системе при постоянных давлении и температуре cамопроизвольно протекает какая-то реакция (неравновесный процесс). В этом случае ΔH < TΔS, соответственно ΔG <0. Таким образом, изменение функции Гиббса может служить критерием при определении направления протекания реакций: в изолированной или закрытой системе при постоянной температуре и давлении самопроизвольно протекают реакции, для которых изменение свободной энергии Гиббса отрицательно (ΔG < 0).
Пусть протекающая в системе реакция обратима. Тогда при заданных условиях прямая реакция принципиально осуществима, если ΔG < 0, а обратная - если ΔG > 0; при ΔG = 0 система будет находиться в состоянии равновесия. Для изолированных систем ΔН = 0, поэтому ΔG = - TΔS. Таким образом, в изолированной системе самопроизвольно протекают процессы, приводящие к повышению энтропии (второй закон термодинамики).
Поскольку в уравнение энергии Гиббса входит энтальпия системы, определить ее абсолютное значение невозможно. Для расчета изменения свободной энергии, отвечающего протеканию той или иной реакции, используют энергии Гиббса образования соединений, участвующих во взаимодействии. Энергия Гиббса образования соединения (ΔGf) - это изменение свободной энергии, соответствующее синтезу моля данного соединения из простых веществ. Энергии Гиббса образования соединений, отнесенные к стандартным условиям, называются стандартными и обозначаются символом  . Значения
. Значения  приведены в справочной литературе; их можно также вычислить по значениям энтальпий образования и энтропий соответствующих веществ.
приведены в справочной литературе; их можно также вычислить по значениям энтальпий образования и энтропий соответствующих веществ.
|
|
Пример №1. Требуется рассчитать  для Fe3O4, если известна энтальпия образования этого соединения ΔНоf(Fe3O4) = -1117,13 кДж/моль и энтропии
для Fe3O4, если известна энтальпия образования этого соединения ΔНоf(Fe3O4) = -1117,13 кДж/моль и энтропии 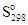 железа, кислорода и Fe3O4, равные 27,15; 205,04 и 146,19 Дж/моль.К. Соответственно
железа, кислорода и Fe3O4, равные 27,15; 205,04 и 146,19 Дж/моль.К. Соответственно
 (Fe3O4) =
(Fe3O4) =  (Fe3O4) - T·
(Fe3O4) - T·  ,
,
где Δ 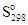 - изменение энтропии при протекании реакции: 3Fe + 2O2 = Fe3O4
- изменение энтропии при протекании реакции: 3Fe + 2O2 = Fe3O4
Изменение энтропии рассчитывается по следующему уравнению:
Δ 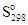 =
= 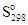 (Fe3O4) - [3
(Fe3O4) - [3 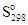 (Fe) + 2
(Fe) + 2 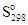 (O2)] =
(O2)] =
= 146,19 - (3.27,15 + 2.205,04) = -345,3(Дж/моль . К);
Δ 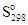 = -0,34534 кДж/моль·К
= -0,34534 кДж/моль·К
Тогда
 (Fe3O4) = -1117,13 - 298(-0,34534) = -1014,2 (кДж/моль)
(Fe3O4) = -1117,13 - 298(-0,34534) = -1014,2 (кДж/моль)
Полученный результат позволяет сделать вывод, что реакция принципиально возможна при стандартных условиях. В данном случае энтальпийный фактор благоприятствует протеканию реакции (  < 0), а энтропийный - препятствует (Т
< 0), а энтропийный - препятствует (Т  < 0), но не может увеличить
< 0), но не может увеличить  до положительной величины
до положительной величины
Поскольку G является функцией состояния, то для реакции: aA + bB = dD + eE изменение энергии Гиббса можно определить по уравнению
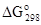 = Σi
= Σi  (пр) - Σj
(пр) - Σj  (реаг)
(реаг)
Пример №2. Оценим принципиальную возможность получения озона при взаимодействии азотной кислоты с кислородом (условия стандартные) по уравнению:
4HNO3(ж) + 5O2(г) = 4O3(г) + 4NO2(г) + 2H2O(ж)
Рассчитаем изменение энергии Гиббса в стандартных условиях:
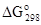 = [4
= [4  (O3) + 4
(O3) + 4  (NO2) + 2
(NO2) + 2  (H2O)] - [4
(H2O)] - [4  (HNO3) + 5
(HNO3) + 5  (O2)] =
(O2)] =
= 4·162,78 + 4·52,29 - [4(-79,90) + 5·0] = 1179,82 (кДж)
Самопроизвольное протекание реакции при стандартных условиях принципиально невозможно. В то же время диоксид азота может быть окислен озоном до азотной кислоты, так как для обратной реакции значение ΔG отрицательно.
ХИМИЧЕСКАЯ КИНЕТИКА
|
|
|

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!