

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
Топ:
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Интересное:
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Важнейшими факторами, влияющими на скорость химической реакции, являются концентрация реагентов, температура, энергия активации, энтропия активации и катализаторы. Остановимся на характеристике каждого из этих факторов.
Влияние концентрации. Химические реакции можно подразделить на реакции соударения, требующие для своего осуществления столкновения двух или нескольких частиц, и реакции возбуждения, в случае которых молекула переходит в возбужденное состояние, поглощая энергию, а затем разрушается, образуя продукты реакции. Для обеих групп реакций повышение концентрации реагирующих веществ вызовет увеличение скорости реакции в результате увеличения абсолютного числа результативных столкновений или актов перехода молекул в возбужденное состояние. Количественно зависимость скорости реакции от концентрации определяется законом действующих масс (К. Гульдберг, П. Вааге, 1879 г.): д ля одностадийных реакций при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Так, для одностадийной реакции: аА + bB = AaBb скорость реакции рассчитывается следующим образом:
υ = k·CA·CA... ·CA·CB·CB... ·CB
(а раз) (b раз)
или
υ = k  ,
,
где С – молярные концентрации реагентов, k - коэффициент пропорциональности, который не зависит от концентрации и называется константой скорости реакции. Константа скорости зависит от природы реагирующих веществ и от температуры; она численно равна скорости реакции при концентрациях реагентов, равных единице. Например, для одностадийной реакции:
2NO + Cl2 = 2NOCl;
υ = k 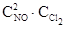
Если реакция многостадийна, то закон действующих масс можно применить к каждой стадии процесса. При этом определяющее влияние на процесс будет иметь скорость самой медленной стадии. Отсюда следует, что стехиометрические коэффициенты уравнения реакции нельзя переносить в кинетическое уравнение скорости, если нет уверенности в том, что эта реакция протекает в одну стадию.
|
|
Если реакция гетерогенна, то скорость ее будет зависеть от площади поверхности соприкосновения веществ, участвующих во взаимодействии. Так, для реакции
mA(г) + nB(к) = AmBn(к);
υ 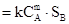 ,
,
где SB - поверхность вещества В, соприкасающаяся с газом А. Если SB допустимо считать величиной постоянной, то уравнение закона действующих масс (кинетическое уравнение) примет следующий вид:
υ = k' 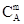
Для реакций между газообразными веществами концентрации в кинетическом уравнении могут быть заменены парциальными давлениями (p) соответствующих газов, так как давление газа прямопропорционально зависит от его концентрации. Например, для реакции, которую можно рассматривать как одностадийную:
С(графит) + СО2(г) = 2СО(г);
υ 
Влияние температуры. C повышением температуры возрастает кинетическая энергия молекул. В результате увеличивается доля частиц, преодолевших энергетический барьер, определяемый энергией активации. Отсюда следует, что с повышением температуры скорость реакции должна возрастать. Влияние температуры на скорость реакции позволяет приближенно оценить эмпирическое правило Вант-Гоффа (1884 г.): при повышении температуры на каждые 10 ˚С скорость гомогенной реакции возрастает в одно и то же число раз. В соответствии с правилом:
 ,
,
где k1 и k2 - константы скорости реакции при температурах Т1 и Т2, γ - температурный коэффициент скорости реакции, зависящий от природы реагирующих веществ и принимающий для большинства реакций значения от двух до четырех.
Более строго температурная зависимость скорости реакции передается уравнением С. Аррениуса:
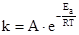 ,
,
где А - предэкспоненциальный множитель, е - основание натурального логарифма, Еа - энергия активации процесса.
|
|
Влияние энергии активации. С увеличением энергии активации уменьшается доля частиц, преодолевающих энергетический барьер, что влечет за собой уменьшение скорости реакции. Поскольку температура слабо влияет на энергию активации, при расчетах ее величину можно считать постоянной. Влияние энергии активации на скорость реакции весьма существенно. Так, при стандартных условиях понижение энергии активации на 20 кДж влечет за собой увеличение константы скорости в 3000 раз, а на 100 кДж - в 3×1017 раз.
Влияние энтропии активации. Необходимым условием осуществления химического акта для реакций столкновения является надлежащая ориентация молекул в момент столкновения, позволяющая образоваться активированному комплексу. Например, для реакции А2 + В2 = 2АВ активированный комплекс имеет форму, представленную на рис. 16а. Столкновение, показанное на рис. 16б будет благоприятствовать протеканию реакции, а на рис. 16в - нет.

Рис. 16. Благоприятное (б) и неблагоприятное (в) столкновение при образовании
активированного комплекса (a).
Вероятность надлежащей ориентации взаимодействующих молекул характеризует энтропия активации Sa. Изменение этой характеристики в процессе реакции определяется следующим соотношением:
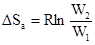 ,
,
где W1 - число возможных ориентаций молекул, W2 - число ориентаций, благоприятствующих взаимодействию. Величина ΔSa входит в предэкспоненциальный множитель уравнения Аррениуса:
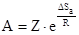 ,
,
где Z - множитель, пропорциональный частоте столкновений взаимодействующих частиц при концентрациях, равных 1 моль/л. Для реакций столкновения W2 < W1 и ΔSa < 0. Для реакций возбуждения W2 = W1 и Δ Sa = 0. С учетом энтропии активации уравнение Аррениуса принимает следующий вид:
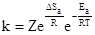
Влияние катализатора. Катализаторами называют вещества, изменяющие скорость химической реакции, но остающиеся в результате реакции химически неизмененными и в том же количестве. Изменение скорости реакции в присутствии катализатора называется катализом.
Катализаторы могут как ускорять, так и замедлять химические процессы. Катализаторы, увеличивающие скорость реакции, называются положительными, а катализаторы, уменьшающие скорость реакции - отрицательными или ингибиторами. Например, для реакции
2Н2О2 = 2Н2О + О2
положительным катализатором является диоксид марганца MnO2, а отрицательным - пирофосфат натрия Na4P2O7. Иногда катализатором является один из продуктов реакции. Такое явление называется автокатализом. Например, реакция окисления щавелевой кислоты перманганатом калия по уравнению:
|
|
2MnO 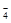 + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2 + 8Н2О
+ 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2 + 8Н2О
непосредственно после смешивания растворов реагентов протекает весьма медленно, однако постепенно скорость процесса возрастает, достигает максимума, а затем начинает понижаться. Это явление связано с тем, что реакцию катализируют ионы Mn2+, концентрация которых по мере протекания реакции возрастает.
По фазовому состоянию различают гомогенные и гетерогенные катализаторы. Гомогенный катализатор находится в одной фазе с реагирующими веществами; катализ в этом случае называют гомогенным катализом. Гетерогенный катализатор образует самостоятельную фазу. Изменение скорости реакции под действием гетерогенного катализатора, называется гетерогенным катализом; в этом случае процесс протекает на поверхности раздела фаз. Так, для реакции разложения пероксида водорода Na4P2O7 является гомогенным катализатором, а MnO2 - гетерогенным. Механизм действия катализаторов (как гомогенных, так и гетерогенных) сводится к тому, что катализатор изменяет энергию активации процесса, понижая ее при положительном катализе и повышая при отрицательном.
Механизм гомогенного катализа объясняет теория промежуточных соединений, согласно которой катализатор вступает во взаимодействие с одним или несколькими реагентами, образуя интермедиаты, которые затем вступают в реакцию, сопровождающуюся освобождением катализатора.
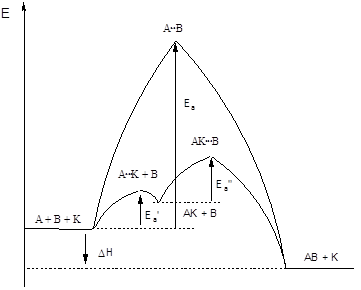
Рис. 17. Механизм гомогенного катализа.
Пусть реакция А + В = А×××В = АВ характеризуется высокой энергией активации (Еа) и протекает медленно. В присутствии катализатора K эта реакция осуществляется в две стадии:
А + К = А×××К = АК;
АК + В = А×××К×××В = АВ + К
Каждая стадия характеризуется своей энергией активации Eа΄ и Еа˝ соответственно. Если энергия активации каждой стадии меньше Еа, скорость реакции возрастет, и в системе будет иметь место положительный катализ. Путь такой реакции показан на рис. 17. Еcли катализатор поведет реакцию по пути с большей энергией активации, то скорость реакции уменьшится (отрицательный катализ или ингибирование).
|
|
Механизм действия гетерогенного катализатора более сложен и включает стадию адсорбции одного из веществ (субстрата) на активных центрах поверхности раздела фаз. При этом он определенным образом ориентируется по отношению к матрице катализатора. После взаимодействия реагентов образуется новое вещество, размер его молекулы не соответствует размеру активного центра катализатора. В результате продукт реакции десорбируется, освобождая место для новой молекулы реагента. Механизм действия гетерогенного катализатора реакции гидрирования этилена можно представить следующей схемой:

Вещества, усиливающие действие катализатора, называются промоторами (активаторами). Так, небольшая добавка сульфатов щелочных металлов значительно повышает активность V2O5, катализирующего окисление оксида серы(IV). В то же время незначительные примеси некоторых веществ могут снижать или полностью подавлять активность катализатора. Такие вещества называют каталитическими ядами.
Биохимические процессы немыслимы без ферментативного катализа. Ферменты (энзимы) - это катализаторы биохимических реакций. Они имеют белковую природу, содержат активные центры, зачастую включающие катион металла, и характеризуются следующими признаками:
ü высочайшей эффективностью (ускоряют реакции в миллионы раз);
ü стереоселективностью (субстрат со строго определенной геометрией молекулы укладывается в нишу с активным центром фермента по принципу ”ключ - замок”);
ü субстратной избирательностью - фермент обслуживает строго определенные классы соединений и типы реакций.
|
|
|

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!