Как уже указывалось, следствием периодического повторения сходных электронных конфигураций является наличие совокупностей элементов, сходных по тем или иным характеристикам. Подобные элементы называют аналогами. Различают групповую, типовую, контракционную, горизонтальную и диагональную аналогии.
Групповая аналогия проявляется у элементов, входящих в одну группу периодической системы, и является наиболее широким видом аналогии. Групповые аналоги могут весьма сильно отличаться как по свойствам простых веществ, так и по свойствам соединений, однако некоторые общие признаки им все же присущи. Поскольку общим для элементов группы является число валентных электронов, все групповые аналоги характеризуются одинаковым высшим значением степени окисления, если оно может быть реализовано. Так, элементы VI группы, как неметаллического, так и металлического характера, за исключением кислорода, проявляют высшую степень окисления +6. У кислорода степень окисления не превышает +4 (центральный атом кислорода в молекуле озона), хотя формально степень окисления +6 для этого элемента не запрещена.
Отметим, что в высшей степени окисления элементы группы образуют сходные как по физическим, так и по химическим свойствам соединения. Например, сера и хром резко отличаются по свойствам друг от друга в элементарном состоянии; их соединения в степени окисления +4 не обнаруживают сходства, а степени окисления +2 и +3, не типичные для серы, весьма характерны для хрома. В то же время соединения серы(VI) и хрома(VI) во многом аналогичны. Так, высшие оксиды этих элементов SO3 и CrO3 являются типичными кислотными оксидами, реагирующими с водой с образованием серной (H2SO4) и хромовой (H2CrO4) кислот. Как серная, так и хромовая кислоты проявляют окислительные свойства и склонны к образованию поликислот (например, H2S2O7 и H2Cr2O7). Как сульфаты, так и хроматы бария и свинца являются практически нерастворимыми солями; относительно низкая растворимость присуща сульфату и хромату кальция, причем для обеих солей с повышением температуры растворимость не растет, а понижается.
Типовая аналогия проявляется в A-, B- и C-подгруппах периодической системы и является более узким видом аналогии, нежели групповая. Типовые аналоги характеризуются одинаковым числом валентных электронов, распределенных на орбиталях одного типа. Распределение одного и того же числа валентных электронов по орбиталям одинакового типа обуславливает сходство этого вида аналогов как в простых веществах, так и в их соединениях. Однако у разных представителей подгруппы это сходство может проявляться не в одинаковой мере, потому что, как будет показано ниже, подгруппа типовых аналогов может включать в себя более тонкие виды аналогов.
Электронная аналогия проявляется у элементов, имеющих сходные электронные формулы. Элементы, входящие в подгруппу электронных аналогов, аналогичны по конфигурации внешнего электронного слоя и достраивающихся внутренних подуровней. Отнесению к электронным аналогам не препятствуют отличия в конфигурации благородного газа, включенного в электронную формулу ([He]2, [Ne]10 и т.д.); при этом конфигурация [Xe]544f14 считается эквивалентной конфигурации благородного газа. Провал электрона также не нарушает электронную аналогию. апример, молибден ([Kr]364d54s1) и вольфрам ([Xe]544f145d46s2) являются электронными аналогами, хотя их электронные формулы отличаются по структуре как внешнего, так и внутренних электронных слоев.
Различают полные и неполные электронные аналоги. Полные аналоги имеют аналогичные электронные конфигурации во всех степенях окисления. Неполные электронные аналоги характеризуются сходными электронными конфигурациями лишь в некоторых степенях окисления.

Рис. 39. Подгруппы электронных аналогов в VI группе периодической системы
(¾ полные электронные аналоги, ---- аналоги в высшей степени окисления).
Например, в группе VI можно выделить три подгруппы полных электронных аналогов (соединены сплошными линиями на рис. 39). Первая из них включает кислород и серу, вторая - селен, теллур и полоний, третья - хром, молибден и вольфрам. Электронные конфигурации атомов в любой из этих подгрупп аналогичны, независимо от степени окисления. Так, все элементы подгруппы селена в степени окисления -2 имеют конфигурацию ns2np6, в степени окисления +4 - ns2np2, в степени окисления +6 - (n-1)d10. В то же время элементы VI группы образуют две подгруппы неполных аналогов, в одну из них входят кислород, сера, селен, теллур и полоний (соединенны на рисунке прерывистой линией). Эти элементы имеют аналогичные электронные конфигурации во всех степенях окисления, кроме высшей. Действительно, в степени окисления +6 сере отвечает электронная формула [Ne]10, а селену - [Ar]183d10. Вторую подгруппу неполных электронных аналогов образуют кислород, сера, хром, молибден и вольфрам. Для этой подгруппы аналогичные электронные конфигурации благородного газа отвечают лишь высшей степени окисления элементов +6.
Контракционная аналогия (шринк-аналогия) проявляется в IVB-VIIIB-подгруппах периодической системы. В этих подгруппах первый элемент заметно отличается от второго, тогда как второй и третий очень близки по свойствам как простых веществ, так и их соединений. Подобные "элементы-близнецы" называют контракционными аналогами или шринк-аналогами (от англ. - shrink, съеживаться).
Существование шринк-аналогов обусловлено, в основном, лантаноидным сжатием, благодаря которому радиусы атомов элементов подгруппы, относящихся к V и VI периодам близки, что влечет за собой сходство других свойств. Например, в подгруппе VIB шринк-аналогами являются молибден и вольфрам, элементы весьма похожие один на другой, но отличающиеся от хрома. Так, хром окисляется в водных растворах катионами водорода, в то время как молибден и вольфрам устойчивы к действию кислот, являющихся окислителями по катиону. Соединения хрома в степени окисления +6 являются сильнейшими окислителями, высший оксид хрома CrO3 активно взаимодействует с водой, образуя растворимые хромовые кислоты; соединения молибдена(VI) и вольфрама(VI) окислителями не являются, их триоксиды не реагируют с водой, молибденовые и вольфрамовые кислоты - малорастворимые соединения. Для хрома весьма типичны степени окисления +2 и +3; для молибдена и вольфрама эти степени окисления проявляются редко, а соответствующие соединения являются кластерами, содержащими агрегаты ковалентно связанных атомов металла.
Горизонтальная аналогия проявляется у некоторых элементов, относящихся к одному периоду и обнаруживающих значительное сходство друг с другом. Обычно горизонтальная аналогия наблюдается у d- и f-элементов с более чем наполовину заполненными электронными подуровнями. Существование горизонтальной аналогии объясняется тем, что в рядах d- и f-элементов изменение свойств с увеличением заряда ядра замедляется (вспомним хотя бы то, что все d- и f-элементы являются металлами). Особенно медленно изменяются свойства во второй половине рядов, где в квантовых ячейках подуровней происходит образование электронных пар. Горизонтальными аналогами обычно являются элементы, нереализующие высшую степень окисления.
Примером горизонтальных аналогов могут служить железо ([Ar]183d64s2), кобальт ([Ar]183d74s2) и никель ([Ar]183d84s2). Для всех этих элементов наиболее характерны степени окисления +2 и +3, формулы основных классов соединений однотипны (например, МеО, Ме2О3, Ме(ОН)2, Ме(ОН)3 и т.д.), а свойства этих соединений, равно как и простых веществ, близки.
Аналогичное явление наблюдается и для платиновых металлов. Триады рутений, родий, палладий и осмий, иридий, платина являются горизонтальными аналогами. В то же время пары рутений-осмий, родий-иридий, палладий-платина относятся к шринк-аналогам. В результате все платиновые металлы близки по свойствам.
В ряду лантанидов элементы подсемейства церия (Ce-Gd) сильнее отличаются друг от друга по свойствам, чем элементы подсемейства тербия (Tb-Lu); это явление также связано с горизонтальной аналогией.
Диагональная аналогия. Как отмечалось ранее, тенденция изменения свойств элементов противоположна для периодов и подгрупп. В связи с этим можно ожидать проявления определенного сходства между элементами, располагающимися в периодической системе по диагонали. Этот вид аналогии называют диагональной. Для проявления диагональной аналогии необходимо, чтобы то или иное свойство изменялось при перемещении на одно место в периоде и на одно место в группе на одну и ту же по абсолютному значению величину. Это условие более или менее удовлетворительно выполняется лишь для пар бериллий-алюминий, бор-кремний и, в меньшей степени, литий-магний. Диагональные аналоги не являются типовыми или электронными аналогами, для них характерны разные степени окисления; формулы образуемых ими оксидов, гидроксидов, кислот, солей, гидридов и других соединений не являются однотипными, однако некоторые общие признаки им присущи. Так, электроотрицательность бериллия и алюминия практически совпадает (1,57 и 1,61 по Полингу), бериллий и алюминий - легкие, не корродирующие на воздухе металлы, взаимодействующие как с кислотами, так и со щелочами; они образуют амфотерные оксиды и гидроксиды. Соли бериллия и алюминия аналогичны по растворимости, гидриды обоих металлов - полимерные соединения, являющиеся активными восстановителями.
9. РАДИОАКТИВНОСТЬ. ЗАКОНЫ ГЕОХИМИИ
9.1. Элементарные частицы
Атомное ядро - это центральная часть атома, в которой сосредоточена его основная масса (около 99,9%). Ядра атомов представляют собой сложные образования, структурными элементами которых являются элементарные частицы.
В настоящее время известно свыше 350 элементарных частиц, различающихся по массе, заряду, спину, устойчивости и другим характеристикам. Они могут быть классифицированы по присущим им типам взаимодействия. Можно выделить четыре типа взаимодействий: гравитационные, электромагнитные, слабые и сильные ядерные взаимодействия. Гравитационные взаимодействия присущи всем элементарным частицам и не могут быть использованы для их классификации. Электромагнитные взаимодействия осуществляются на любых расстояниях и протекают за время, превышающее 10-16 с. Слабые взаимодействия примерно в 100 раз слабее электромагнитных; они характеризуются конечным радиусом действия и временем, превышающим 10-10 с. Сильные взаимодействия превышают слабые примерно в 1013 раз; радиус действия и время протекания их чрезвычайно малы (величины порядка 10-3 пм и 10-23 с). Примеры сильных и слабых взаимодействий будут приведены ниже.
По типам взаимодействия элементарные частицы делят на три группы:
1. Фотон - единственная частица, участвующая, наряду с гравитационными, только в электромагнитных взаимодействиях.
2. Лептоны - частицы, участвующие как в электромагнитных, так и в слабых взаимодействиях. К лептонам относят 6 частиц: электрон, мюон, t-лептон и три вида нейтрино, соответствующих каждой из указанных выше частиц.
3. Адроны - частицы, участвующие во всех видах взаимодействий. Они подразделяются на мезоны, имеющие нулевой или целый спин (в единицах h) и барионы, частицы с полуцелым спином. К мезонам, в частности, относятся p-мезоны или пионы, а к барионам протон и нейтрон.
Каждой элементарной частице соответствует античастица, отличающаяся от частицы знаком заряда или, при отсутствии последнего, знаком проекции спина частицы на направление магнитного поля. В некоторых случаях античастицы тождественны частицам.
Теория строения атомного ядра предполагает знакомство с такими элементарными частицами, как фотон, электрон и отвечающая ему античастица позитрон, электронное нейтрино и соответствующее ему антинейтрино, протон, нейтрон и p-мезоны (табл. 14). Фотон, электрон, позитрон, протон, нейтрино и антинейтрино являются стабильными частицами. Нейтрон вне атомного ядра неустойчив, среднее время жизни - 1040 с. Распад нейтрона является примером слабого взаимодействия и протекает по уравнению:
n ® p + e- + 
Еще менее устойчивы пионы: среднее время жизни для p+ и p- составляет 2,56×10-8 с, а для p0 - 2,31×10-16 с.
Таблица 14.
Характеристики некоторых элементарных частиц
| Семейство
| Частица
| Символ
| Заряд, эл.е.з.
| Масса покоя, а.е.м.
| Спин, h
|
|
| Фотон
| -
|
|
|
|
| Лептоны
| Электрон
| Е
| -1
| 5,48580×10-4
| 1/2
|
| Позитрон
| е+
| +1
| 5,48580×10-4
| 1/2
|
| Нейтрино
| n
|
| 3×10-7
| 1/2
|
| Антинейтрино
| 
|
| 3×10-7
| 1/2
|
| Адроны
| Пи-мезон плюс
| p+
| +1
| 0,14991
|
|
| Пи-мезон минус
| p-
| -1
| 0,14991
|
|
| Пи-мезон нуль
| p0
|
| 0,07405
|
|
| Протон
| Р
| +1
| 1,00728
| 1/2
|
| Нейтрон
| N
|
| 1,00867
| 1/2
|
Позитрон и пи-мезон минус являются античастицами в отношении электрона и пи-мезон плюс, от которых отличаются зарядом. Античастицы при столкновении с соответствующей частицей подвергаются аннигиляции; при этом их масса полностью превращается в электромагнитное излучение. Так, взаимодействие электрона и позитрона протекает с образованием двух фотонов:
e- + e+ ® 2 hn
Нейтрино и антинейтрино, не имеющие заряда частицы исчезающе малой массы, отличаются по знаку проекции спина на направление магнитного поля.
Элементарные частицы не следует, однако, рассматривать как некий предел делимости материи. В настоящее время успешно развивается теория строения адронов. Полагают, что все адроны построены из шести субъядерных частиц, получивших название кварков и антикварков (М. Гел-Манн и Г. Цвейг, 1964 г.). Так мезоны являются дикварками (сочетание кварка и антикварка), барионы - трикварками. В рамках кварковой теории число "истинных" элементарных частиц ограничивается фотоном, лептонами и шестью кварками. Заметим, однако, что попытки выделить свободные кварки до сих пор не увенчались успехом.
9.2. Теория строения атомных ядер
В настоящее время общепринятой является протонно-нейтронная теория атомных ядер (Д. Иваненко, В. Гейзенберг, 1932 г.), которая может быть сведена к следующим основным положениям:
1. Ядро состоит из протонов и нейтронов. Легкие элементарные частицы (электроны, позитроны, мезоны) не могут сколько-нибудь долго находиться в ядре. При образовании подобных частиц они либо поглощаются другими частицами, либо покидают ядро в процессе радиоактивного распада. Протон и нейтрон объединяют под общим названием нуклон. Число нуклонов в атомном ядре называется массовым числом (А). Поскольку массы как протона, так и нейтрона в а.е.м. близки к единице, массовое число ядра равно атомной массе, округленной до целого числа. Число протонов в ядре (Z) равно заряду ядра, совпадающему с порядковым номером элемента в периодической системы, число нейтронов можно определить по следующей формуле:
Nn = A - Z
При записи формул атомных ядер (нуклидов) верхним левым индексом при химическом символе элемента указывается массовое число, нижним левым - число протонов, например,  .
.
Сопоставление значений А, Z и Nn для различных ядер позволяет выделить определенные группы нуклидов, из которых важнейшими являются:
а) изобары - нуклиды, имеющие одинаковые массовые числа при разных значениях Z и Nn (например,  );
);
б) изотопы - нуклиды, имеющие одинаковое число протонов при разном числе нейтронов (например,  );
);
в) изотоны - нуклиды, содержащие одинаковое число нейтронов (например,  ).
).
Термины "изотоп", "изобар", "изотон" распространяются и на атомы, содержащие соответствующие ядра.
2. Протоны и нейтроны являются взаимопревращающимися частицами. В атомных ядрах непрерывно протекают процессы превращения протонов в нейтроны и нейтронов в протоны в результате обмена пи-мезонами в соответствии с уравнениями:
p + n ® n + p+ + n ® n + p;
n + p ® p + p- + р ® p + n
Эти процессы обуславливают стабильность атомных ядер, хотя нейтроны, как указывалось выше, являются нестабильными частицами. В результате протон и нейтрон можно рассматривать как разные квантово-механические состояния нуклона. Продолжительность существования пи-мезонов в ядре не превышает 10-23 - 10-24 с.
3. Между нуклонами действуют силы притяжения, называемые ядерными силами. Ядерные силы обусловлены непрерывным взаимодействием нуклонов, состоящем в многократных актах испускания пионов одними нуклонами и их поглощения другими нуклонами. При этом мезонами обмениваются не только пары протон - нейтрон, но и пары протон - протон и нейтрон - нейтрон; в последних случаях во взаимодействии участвует пи-мезон нуль. Ядерные силы относятся к сильным взаимодействиям: их действие проявляется лишь на расстояниях порядка 10-3 пм и очень быстро падает при удалении нуклонов друг от друга. Ядерные силы чудовищно велики. Так, сила притяжения между двумя протонами на расстоянии 10-3 пм в 100 раз больше их электростатического отталкивания и в 1038 раз превышает их гравитационное взаимодействие. Следствием этого являются малые размеры атомных ядер и фантастические высокая плотность ядерного вещества. Если атомы характеризуются радиусами порядка 100 пм, то радиусы ядер составляют величины порядка 10-3-10-2 пм. Плотность ядерного вещества достигает 1014 г/см3; напомним, что плотность наиболее тяжелого металла осмия равна 22,5 г/см3.
Наряду с ядерными силами в ядре действуют также электростатические силы отталкивания одноименно заряженных протонов, понижающие устойчивость ядер, особенно имеющих высокий заряд. Элементы с порядковыми номерами 84 и выше вообще не имеют стабильных изотопов. Лишенные зарядов нейтроны стабилизируют ядра, ослабляя взаимное отталкивание протонов. С увеличением зарядов ядер отношение N:Z в них возрастает; у элементов начала периодической системы оно близко к единице и с увеличением порядкового номера повышается до 1,6 у урана.
4. Расщепление ядра на нуклоны требует преодоления ядерных сил и сопровождается поглощением энергии. Энергия, которую необходимо затратить, чтобы расщепить ядро на отдельные нуклоны, называется энергией связи ядра (Есв). Такое же количество энергии выделяется при синтезе ядра из нуклонов. Энергию связи, отнесенную к одному нуклону, называют средней (удельной) энергией связи ядра:

Значения средней энергии связи, в отличие от Е св, изменяются в относительно узких пределах, составляя для большинства ядер 6-8 мЭв на каждый нуклон. Максимальные значения  отвечают элементам середины периодической системы, достигая 8,8 мЭв, что соответствует выделению до 850 млн. кДж на моль взаимодействующих нуклонов и многократно превышает тепловые эффекты обычных химических реакций. Выделение столь значительных количеств энергии в соответствии с уравнением Эйнштейна должно ощутимо сказаться на изменении массы системы. Уменьшение массы ядра сравнительно с массой входящих в его состав нуклонов называется дефектом массы. Дефект массы может быть рассчитан по формуле:
отвечают элементам середины периодической системы, достигая 8,8 мЭв, что соответствует выделению до 850 млн. кДж на моль взаимодействующих нуклонов и многократно превышает тепловые эффекты обычных химических реакций. Выделение столь значительных количеств энергии в соответствии с уравнением Эйнштейна должно ощутимо сказаться на изменении массы системы. Уменьшение массы ядра сравнительно с массой входящих в его состав нуклонов называется дефектом массы. Дефект массы может быть рассчитан по формуле:
Dm = Z·mp + N·mn - Mx,
где mp и mn - массы протона и нейтрона, Mx - масса синтезированного ядра. Так, например, для ядра  значение Мх равно разности масс атома гелия и двух электронов, входящих в этот атом.
значение Мх равно разности масс атома гелия и двух электронов, входящих в этот атом.
Мх = 4,00260 - 2·0,00055 = 4,0015 а.е.м.
Тогда
Dm = 2·1,00728 + 2·1,00867 - 4,0015 = 0,0304 а.е.м.;
т.е. около 0,8% от массы ядра. Найденному дефекту массы соответствует выделение 28 мЭв энергии на каждое ядро гелия или 2,7×109 кДж на моль синтезированного гелия.
Атомное ядро является квантово-механическим объектом. Однако разработка квантово-механической теории атомных ядер встречает серьезные затруднения, связанные как с ограниченностью сведений о природе ядерных сил, так и с чисто математическими трудностями. Поэтому для объяснения свойств ядер широко используются модельные представления. Одной из наиболее приемлемых моделей ядра является оболочечная модель (М. Гепперт-Майер, 1948 г.). Оболочечная модель базируется на предположении, что ядро имеет ряд дискретных ядерных уровней, емкость которых определяется значениями ядерных квантовых чисел. Не останавливаясь детально на вопросе о квантовании нуклонов, укажем, что полному заполнению ядерных энергетических уровней соответствуют числа нуклонов, равные 2, 8, 14, 20, 28, 50, 82, 126 и 184. Эти числа называют магическими; ядра, в которых они реализуются, получили название магических ядер. Эти ядра в какой-то мере аналогичны атомам благородных газов в периодической системе. Различают ядра, магические по протонам (например,  ), по нейтронам (например,
), по нейтронам (например,  ) и дважды магические ядра, примерами которых могут служить
) и дважды магические ядра, примерами которых могут служить  . Магические ядра характеризуются большой устойчивостью и распространенностью в природе сравнительно с ядрами, энергетические уровни которых не завершены.
. Магические ядра характеризуются большой устойчивостью и распространенностью в природе сравнительно с ядрами, энергетические уровни которых не завершены.
9.3. Ядерные реакции
Ядерными реакциями называются превращения атомных ядер, обусловленные их взаимодействием с элементарными частицами или другими ядрами. В отличие от химических реакций, ядерные реакции всегда сопровождаются изменением элементного или изотопного состава.
Обычным методом осуществления ядерных реакций является метод бомбардировки, при котором ядра вещества-мишени подвергаются действию пучка частиц, энергия которых достаточна для преодоления электростатического отталкивания. Для получения пучков частиц, обладающих высокой скоростью и энергией, используют разнообразные ускорители (циклотроны, синхрофазотроны, линейные ускорители). Иногда для бомбардировки используют частицы, образующиеся при распаде радиоактивных элементов.
Чаще всего в ядерных реакциях принимают участие четыре частицы: две частицы вступают во взаимодействие, образуя две новые частицы. Значительно реже наблюдается образование трех и более новых частиц. Суммы масс и зарядов исходных и образующихся частиц не изменяются (разумеется, без учета дефекта или приращения масс, соответствующих тепловому эффекту превращения).
Ядерные реакции обычно протекают по схеме:
X + Y ® U ® X' + Y'
Взаимодействующие частицы X и Y сливаются в короткоживущее ядро U (компаунд-ядро), которое затем распадается на частицы X' и Y'.При записи уравнения ядерных реакций принято указывать заряды и массовые числа исходных и образующихся ядер. Зачастую используют сокращенную форму записи подобных уравнений; при этом записывают символы исходного и полученного ядра с указанием массовых чисел, а между ними в круглых скобках через запятую указывают символы бомбардирующей и образующейся легких частиц. При такой форме записи ядро  обозначается символом a, ядро дейтерия
обозначается символом a, ядро дейтерия  (дейтрон или дейтон) - символом d, электрон и позитрон – символами b- и b+.
(дейтрон или дейтон) - символом d, электрон и позитрон – символами b- и b+.
Ядерные реакции классифицируют по природе бомбардирующих частиц. Можно выделить 6 групп ядерных реакций, соответствующих использованию для бомбардировки нейтронов, протонов, фотонов (g-квантов), дейтронов, ядер гелия и многозарядных тяжелых ионов. Ниже приведены примеры ядерных реакций указанных типов:
 или 10B(n,a)7Li;
или 10B(n,a)7Li;
 или 63Cu(p,n)Zn;
или 63Cu(p,n)Zn;
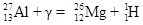 или 27Al(g,p)26Mg;
или 27Al(g,p)26Mg;
 или 24Mg(d,a)22Na;
или 24Mg(d,a)22Na;
 или 14N(a,p)17O;
или 14N(a,p)17O;
 или 242Pu(22Nе,4n)260Ku
или 242Pu(22Nе,4n)260Ku
К ядерным реакциям относятся также термоядерные процессы - реакции синтеза тяжелых ядер из более легких. Термоядерным реакциям соответствуют огромные тепловые эффекты, однако для начала протекания таких реакций необходимы очень высокие температуры (порядка 106 К). Простейшей термоядерной реакцией является синтез ядер гелия из протонов:

Эта реакция протекает в несколько стадий и является источником энергии многих звезд, в том числе и Солнца. Неуправляемая термоядерная реакция синтеза гелия осуществляется при взрыве водородной бомбы.
9.4. Радиоактивность
Радиоактивность - это явление самопроизвольного распада неустойчивых атомных ядер, сопровождающееся корпускулярным или электромагнитным излучением. Явление радиоактивности было открыто французским физиком А. Беккерелем в 1896 г. при работе с ураном и его соединениями. Фундаментальное изучение этого явления связано с именами Марии и Пьера Кюри, выделившими из урановых руд радиоактивные элементы полоний и радий, являющиеся в миллионы раз более мощными излучателями, чем уран. Связь радиоактивности с распадом атомных ядер была установлена Э. Резерфордом и Ф. Содди.
Системной единицей радиоактивности является беккерель (Бк). Беккерель равен активности образца, в котором происходит один акт радиоактивного распада в секунду; размерность беккереля - с-1. Часто используемой внесистемной единицей радиоактивности является кюри (Ки), соответствующая радиоактивности 1 г радия; 1 Ки = 3,700×1010 Бк.
Радиоактивное облучение оказывает сильное воздействие на биологические объекты, в том числе и на организм человека. Рассмотрим единицы его измерения.
Рентген – доза облучения, при которой в 1 см3 воздуха образуется 2×109 пар однозарядных ионов.
Бэр – биологический эквивалент рентгена – количество энергии, поглощенное биологической тканью, эквивалентное по воздействию 1 ренгену.
Поглощенная доза (Дпогл.) – отношение поглощенной энергии к массе тела. Единицы измерения: Грей (Гр) – 1 Дж/кг и Рад – 100 эрг/1 г.
Различают естественную и искусственную радиоактивность. Первая присуща изотопам, существующим в природных условиях, вторая наблюдается у ядер, полученных искусственным путем. Существует несколько типов радиоактивного распада, важнейшими из которых являются a-распад, b-распад, электронный захват и спонтанное деление ядра.
a-Распад сопровождается испусканием двух протонов и нейтронов в виде ядра гелия  и протекает по уравнению:
и протекает по уравнению:

Образующиеся при a-распаде ядра гелия имеют энергию 4 - 9 мЭв и распространяются со скоростью порядка 2×107 м/с. a-Распад характерен для элементов с высокими значениями заряда ядра. Все элементы, располагающиеся в периодической системе после висмута, имеют изотопы, подвергающиеся a-распаду. Примером этого типа распада может служить распад ядер радия:

b-Распад сопровождается испусканием электрона (b--распад) или позитрона (b+-распад) в соответствии с уравнениями:
 или
или 
Энергия b-частиц изменяется в широких пределах (от 0,02 до 16 мЭв). Этот тип радиоактивности присущ как легким, так и тяжелым элементам; известно свыше тысячи изотопов, для которых характерен b-распад. При этом изотопы одного и того же элемента могут подвергаться как b--распаду, так и b+-распаду. Если масса радиоактивного ядра больше массы стабильного изотопа данного элемента, то оно обычно подвергается b--распаду, если меньше - то b+-распаду. Например, масса стабильного изотопа углерода равна 12 а.е.м.; соответственно ядра углерода 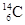 и
и  распадаются по уравнениям:
распадаются по уравнениям:
 ;
; 
Электронный захват. Ядро поглощает электрон, находящийся на одном из низших энергетических уровней, в результате чего один из протонов ядра превращается в нейтрон:

Чаще всего захват электрона происходит с ближайшего к ядру К-слоя (К-захват), реже с L- или М-слоя. Электронный захват, как и b+-распад, присущ нейтронодефицитным изотопам. Например, К-захвату подвергаются ядра  :
:
 ;
; 
Спонтанное деление ядер. Самопроизвольное деление тяжелого ядра на два (реже на три или четыре) осколка, являющихся ядрами элементов середины периодической системы. Известно очень мало изотопов, для которых спонтанное деление является единственным видом радиоактивного распада. Примером таких ядер может служить изотоп менделевия  . Обычно ядра, способные к спонтанному делению, одновременно подвергаются также a- или b-распаду, являющемуся для них основным. При спонтанном делении образуются самые разнообразные осколки, однако их массы и заряды чаще всего относятся как 3:2.
. Обычно ядра, способные к спонтанному делению, одновременно подвергаются также a- или b-распаду, являющемуся для них основным. При спонтанном делении образуются самые разнообразные осколки, однако их массы и заряды чаще всего относятся как 3:2.
9.4.1. Законы радиоактивного распада
Процессам радиоактивного распада присущи некоторые общие закономерности, важнейшими из которых являются закон радиоактивной постоянной и правило смещения.
Закон радиоактивной постоянной: число ядер, распадающихся в единицу времени, пропорционально числу имеющихся в наличии радиоактивных ядер.
Пусть за отрезок времени t число радиоактивных ядер изменилось от N0 до N. В соответствии с законом радиоактивной постоянной скорость распада в каждый момент времени будет пропорциональна величине N:
 lN или
lN или  -ldt
-ldt
Коэффициент пропорциональности l называется радиоактивной постоянной или константой радиоактивного распада. Проинтегрировав левую часть уравнения в пределах от N0 до N, а правую - от нуля до t, получим математическое выражение основного закона радиоактивного распада в интегральной форме:
N = N0e-lt
Значения радиоактивной постоянной зависят от природы радиоактивного изотопа и изменяются в широких пределах. Так, например, для  радиоактивная постоянная равна 1,36×10-11 с-1, а для
радиоактивная постоянная равна 1,36×10-11 с-1, а для 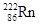 , образующегося при a-распаде радия, 2,10×10-6 с-1.
, образующегося при a-распаде радия, 2,10×10-6 с-1.
Величина, обратная радиоактивной постоянной, называется средним временем жизни ядра, t =  .
.
Следствием из закона радиоактивной постоянной является правило полураспада: отрезок времени, за который распадается половина радиоактивных ядер, величина постоянная для данного изотопа, называемая периодом полураспада (Т1/2).
Если t = Т1/2, то N = 1/2N0 = 2-1N0. Отсюда
 или
или 
Поскольку радиоактивный распад может сопровождаться изменением зарядов ядер, образующиеся при распаде нуклиды занимают в периодической системе иные места, нежели исходные ядра. Для характеристики подобных перемещений удобно пользоваться так называемым правилом смещения (К. Фаянс, Ф. Содди, 1913 г.): н уклид, образующийся в результате a-распада, смещается в периодической системе на две клетки влево, а нуклид, образующийся в результате b --распада, - на одну клетку вправо от исходного. К этому правилу можно добавить, что позитронный распад и электронный захват смещают ядро на одну клетку влево. При этом испускание a-частицы изменяет массу ядра и массовое число на четыре единицы, тогда как b-распад на массу ядра не влияет. Например, ядро  последовательно испустило 3 a-частицы и один электрон. В соответствии с правилом смещения полученный нуклид сместится в периодической системе на пять клеток влево от исходного ядра, а масса его уменьшится на 12 единиц. Таким образом, продуктом взаимодействия будет ядро
последовательно испустило 3 a-частицы и один электрон. В соответствии с правилом смещения полученный нуклид сместится в периодической системе на пять клеток влево от исходного ядра, а масса его уменьшится на 12 единиц. Таким образом, продуктом взаимодействия будет ядро  .
.
9.4.2. Естественная радиоактивность. Радиоактивные ряды.
Радиоактивное равновесие
Естественные радиоактивные изотопы достаточно многочисленны и содержатся в различных природных объектах (горные породы, минералы, атмосфера, гидросфера, космические тела). К ним относятся все изотопы элементов, порядковый номер которых превышает 83, а также некоторые изотопы элементов, расположенных в периодической системе до висмута.
Из тяжелых естественных радионуклидов, прежде всего, заслуживают внимания относительно распространенные в земной коре изотопы урана и тория ( ). В результате непрерывно протекающего распада ядер этих изотопов Земля получает значительное количество энергии - около 5,7×1010 кДж/с (величина соизмеримая с количеством тепла, излучаемого в мировое пространство). За счет этой энергии повышается температура при углублении в земные недра.
). В результате непрерывно протекающего распада ядер этих изотопов Земля получает значительное количество энергии - около 5,7×1010 кДж/с (величина соизмеримая с количеством тепла, излучаемого в мировое пространство). За счет этой энергии повышается температура при углублении в земные недра.
При распаде изотопов урана и тория протекает ряд последовательных ядерных превращений, при которых нуклид, образующийся на определенной стадии, становится исходным ядром для следующей стадии. Совокупность генетически связанных нуклидов называется радиоактивным рядом. Радиоактивный ряд начинается родоначальником ряда - нуклидом с периодом полураспада, достаточным для того, чтобы этот изотоп не исчез за время существования земной коры (Т1/2 > 108 лет); ряд завершается каким-либо стабильным изотопом. В настоящее время известны три естественных радиоактивных ряда, в которых происходят только a- и b--превращения. Все существующие в земной коре изотопы тяжелых радиоактивных элементов являются членами этих рядов.
Ряд урана. Родоначальником ряда является  с периодом полураспада 4,47×109 лет; завершает ряд стабильный изотоп свинца
с периодом полураспада 4,47×109 лет; завершает ряд стабильный изотоп свинца  . Превращение осуществляется в 14 стадий (8 a-распадов, 6b--распадов). Часть радиоактивного ряда урана приведена ниже:
. Превращение осуществляется в 14 стадий (8 a-распадов, 6b--распадов). Часть радиоактивного ряда урана приведена ниже:

4,47×109 лет 24,1 сут. 6,7 ч стабилен
Поскольку изменение массового числа членов ряда происходит только при a-распаде, для любого нуклида ряда справедлива формула A = 4n + 2, где А - массовое число изотопа, n - целое число. Ряд образуют изотопы таких элементов, как протактиний, радий, радон, астат, полоний, висмут, свинец и таллий.
Ряд тория открывается изотопом  (Т1/2 = 1,40×1010 лет), включает 10 стадий (6a- и 4b--распадов) и заканчивается изотопом
(Т1/2 = 1,40×1010 лет), включает 10 стадий (6a- и 4b--распадов) и заканчивается изотопом  . Массовые числа членов ряда отвечают форму
. Массовые числа членов ряда отвечают форму







 .
. );
); );
); ).
).
 отвечают элементам середины периодической системы, достигая 8,8 мЭв, что соответствует выделению до 850 млн. кДж на моль взаимодействующих нуклонов и многократно превышает тепловые эффекты обычных химических реакций. Выделение столь значительных количеств энергии в соответствии с уравнением Эйнштейна должно ощутимо сказаться на изменении массы системы. Уменьшение массы ядра сравнительно с массой входящих в его состав нуклонов называется дефектом массы. Дефект массы может быть рассчитан по формуле:
отвечают элементам середины периодической системы, достигая 8,8 мЭв, что соответствует выделению до 850 млн. кДж на моль взаимодействующих нуклонов и многократно превышает тепловые эффекты обычных химических реакций. Выделение столь значительных количеств энергии в соответствии с уравнением Эйнштейна должно ощутимо сказаться на изменении массы системы. Уменьшение массы ядра сравнительно с массой входящих в его состав нуклонов называется дефектом массы. Дефект массы может быть рассчитан по формуле: значение Мх равно разности масс атома гелия и двух электронов, входящих в этот атом.
значение Мх равно разности масс атома гелия и двух электронов, входящих в этот атом. ), по нейтронам (например,
), по нейтронам (например,  ) и дважды магические ядра, примерами которых могут служить
) и дважды магические ядра, примерами которых могут служить  . Магические ядра характеризуются большой устойчивостью и распространенностью в природе сравнительно с ядрами, энергетические уровни которых не завершены.
. Магические ядра характеризуются большой устойчивостью и распространенностью в природе сравнительно с ядрами, энергетические уровни которых не завершены. (дейтрон или дейтон) - символом d, электрон и позитрон – символами b- и b+.
(дейтрон или дейтон) - символом d, электрон и позитрон – символами b- и b+. или 10B(n,a)7Li;
или 10B(n,a)7Li; или 63Cu(p,n)Zn;
или 63Cu(p,n)Zn;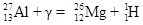 или 27Al(g,p)26Mg;
или 27Al(g,p)26Mg; или 24Mg(d,a)22Na;
или 24Mg(d,a)22Na; или 14N(a,p)17O;
или 14N(a,p)17O; или 242Pu(22Nе,4n)260Ku
или 242Pu(22Nе,4n)260Ku
 и протекает по уравнению:
и протекает по уравнению:

 или
или 
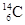 и
и  распадаются по уравнениям:
распадаются по уравнениям: ;
; 

 :
: ;
; 
 . Обычно ядра, способные к спонтанному делению, одновременно подвергаются также a- или b-распаду, являющемуся для них основным. При спонтанном делении образуются самые разнообразные осколки, однако их массы и заряды чаще всего относятся как 3:2.
. Обычно ядра, способные к спонтанному делению, одновременно подвергаются также a- или b-распаду, являющемуся для них основным. При спонтанном делении образуются самые разнообразные осколки, однако их массы и заряды чаще всего относятся как 3:2. lN или
lN или  -ldt
-ldt радиоактивная постоянная равна 1,36×10-11 с-1, а для
радиоактивная постоянная равна 1,36×10-11 с-1, а для 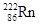 , образующегося при a-распаде радия, 2,10×10-6 с-1.
, образующегося при a-распаде радия, 2,10×10-6 с-1. .
. или
или 
 .
. ). В результате непрерывно протекающего распада ядер этих изотопов Земля получает значительное количество энергии - около 5,7×1010 кДж/с (величина соизмеримая с количеством тепла, излучаемого в мировое пространство). За счет этой энергии повышается температура при углублении в земные недра.
). В результате непрерывно протекающего распада ядер этих изотопов Земля получает значительное количество энергии - около 5,7×1010 кДж/с (величина соизмеримая с количеством тепла, излучаемого в мировое пространство). За счет этой энергии повышается температура при углублении в земные недра. с периодом полураспада 4,47×109 лет; завершает ряд стабильный изотоп свинца
с периодом полураспада 4,47×109 лет; завершает ряд стабильный изотоп свинца  . Превращение осуществляется в 14 стадий (8 a-распадов, 6b--распадов). Часть радиоактивного ряда урана приведена ниже:
. Превращение осуществляется в 14 стадий (8 a-распадов, 6b--распадов). Часть радиоактивного ряда урана приведена ниже:
 (Т1/2 = 1,40×1010 лет), включает 10 стадий (6a- и 4b--распадов) и заканчивается изотопом
(Т1/2 = 1,40×1010 лет), включает 10 стадий (6a- и 4b--распадов) и заканчивается изотопом  . Массовые числа членов ряда отвечают форму
. Массовые числа членов ряда отвечают форму


