ТАВРИЧЕСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ
Имени В.И. ВЕРНАДСКОГО
Э.А. ГЮННЕР,
В.Ф. ШУЛЬГИН, Н.С. ПЕВЗНЕР
ЛЕКЦИИ ПО ОБЩЕЙ
ХИМИИ
учебное пособие
для студентов I курса направления подготовки 6.040101 - химия
Симферополь 2010
Рекомендовано к печати заседанием кафедры общей химии от 13.09.10, протокол №2
Рекомендовано к печати научно-методическим советом
Таврического национального университета имени В.И. Вернадского от октября 2010 г.,
протокол № 5
В учебном пособии кратко освещены основные вопросы программы по общей химии для студентов химических специальностей Таврического национального университета (химия, биохимия). Материал, изложенный в книге, может быть использован студентами вузов другого профиля, например, сельскохозяйственного или медицинского, а также студентами нехимических специальностей университета.
© Э.А. Гюннер, В.Ф. Шульгин, Н.С. Певзнер, 2010
Введение. Предмет химии
Особенностью окружающего нас мира является материальность его объектов в том смысле, что они существуют вне и независимо от нашего сознания. Все известные к настоящему времени проявления материи можно свести к двум видам - веществу и полю. Вещество - это форма материи, носители которой имеют ненулевую массу покоя. Примерами таких носителей могут служить протон, нейтрон и электрон - элементарные частицы, из которых построены атомы. Носители свойств поля (например, фотоны) характеризуются нулевой массой покоя.
Химия - это наука о химических веществах и закономерностях их взаимных превращений. Под химическим веществом подразумевают конкретный вид материи, образованный атомами химических элементов. При исследовании химических веществ химия решает цепочку взаимосвязанных задач: состав – структура – свойство – функция (область практического применения).
Особенностью материи является постоянное ее движение, под которым понимают любое изменение материального объекта. Различают несколько форм движения материи, основными из которых являются физическая, химическая и биологическая. Под химической формой движения подразумеваются превращения одних веществ в другие, при которых сохраняются ядра атомов - носителей химических свойств материи. В основе химической формы движения лежит перестройка структуры валентных электронных оболочек атомов - явление физическое. Тем не менее, химическая форма является самостоятельным видом изменения материи и не может рассматриваться как частный случай физической формы ее движения. В свою очередь, химическая форма движения является основой биологической, поскольку в основе жизнедеятельности любого живого организма лежит сложный комплекс химических реакций.
Поскольку химия занимается изучением как химических, так физических явлений, важным является проведение границы между ними. В настоящее время критериями протекания химического процесса (химической реакции) считают:
· образование новых химических частиц;
· тепловой эффект процесса более 20-40 кДж/моль.
Тем не менее, в ряде случаев процесс не удается четко отнести к физическому или химическому. Примерами таких явлений могут служить растворение или испарение некоторых веществ. Так, процесс испарения вольфрама идет с образованием в газовой фазе двухатомных молекул W2, которые отсутствуют в кристаллическом состоянии, и сопровождается значительным по величине тепловым эффектом (770 кДж/моль). Несмотря на то, что новые химические вещества при этом не образуются, процесс нельзя считать чисто физическим, в подобном случае лучше подходит термин "физико-химическое явление".
Являясь самостоятельной наукой, химия связана с другими естественными науками – физикой, биологией, геологией, сельскохозяйственными науками. Связь эта иногда бывает столь тесной, что на границе наук возникают их новые ветви, представляющие собой самостоятельные науки. Примерами таких наук могут служить физическая химия, квантовая химия, геохимия, космохимия, биохимия, бионеорганическая и биоорганическая химия. Широкое применение в современной химии математических методов и вычислительной техники привело к возникновению таких специфических наук как математическая и компьютерная химия. В то же время для химии, как и для других естественных наук, характерна тенденция к дифференциации, т.е. к выделению в относительно самостоятельные науки ее отдельных частей. Современная химия представляет собой комплекс наук, важнейшими составными частями которого являются:
1. Общая химия - наука об общих закономерностях химических процессов.
2. Неорганическая химия, изучающая химические элементы и их соединения.
3. Органическая химия, изучающая специфические соединения углерода - углеводороды и их производные.
4. Физическая химия - наука о физических процессах, сопровождающих химические явления.
5. Аналитическая химия (химическая метрология), предметом изучения которой являются методы определения качественного и количественного состава веществ.
6. Квантовая химия использует идеи и методы квантовой механики для исследования химических объектов и процессов.
7. Коллоидная химия, изучающая дисперсные системы и поверхностные явления на границе раздела фаз.
8. Нанохимия изучает химические объекты с размерами порядка 1–100 нм (хотя бы в одном измерении).
9. Супрамолекулярная химия – химия межмолекулярных взаимодействий.
10. Координационная химия изучает состав, строение и свойства соединений, имеющих центр координации, в роли которого зачастую выступает атом или катион металла.
11. Радиохимия изучает химию радиоактивных изотопов и ядерные превращения.
12. Бионеорганическая химия изучает координационные соединения металлов с биомолекулами (белками, аминокислотами, нуклеиновыми кислотами, липидами и т.д.).
13. Биоорганическая химия изучает связь между строением органических соединений и их биологическими функциями.
14. Химическая технология - наука о методах и средствах масштабной химической переработки природных материалов в практически важные продукты.
Основу современной общей химии составляет ряд концепций, главными из которых являются:
· атомно-молекулярное учение;
· учение о строении вещества (теория строения атома и химической связи);
· Периодический закон и периодическая система химических элементов им. Д.И. Менделеева;
· учение о химическом процессе (химическая кинетика и химическая термодинамика);
· теория растворов и дисперсных систем.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
СТРОЕНИЕ АТОМА
ХИМИЧЕСКАЯ СВЯЗЬ
Метод валентных связей
Основные положения
Сущность метода ВС может быть сведена к следующим основным положениям:
1. Ковалентная связь реализуется за счет образования электронной пары, общей для взаимодействующих атомов. Подобная двухцентровая, двухэлектронная связь называется ковалентной локализованной связью.
2. Ковалентные двухцентровые связи образуют электроны с антипараллельными спинами. Необходимость антипараллельности спинов для образования связи была доказана В. Гайтлером и Ф. Лондоном, которые в 1927 году, используя уравнение Шредингера, рассчитали изменение потенциальной энергии системы для двух атомов водорода в зависимости от межъядерного расстояния. При этом было установлено, что в случае параллельных спинов электронов энергия системы непрерывно возрастает по мере сближения атомов. Если же спины антипараллельны, то при уменьшении межъядерного расстояния потенциальная энергия первоначально понижается, проходит через минимум, а при дальнейшем сближении атомов начинает быстро расти (рис. 4). Положение минимума на кривой потенциальной энергии отвечает длине связи в молекуле Н2, а глубина минимума - энергии связи.

Рис. 4. Зависимость энергии взаимодействия атомов водорода от межъядерного
расстояния: а – при параллельности, б – при антипараллельности спинов электронов.
3. При образовании ковалентной связи происходит перекрывание электронных орбиталей взаимодействующих атомов. Сущность перекрывания состоит в том, что после образования связи расстояние между ядрами становится меньше суммы радиусов взаимодействующих атомов. Так, для молекулы водорода межъядерное расстояние составляет 74 пм, тогда как сумма атомных радиусов равна 106 пм. В результате возникает область пространства, в которой с достаточной вероятностью может находиться электрон как одного, так и другого атома (зона перекрывания). В зоне перекрывания каждый электрон, образующий локализованную связь, описывается волновыми функциями обоих взаимодействующих атомов.
Количественной характеристикой перекрывания является интеграл перекрывания
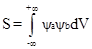 ,
,
где Ya и Yb - волновые функции электронов атомов, между которыми образуется связь.
В зависимости от знака волновых функций и ориентации орбиталей в пространстве возможны три типа перекрывания:
а) Положительное (эффективное) перекрывание. В области перекрывания волновые функции обоих электронов (Ya и Yb) имеют одинаковый знак. При положительном перекрывании растет электронная плотность в зоне перекрывания и происходит образование связи.
Эффективное перекрывание Неэффективное перекрывание Нулевое перекрывание
б) Отрицательное (неэффективное) перекрывание. В области перекрывания волновые функции Yа и Yb имеют разный знак. В случае отрицательного перекрывания электронная плотность в области перекрывания понижается, усиливается взаимное отталкивание ядер и образование связи становится невозможным.
в) Нулевое перекрывание. Перекрывание не сопровождается изменением электронной плотности в зоне перекрывания.
3.2.2.Механизмы образования двухцентровой связи.
Кратность ковалентной связи
Между двумя атомами в молекуле возможно образование не только одной, но и нескольких локализованных связей. Ковалентные связи, осуществляемые двумя и более электронными парами называются кратными связями, в отличие от связи, осуществляемой одной электронной парой, называемой одинарной. Число электронных пар, связывающих два атома, называется кратностью связи.
При образовании кратных связей всегда соблюдается следующее правило: электронные облака взаимодействующих атомов, образующие кратные связи не могут перекрываться в одном и том же направлении, т.е. иметь одинаковое расположение в пространстве. Так, например, если между двумя атомами, ядра которых лежат на оси х образовалась связь в результате перекрывания двух px-орбиталей, то вторая связь за счет перекрывания s- или  -орбиталей возникнуть не может, так как эти орбитали перекрываются в том же направлении, что и px-орбитали.
-орбиталей возникнуть не может, так как эти орбитали перекрываются в том же направлении, что и px-орбитали.
В зависимости от характера перекрывания различают три вида ковалентной связи.
Сигма-связь (s-связь). Перекрывание валентных орбиталей происходит вдоль линии связи, т.е. линии, соединяющей ядра взаимодействующих атомов. s-Связь может быть образована орбиталями любого типа, если эти орбитали перекрываются по линии связи. Наиболее прочная s-связь образуется за счет гибридных орбиталей, в силу этого образованию s-связи обычно предшествует гибридизация, если последняя возможна. На рис. 9а приведены примеры перекрывания атомных орбиталей, приводящие к образованию s-связей.
Пи-связь (p-связь). Перекрывание орбиталей происходит в направлении, перпендикулярном линии связи (боковое перекрывание). Образующееся при этом связывающее электронное облако имеет плоскость, включающую линию связи и одну из координатных осей. Поскольку линии связи перпендикулярны две оси, между атомами могут возникнуть две p-связи, для которых электронные облака не будут пространственно совмещаться. p-Связь может образовываться за счет р- и d-орбиталей (рис. 9б). Прочность p-связи меньше прочности s-связи, тем не менее образование p-связей дополнительно стабилизирует молекулу.

Рис. 9. Перекрывание электронных орбиталей при образовании s- (а), p- (б) и
d-связей (в).
Дельта-связь (d-связь). Перекрывающиеся орбитали расположены в двух параллельных плоскостях, перпендикулярных линии связи. d-Связь может образоваться в результате перекрывания  -орбиталей взаимодействующих атомов, если линией связи является ось z (рис. 9в); при этом между двумя атомами возможно образование только одной d-связи. Таким образом, максимальная теоретически возможная кратность связи между двумя атомами равна четырем: одна s-, две p- и одна d-связь.
-орбиталей взаимодействующих атомов, если линией связи является ось z (рис. 9в); при этом между двумя атомами возможно образование только одной d-связи. Таким образом, максимальная теоретически возможная кратность связи между двумя атомами равна четырем: одна s-, две p- и одна d-связь.
В качестве примера соединения с s- и p-связями можно привести молекулу азота N2. Атом азота, имеющий электронную конфигурацию 1s22s22p3, характеризуется наличием на валентных энергетических подуровнях электронной пары и трех неспаренных электронов. Наиболее выгодным типом гибридизации в данном случае является sp-гибридизация, при которой сохраняются две "чистые" р-орбитали, обеспечивающие образование двух p-связей:
½¾¾¾¾¾®½
sp-гибридизация
На двух sp-гибридных орбиталях каждого атома азота распределяются три электрона (электронная пара и неспаренный электрон); электронные пары остаются неподеленными, а непарные электроны образуют s-связь, направленную по оси х. Неспаренные электроны образуют две p-связи, ориентированные взаимно перпендикулярно. Структура молекулы :NºN: приведена на рис. 10.

Рис. 10. Строение молекулы азота.
d-Связь реализуется значительно реже, чем s- и p-связи. Примером соединения с d-связью может служить ион [Re2Cl8]2-:

Ионная связь
Ионная связь представляет собой предельный случай полярной связи, когда электроотрицательности взаимодействующих атомов настолько сильно отличаются друг от друга, что связывающая электронная пара полностью переходит от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью, следствием чего является превращение атомов в ионы.
Рассмотрим в качестве примера образование ионной связи во фториде лития. Для этого вспомним электронное строение взаимодействующих атомов и оценим их валентные возможности. Атом лития имеет электронную формулу 1s22s1. Очевидно, что для достижения устойчивой структуры ему необходимо отдать один электрон, расположенный на внешнем энергетическом уровне.
Li(1s22s1) ® Li+(1s2) + e-
Атому фтора, который имеет электронную формулу 1s22s22p5, для достижения устойчивой конфигурации электронной оболочки достаточно присоединить один электрон, источником которого является атом лития:
F(1s22s22p5) + e- ® F-(1s22s22p6)
Электростатическое притяжение образовавшихся ионов и приводит к образованию вещества с ионной связью: Li + F ® Li+ + F- ® Li+F-.
Следует отметить, что описанная картина несколько идеализирована. В реальности полного переноса электрона не происходит, что вызвано поляризующим действием катиона лития, за счет которого он оттягивает на себя часть электронной плотности аниона. Квантово-механический расчет показывает, что в молекуле фторида лития эффективный заряд на атоме лития составляет +0,51, соответственно на атоме фтора -0,51, т.е. связь литий-фтор в значительной мере ковалентна.
Электростатическая природа ионной связи обуславливает ее основные свойства - ненаправленность и ненасыщаемость. Ненаправленность ионной связи обусловлена сферической симметрией электростатического поля иона, вследствие которой заряженная частица притягивает ионы противоположного знака равномерно по всем направлениям.

Образование ионной связи с частицей противоположного заряда нарушает сферическую симметрию поля, но само поле не исчезает. Поэтому, образовав одну ионную связь, ион не утрачивает способность к электростатическому взаимодействию с другими частицами.

Вследствие этого молекулы с ионным типом связи существуют только при высокой температуре в газовой фазе. В конденсированном состоянии ионы стремятся окружить себя максимальным число ионов противоположного знака, что приводит к образованию веществ с немолекулярной структурой - ионных агрегатов (ионных кристаллов).
Общий тип химической связи обуславливает некоторые общие свойства, присущие всем ионным соединениям:
1. Ионные соединения имеют высокую температуру плавления и низкую летучесть. Это явление объясняется сильным электростатическим притяжением между ионами.
2. Ионные соединения, как правило, имеют низкую электрическую проводимость в кристаллическом состоянии, так как ионы, находящиеся в узлах кристаллической решетки, не способны к поступательному движению. Расплавы ионных соединений хорошо поводят электрический ток.
3. Ионные кристаллы тверды, но хрупки. Твердость ионных соединений объясняется отсутствием в них направлений, по которым кристаллическая решетка могла бы расслаиваться, как, например, в случае кристалла графита. Хрупкость ионных кристаллов связана с тем, что даже незначительные деформации решетки сопровождаются сближением одноименно заряженных ионов, в результате чего баланс сил отталкивания и притяжения нарушается, а кристалл раскалывается.
4. Ионные соединения обычно заметно растворимы в полярных растворителях. Полярные растворители характеризуются высокими значениями диэлектрической постоянной (e), которая связана с энергией взаимодействия двух заряженных частиц уравнением:
 ,
,
где Z+ и Z- - заряды взаимодействующих частиц, r - расстояние между ними. Для воды диэлектрическая постоянная составляет 7,25×10-10 Кл2×Дж-1×м-1, тогда как диэлектрическая постоянная вакуума (e0) равна 8,85×10-12 Кл2×Дж-1×м-1, то есть в 82 раза меньше. Изменение диэлектрической постоянной при переходе от вакуума к воде в 82 раза понижает энергию электростатического взаимодействия, что способствует распаду вещества на ионы. Примером других жидкостей с высокими значениями диэлектрической проницаемости могут служить циановодород (e = 158 e0), фтороводород (e = 83,6 e0), муравьиная кислота (e = 57,9 e0), метиловый спирт (e = 37,9 e0), жидкий аммиак (e = 25,0 e0).
Водородная связь
Водородная связь - это связь атома водорода, связанного с сильно электроотрицательным партнером, с атомами других элементов. Этот вид химического взаимодействия уникален и присущ только одному элементу - водороду. Ниже приведена схема образования водородной связи при взаимодействии двух полярных молекул

В образовавшейся частице связь X-H является полярной, а связь H××××Y - водородной (водородная связь обычно обозначается пунктиром).
Атом водорода обычно образует одну водородную связь, но известны бифуркатные (раздвоенные) и трифуркатные водородные связи.
Энергия водородной связи невелика (8 - 40 кДж/моль) и представляет величину того же порядка, что и энергия межмолекулярного взаимодействия. Прочность водородной связи тем выше, чем больше электроотрицательность партнера водорода. Так энергия связи H×××××F составляет 25-40 кДж/моль, связи Н×××××О - 19-21 кДж/моль, связей N×××××H и S××××H - около 8 кДж/моль.
Общая теория водородной связи не разработана до настоящего времени. Можно считать, что по своей природе водородная связь имеет смешанный характер, в силу чего при ее описании следует учитывать два эффекта.
1. Электростатический эффект. В отличие от всех других элементов атом водорода имеет лишь один электрон и при потере последнего превращается не в обычный ион, а в элементарную частицу - протон. В связи с этим водород, образовавший полярную связь, может сильно притягиваться к электронным оболочкам соседних атомов, не связанных с ним ковалентно; силы межэлектронного отталкивания при этом не возникают.
2. Эффект донорно-акцепторного взаимодействия. При сильном смещении общей электронной пары, образующей полярную связь, к электроотрицательному партнеру атом водорода проявляет акцепторные свойства и способен взаимодействовать с электронными парами другого атома, хотя образующаяся при этом связь менее прочная, чем при наличии у водорода вакантной электронной орбитали.
Различают два типа водородной связи.
Межмолекулярная водородная связь образуется между двумя или несколькими молекулами, одинаковыми или различными. Типичным примером вещества с межмолекулярными водородными связями является фтороводород, который образует ассоциаты (HF)n во всех агрегатных состояниях; при этом в газообразном фтороводороде значения n не превышают 4, а в жидком – n больше чем 4. Ассоциаты фтороводорода представляют собой цепи, состоящие из линейных (F¾H×××××F) и угловых (H××××F¾H) фрагментов:

При этом длина водородной связи H×××××F больше длины полярной связи. При достаточно высоких значениях n эти цепи могут замыкаться в циклы.
Образование ассоциатов за счет водородных связей характерно для воды. В жидкой воде образуются ассоциаты (Н2О)n, простейшим из которых является дигидроль (Н2О)2, для которого водородная связь в 1,8 раза длиннее полярной. В кристаллической воде каждый атом водорода образует одну полярную и одну водородную связь, а кислород участвует в образовании четырех связей - двух полярных и двух водородных (по числу электронных пар). Структурной единицей льда является тетраэдр, в котором центральный атом кислорода соединен с четырьмя атомами водорода, а каждый атом водорода - с двумя атомами кислорода во фрагменте О¾Н×××××О.
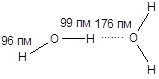
Муравьиная кислота НСООН в жидком и газообразном состояниях за счет водородных связей образует циклические димеры:

Внутримолекулярная водородная связь образуется между атомами одной и той же молекулы. При образовании внутримолекулярной водородной связи обычно наблюдается замыкание пяти- или шестичленных циклов. Например, для молекулы 2,6-дигидроксибензойной кислоты наблюдается образование двух внутримолекулярных водородных связей:

Образование водородных связей влияет на свойства вещества, а именно повышает температуры и энтальпии кипения и кристаллизации соответствующих соединений, увеличивает их теплоемкость. Так, если бы в воде отсутствовали водородные связи, она кипела бы при -80 °С, а кристаллизовалась бы при -100 °С. Теплоемкость воды также аномально велика и составляет при стандартных условиях 4,2 Дж×г-1×К-1, что в 2-3 раза больше теплоемкости жидкостей, не образующих водородных связей.
Следствием образования водородных связей могут также быть аномалии плотности вещества. Например, плотность жидкой воды максимальна при 4 °С, а плотность льда ниже плотности жидкой воды. Это может быть объяснено ажурной структурой льда, обусловленной образованием большого числа водородных связей и наличием полостей в кристаллической структуре воды. При плавлении льда примерно 10 % водородных связей разрушается, и плотность воды возрастает. Отметим также, что образование водородных связей между растворителем и растворенным веществом благоприятствует увеличению растворимости.
3.9. Агрегатное состояние вещества
В зависимости от расстояниями между частицами вещества и сил их взаимодействия выделяют четыре основные агрегатные состояния вещества: плазма, газ, жидкость и твердое тело. Последние два состояния называют конденсированными.
Плазма - это состояние ионизированного газа, представляющего собой смесь нейтральных атомов, электронов, ионов и атомных ядер. Различают холодную (10-100 тыс.град.) и горячую (свыше 100 тыс.град.) плазму.
Газообразное состояние вещества характеризуется отсутствием заметного взаимодействия между молекулами, способными свободно перемещаться друг относительно друга. Состояние идеального газа, который можно рассматривать как совокупность материальных точек, описывается уравнением Менделеева-Клапейрона:
рV = nRT
Состояние реального газа передается уравнением Ван-дер-Ваальса:
 ,
,
где Vm - молярный объем газа, a и b - экспериментальные параметры, учитывающие объем молекул и силы взаимодействия между молекулами.
Жидкое состояние характеризуется наличием ближнего порядка (упорядоченности) в расположении частиц, способных легко перемещаться друг относительно друга. Аморфное состояние является одной из разновидностей твердого состояния вещества, и может рассматриваться как переохлажденная жидкость, поэтому оно термодинамически нестабильно. Аморфное состояние близко по своим свойствам к жидкому и характеризуется наличием ближнего порядка в расположении частиц, неспособных свободно перемещаться друг относительно друга.
Кристаллическое состояние твердых веществ характеризуется наличием дальнего порядка в расположении частиц, неспособных свободно перемещаться друг относительно друга. Отличительной особенностью кристаллического тела является строго определенная форма и анизотропия - зависимость физических свойств вещества от направления в пространстве.
Кристалл - это твердое тело, ограниченное плоскими поверхностями (гранями). Строгость формы кристалла является отражением строгости его внутреннего строения. Идеальный кристалл характеризуется бесконечной пространственной решеткой, состоящей из идентичных элементарных ячеек. Существует 14 типов кристаллических решеток (решеток Бравэ), принадлежащих семи кристаллографическим системам (сингониям), которые отличаются соотношением параметров элементарной ячейки. Последние не обязательно совпадают с прямоугольной системой координат.

Наиболее высокосимметричной является кубическая сингония (a = b = c; a = b = g = 90°), включающая решетки нескольких типов:

Примитивная Объемноцентрированная Гранецентрированная
В зависимости от природы химической связи между частицами различают ковалентные, ионные, металлические и молекулярные кристаллы.
Промежуточным между жидким и кристаллическим является жидкокристаллическое состояние вещества, для которого характерно наличие дальнего порядка в расположении частиц, способных свободно перемещаться друг относительно друга. Жидкокристаллическое (мезоморфное) состояние могут образовывать вещества, которые имеют вытянутые асимметричные молекулы, например:
При плавлении вещества данного типа, молекулы ориентируются параллельно с образование мезоморфной фазы. При этом, с одной стороны, наблюдается дальний порядок расположения частиц и анизотропия свойств, характерные для кристалла. С другой стороны, возможна подвижность частиц, обусловливающая текучесть, характерную для жидкости.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
4.1. Предмет и основные понятия химической термодинамики
Химические реакции являются одним из важнейших объектов изучения химической науки. Теория химических процессов изучает общие закономерности реакций, направление их протекания, влияние различных факторов на химическое взаимодействие. Основными разделами теории химических процессов являются химическая термодинамика, химическая кинетика и учение о химическом равновесии, а предметом изучения - термодинамические системы.
Термодинамическая система - это тело или совокупность тел в объеме, ограниченном от окружающей среды реальными или условными перегородками.
Можно выделить три типа термодинамических систем:
1. Изолированные системы не обмениваются с окружающей средой ни веществом, ни энергией. Изолированная система - абстрактное понятие, не реализуемое в окружающем нас мире. Реальные системы могут лишь приближаться к изолированным.
2. Закрытые системы обмениваются с окружающей средой энергией, но не обмениваются веществом. Примером такой системы может служить герметизированный сосуд, заполненный газом.
3. Открытые системы обмениваются с окружающей средой и веществом, и энергией. В качестве примера открытой системы можно привести работающую доменную печь. Организмы человека, животных и растений тоже являются открытыми системами.
Вещества, способные к самостоятельному существованию, которые могут быть выделены из системы, называются составными частями системы. Например, система образована смешиванием растворов хлорида бария и сульфата калия. Число составных частей этой системы будет равно шести, так как из системы можно выделить BaCl2 × 2H2O, BaCl2, K2SO4, BaSO4, KCl и H2O.
Любая система включает одну или несколько фаз. Фаза – это совокупность однородных частей системы, одинаковых по составу, физическим и химическим свойствам и отделенных от других частей системы поверхностями раздела. Так, насыщенный раствор хлорида натрия является однофазной системой, состоящей из двух составных частей. Система, содержащая лед, жидкую воду и водяной пар - трехфазная система с одной составной частью. Системы, состоящие из одной фазы, называются гомогенными, системы, включающие несколько фаз - гетерогенными. Переход вещества из одной фазы в другую называется фазовым переходом. Примером фазовых переходов могут служить плавление, кристаллизация или кипение вещества.
Важной характеристикой системы является ее компонентность. Очевидно, что для образования системы не обязательны все составные части этой системы. Наименьшее число составных частей системы, необходимое и достаточное для ее образования, называется компонентностью данной системы, а необходимые составные части - компонентами. Например, число компонентов системы, состоящей из карбоната кальция, оксида кальция и диоксида углерода, в которой протекает реакция:
СаСО3  СаО + СО2,
СаО + СО2,
равно двум (двухкомпонентная система). Действительно, для образования этой системы достаточно взять два любых вещества из трех составных частей. В общем случае число компонентов равно числу составных частей минус число протекающих в системе реакций.
Термодинамические функции.
Термохимия. Закон Гесса
Термохимия - раздел химической термодинамики, рассматривающий тепловые эффекты реакций и связанные с ними расчеты. Такие расчеты выполняют с использованием термохимических уравнений, которые отличаются от обычных химических уравнений следующими особенностями:
1. Коэффициенты в термохимических уравнениях указывают не число атомов и молекул, участвующих во взаимодействии, а количества вещества. В силу этого в подобных уравнениях допустимо использование дробных коэффициентов, которые обычно подбирают таким образом, чтобы коэффициент перед целевым продуктом реакции равнялся единице.
2. В термохимических уравнениях указывается тепловой эффект реакции (обычно величина ΔН). Тепловой эффект при этом относят к числу молей реагентов и продуктов реакции, определяемых коэффициентами уравнения, и выражают в кДж.
3. В термохимических уравнениях обязательно указывают агрегатное состояние реагентов и продуктов реакции, поскольку фазовые переходы сопровождаются выделением или поглощением энергии. Агрегатное состояние вещества обозначают сокращениями: к - кристаллическое, ж - жидкое, г - газообразное, р - растворенное.
Тепловые эффекты обычно относят к стандартным условиям (температура 298 К, давление 1,01325.105 Па); стандартные энтальпии обозначают символом  .
.
Термодинамические уравнения более информативны, чем обычные химические уравнения. Так, из уравнения реакции:
2Н2 + О2 = 2Н2О
следует, что из двух молекул водорода и одной молекулы кислорода образуются две молекулы воды. Термохимическое уравнение этой реакции имеет следующий вид:
2Н2(г) + О2(г) = 2Н2О(г);  = -483,64 кДж
= -483,64 кДж
Из него следует, что при образовании двух молей водяного пара из двух молей водорода и моля кислорода в газообразном состоянии выделяется 483,64 кДж теплоты при стандартных условиях. Если расчет имеет целью определить тепловой эффект образования моля газообразной воды, уравнение можно записать так:
Н2(г) +  О2(г) = Н2О(г);
О2(г) = Н2О(г);  = -241,83 кДж/моль
= -241,83 кДж/моль
Поскольку термохимические уравнения и их тепловые эффекты относят к макроколичествам веществ, с ними можно выполнять разнообразные алгебраические операции: их можно складывать, вычитать, умножать на некоторые величины и т.д.
Основным законом термохимии, на основании которого проводят термохимические расчеты, является закон, сформулированный Г. И. Гессом в1841 г.: т епловой эффект химической реакции определяется начальным и конечным состоянием системы и не зависит от пути проведения процесса и числа промежуточных стадий.
Например, если реакцию
А(г) + 2В(г) = АВ2(г); ΔН1
провести в две стадии
А(г) + В(г) = АВ(г); ΔН2,
АВ(г) + В(г) = АВ2(г); ΔН3,
то сумма тепловых эффектов отдельных стадий будет равна тепловому эффекту суммарной реакции
ΔН1 = ΔН2 + ΔН3
Связь между тепловыми эффектами химической реакции и ее отдельных стадий может быть представлена наглядно с помощью энтальпийных диаграмм. На энтальпийных диаграммах значениям энтальпии для различных состояний системы соответствуют ступеньки, расстояние между которыми равны тепловым эффектам перехода из одного состояния в другое (рис. 14); стрелки, направленные вниз, соответствуют выделению энергии, стрелки, направленные вверх, - ее поглощению.

Рис. 14. Энтальпийная диаграмма для реакции А + 2В = АВ2.
Закон Гесса позволяет решать многие практически важные задачи. Прежде всего отметим, что этот закон позволяет выражать тепловые эффекты реакций через энтальпии образования веществ, участвующих во взаимодействии.
Энтальпия образования - это изменение энтальпии системы при синтезе одного моля вещества из простых веществ. Эта величина обозначается символом ΔНf




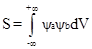 ,
,
 -орбиталей возникнуть не может, так как эти орбитали перекрываются в том же направлении, что и px-орбитали.
-орбиталей возникнуть не может, так как эти орбитали перекрываются в том же направлении, что и px-орбитали.
 -орбиталей взаимодействующих атомов, если линией связи является ось z (рис. 9в); при этом между двумя атомами возможно образование только одной d-связи. Таким образом, максимальная теоретически возможная кратность связи между двумя атомами равна четырем: одна s-, две p- и одна d-связь.
-орбиталей взаимодействующих атомов, если линией связи является ось z (рис. 9в); при этом между двумя атомами возможно образование только одной d-связи. Таким образом, максимальная теоретически возможная кратность связи между двумя атомами равна четырем: одна s-, две p- и одна d-связь.



 ,
,

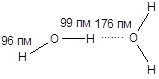
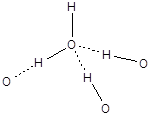


 ,
,



 СаО + СО2,
СаО + СО2, .
. О2(г) = Н2О(г);
О2(г) = Н2О(г); 


