Антибиотикорезистентность — это устойчивость микробов к антимикробным химиопрепаратам. Бактерии следует считать резистентными, если они не обезвреживаются такими концентрациями препарата, которые реально создаются в макроорганизме. Резистентность может быть природной и приобретенной.
Природная устойчивость. Некоторые виды микробов природно устойчивы к определенным семействам антибиотиков или в результате отсутствия соответствующей мишени (например, микоплазмы не имеют клеточной стенки, поэтому не чувствительны ко всем препаратам, действующим на этом уровне), или в результате бактериальной непроницаемости для данного препарата (например, грамотрицательные микробы менее проницаемы для крупномолекулярных соединений, чем грамположительные бактерии, так как их наружная мембрана имеет «маленькие» поры).
Приобретенная устойчивость. Бактерии стали чрезвычайно быстро приспосабливаться, постепенно формируя устойчивость ко всем новым препаратам. Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Возможны ситуации, когда большая часть микробной популяции проявляет приобретенную устойчивость. Появление у бактерий приобретенной резистентности не обязательно сопровождается снижением клинической эффективности антибиотика.
Приобретение резистентности — это биологическая закономерность, связанная с адаптацией микроорганизмов к условиям внешней среды. В разной степени резистентность характерна для всех бактерий и всех антибиотиков. К химиопрепаратам адаптируются не только бактерии, но и остальные микробы — от эукариотических форм (простейшие, грибы) до вирусов. Проблема формирования и распространения лекарственной резистентности микробов особенно значима для внутрибольничных инфекций, вызываемых так называемыми «госпитальными штаммами», у которых, как правило, наблюдается множественная устойчивость к антибиотикам (так называемая полирезистентность ). Бактерии, способные к полирезистентности, являются природными хранилищами генов лекарственной устойчивости. Как известно, мутации, в том числе по признаку лекарственной устойчивости, спонтанны и возникают всегда.
Плазмидная устойчивость приобретается микробными клетками в результате процессов генетического обмена. Сравнительно высокая частота передачи R-плазмид обеспечивает широкое и достаточно быстрое распространение устойчивых бактерий в популяции, а селективное давление антибиотиков — отбор и закрепление их в биоценозах. Плазмидная устойчивость может быть множественной, т. е. к нескольким лекарственным препаратам, и при этом достигать достаточно высокого уровня.
Формирование резистентности во всех случаях обусловлено генетически: приобретением новой генетической информации или изменением уровня экспрессии собственных генов.
Биохимическую основу резистентности обеспечивают разные механизмы:
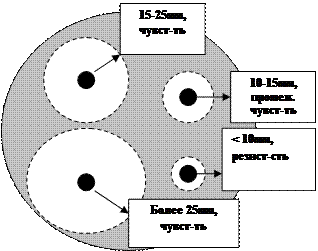
• энзиматическая инактивация антибиотиков — осуществляется с помощью синтезируемых бактериями ферментов, разрушающих активную часть антибиотиков. Одним из таких широко известных ферментов является бета-лактамаза, обеспечивающая устойчивость микроорганизмов к бета-лактамным антибиотикам за счет прямого расщепления бета-лактамного кольца этих препаратов. Другие ферменты способны не расщеплять, а модифицировать активную часть молекулы антибиотиков, как это имеет место при энзиматической инактивации аминогликозидов и левомицетина;
• изменение проницаемости клеточной стенки для антибиотика или подавление его транспорта в бактериальные клетки. Этот механизм лежит в основе устойчивости к тетрациклину;
• изменение структуры компонентов микробной клетки, например, изменение структуры бактериальных рибосом, сопровождается повышением устойчивости к аминогликозидам и макролидам, а изменение структуры РНК-синтетаз — к рифампицину;
• образование бактериями “обходного” пути метаболизма;
• формирование механизмов активного выведения антибиотика из клетки.
У бактерий одного и того же вида могут реализовываться несколько механизмов резистентности. В то же время развитие того или другого типа резистентности определяется не только свойствами бактерий, но и химической структурой антибиотика.
Для борьбы с лекарственной устойчивостью, т. е. для преодоления резистентности микроорганизмов к химиопрепаратам, существует несколько путей:
• соблюдение принципов рациональной химиотерапии;
• создание новых химиотерапевтических средств, отличающихся механизмом антимикробного действия (например, созданная в последнее время группа химиопрепаратов — фторхинолоны) и мишенями;
• постоянная ротация (замена) используемых в данном лечебном учреждении или на определенной территории химиопрепаратов (антибиотиков);
• комбинированное применение бета-лактамных антибиотиков совместно с ингибиторами бета-лактамаз (клавулановая кислота, сульбактам, тазобактам).Например, амоксиклав (амоксициллин+клавунат натрия и др.). Известен также ряд средств, обладающих наряду с антибактериальным действием, способностью элиминировать плазмиды резистентности к другим антибиотикам — например, фторхинолоны, хлоргексидин.
Из-за формирования антибиотикоустойчивых популяций микроорганизмов с целью эффективного лечения необходимо предварительно определять чувствительность данного антибиотика к выделенной культуре возбудителя.
6. Методы определения чувствительности микроорганизмов к антибиотикам
Критериями активности того или иного препарата выступают минимальная ингибирующая концентрация (МИК) — наименьшая концентрация препарата, тормозящая рост тест-культуры, и минимальная бактерицидная концентрация (МБК) — наименьшая концентрация препарата, вызывающая бактерицидный эффект, т.е. гибель 99,9 % микроорганизмов.
Основными методами определения антибиотикочувствительности бактерий in vitro является метод серийных разведений, диффузии в агар (бумажных дисков), ускоренные методы определения чувствительности к антибактериальным препаратам, определение способности к продукции бета-лактамазы, Е-тест.
Определение чувствительности микроорганизмов к антибактериальным препаратам методом серийных разведений (количественный метод). Данный метод определения антибиотикочувствительности является количественным и позволяет определить МИК и МБК. Серийный метод титрования может быть выполнен в разных объемах среды (от 1 до 10 мл). Эксперименты выполняются в условиях асептики при использовании стерильных пипеток для каждого ингредиента реакции. Титрование можно проводить в плотных и жидких средах.
При титровании в жидких средах в ряд пробирок наливают питательную среду в строго определенном объеме. Количество пробирок определяется количеством разведений препарата, которое необходимо взять в опыт. В 1-ю пробирку вносят определенное количество раствора антибиотика, перемешивают, затем определенный объем смеси из 1-й пробирки переносят во 2-ю, перемешивают и переносят то же количество смеси из 2-й в 3-ю и т. д. Из последней пробирки, содержащей антибиотик, такой же объем смеси выливают, чтобы во всех пробирках объем жидкости был одинаков. Кратность разведения антибиотика обычно выбирают равной двум. Пробирка, не содержащая антибиотика, является контрольной. После этого во все пробирки, содержащие серийно разведенный антибиотик, и в контрольную пробирку вносят одинаковое количество взвеси тест-культуры. Штатив с пробирками встряхивают и ставят в термостат при 37°С на 18—20 ч.
Взвесь клеток исследуемой культуры готовят на изотоническом растворе хлорида натрия при обязательном сравнении со стандартами мутности.
Метод серийных разведений в плотных средах отличается тем преимуществом, что микробы-загрязнители при этом легко выявляются и не изменяют общих результатов титрования, тогда как на жидких средах весь опыт может оказаться безрезультатным из-за попадания в пробирки хотя бы единичных клеток посторонних устойчивых микроорганизмов. Этот метод используют и при работе с микроорганизмами, которые не растут на обычных жидких средах, например, микобактерии туберкулеза. Готовят ряд серийных разведений антибиотика, а затем вносят по 1 мл каждого разведения в пробирку, содержащую 4 мл расплавленной и охлажденной до 45—50°С агаризованной среды. Затем пробирки скашивают до застывания агара, а на поверхность плотной среды петлей засевают взвесь тест-культуры.
Для выявления бактерицидного действия препарата делают высев на МПА из всех пробирок, где визуально не отмечен рост микроорганизма (рис. 17).




 MИК=1 мг/мл
MИК=1 мг/мл
24 часа








 37°С
37°С
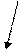

 8 4 2 1 0,5 0,25 8 4 2 1 0,5 0,25
8 4 2 1 0,5 0,25 8 4 2 1 0,5 0,25
Рис. 17. Определение чувствительности микроорганизмов к антибактериальным препаратам методом серийных разведений
Определение чувствительности микроорганизмов методом дисков (качественный метод) — метод диффузии в агар с применением стандартных дисков, пропитанных различными антибиотиками в определенных концентрациях (рис. 18). Оценка результатов связана с существованием зависимости между размером зоны подавления роста исследуемых культур вокруг дисков и значениями МИК соответствующих антибиотиков (чувствительностью микроорганизмов). Имеются специальные таблицы для оценки результатов, в соответствии с которыми культуры определяют как чувствительные, промежуточно чувствительные и устойчивые (резистентные) к тестируемому антибиотику. Диско-диффузионный метод используется для оценки эффективности антибиотиков в клинических условиях. Питательную среду (Мюллера-Хинтона-2, АГВ) разливают в чашки, помещенные на строго горизонтальной поверхности, заполнив их на одинаковую высоту 4 мм (25 мл среды для чашек с внутренним диаметром 9 см). Клинический материал или культуру микроорганизмов, выделенную от больного, засевают на поверхность питательного агара сплошным газоном.
| | | | |
| | |  |
| |  |
| |
После посева крышку чашки приоткрывают не более чем на 15 мин и дают поверхности среды подсохнуть. Затем стерильным пинцетом следует положить на поверхность агара бумажные диски, пропитанные раствором определенного антибиотика, и слегка придавить. Расстояние между дисками и краем чашки должно быть не менее 15 мм.
Рис. 18. Определение чувствительности микроорганизмов к антибактериальным препаратам диско-диффузионным методом.
Чашки инкубируют около 18 ч при 37°С в перевернутом положении. При наличии чувствительной к антибиотику микрофлоры вокруг соответствующих дисков отмечается зона угнетения роста микроорганизмов. Диаметр зоны измеряют с точностью до 1 мм, определяя чувствительность (чувствительность, промежуточная чувствительность и резистентность).
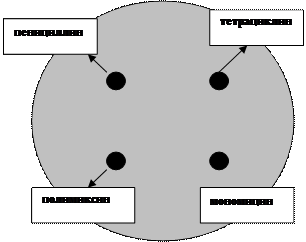
Элипсометрический метод (Е-тест) занимает промежуточное положение между методом бумажных дисков и методом серийных разведений, являясь качественно-количественным методом (рис. 19). В нем используется узкая полоска полимера, пропитанная разными концентрациями антибиотика (от минимальных до максимальных), которая наносится на поверхность плотной питательной среды, предварительно засеянной испытуемой культурой. Задержка роста культуры вокруг полоски наблюдается в той зоне, где концентрация антибиотика выше МИК. На поверхности полоски нанесены величины концентрации антибиотика в каждом участке. Если культура обладает чувствительностью к антибиотику, то зона задержки роста имеет каплевидную (элипсовидную) форму. За величину минимальной ингибирующей концентрации (МИК) антибиотика принимают отрезок полоски, к которому вплотную подходит рост микроба.
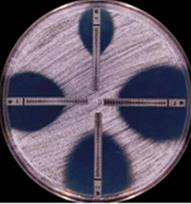
Рис. 19. Определение чувствительности микроорганизмов с помощью Е-тестов.
Интерпретация результатов определения чувствительности микробных культур
На основании получаемых количественных данных (диаметра зоны подавления роста антибиотика или значения МИК) микроорганизмы подразделяют на чувствительные, промежуточно чувствительные и резистентные.
Чувствительные микроорганизмы (S — sensible). Клинически к чувствительным относят бактерии (с учетом параметров, полученных in vitro), если при лечении стандартными дозами антибиотика инфекций, вызываемых этими микроорганизмами, наблюдают хороший терапевтический эффект.
Резистентные микроорганизмы (R — resistant). К резистентным (устойчивым) относят бактерии, когда при лечении инфекции, вызванной этими микроорганизмами, нет эффекта от терапии даже при использовании максимальных доз антибиотика. Такие микроорганизмы имеют механизмы резистентности.
Микроорганизмы с промежуточной чувствительностью (I — intermediate). Клинически промежуточную чувствительность у бактерий подразумевают в случае, если инфекция, вызванная такими штаммами, может иметь различный терапевтический исход. Однако лечение может быть успешным, если антибиотик используется в дозировке, превышающей стандартную, или инфекция локализуется в месте, где антибактериальный препарат накапливается в высоких концентрациях.
Значение минимальной бактерицидной концентрации используют при терапии антибиотиками, обладающими бактериостатическим действием, или при отсутствии эффекта от антибактериальной терапии у особой категории больных. Частными случаями для определения МБК могут быть, например, бактериальный эндокардит, остеомиелит или генерализованные инфекции у пациентов с иммунодефицитными состояниями.
III. План практической работы
1. Определить спектр действия антибиотиков
Для определения спектра действия антибактериальных препаратов применяется метод «дорожек Флеминга». Для проведения используется чашка Петри с плотным питательным агаром. В центре вырезают бороздку, в которую помещают раствор антибактериального препарата определенной концентрации. По краям от бороздки производят посев тестовых культур методом перпендикулярных штрихов. В качестве тестовых культур используют S.aureus (грамположительные кокки), E.coli (грамотрицательные палочки), B.subtilis (спорообразующие грамположительные палочки). Антибактериальный препарат диффундирует в толщу агара, и происходит подавление роста тестовой культуры, при условии ее чувствительности. Спектр действия определяется количеством тест-культур, чувствительных к действия данного антибактериального препарата: 1, 2 тест-культуры — узкий спектр, все тест-культуры — широкий спектр действия.
2. Определить чувствительности микроорганизмов к антибиотикам методом серийных разведений (количественный метод). См подробнее в тексте.
Делается последовательный ряд двукратных разведений антибиотика в МПБ, затем в каждую пробирку вносится равное количество исследуемой культуры. Ставят в термостат на 18-20 часов. Последняя прозрачная пробирка показывает бактериостатическую концентрацию (микроорганизмы не размножаются, но и не погибают). Для определения бактерицидной концентрации (гибель микробов) делают пересев из прозрачных пробирок на МПА, не содержащий антибиотика.
3. Определить чувствительность микроорганизмов к антибиотикам методом бумажных дисков (качественный метод). См подробнее в тексте.
Исследуемую культуры засевают газоном на питательную среду. После посева крышку чашки приоткрывают и дают поверхности среды подсохнуть. Затем стерильным пинцетом поместить бумажные диски, пропитанные раствором определенного антибиотика на поверхность агара и слегка придавить. Чашки инкубируют около 18 ч при 37°С в перевернутом положении. При наличии чувствительной к антибиотику флоры вокруг соответствующих дисков отмечается зона угнетения роста микроорганизмов. Учёт чувствительности измеряют по диаметру зоны задержки роста в мм.
4. Определить чувствительность микрофлоры зева к антибиотикам с помощью Е-теста.
Полоски из фильтровальной бумаги, пропитанной различными концентрациями антибиотика, помещают на поверхность агара. При чувствительности бактерий к действию препарата, вокруг участков полости образуется эллипсовидная зона. МИК соответствует участок полоски, где ее пересекает граница зоны задержки роста (рис. 17).
5. Разобрать основные группы химиопрепаратов и антибиотиков
6. Заполнить таблицы «Классификация антимикробных препаратов по механизму действия»
7. Решить ситуационные задачи
УИРС. Определить чувствительность микрофлоры зева к антимикробным препаратам.









 MИК=1 мг/мл
MИК=1 мг/мл





 8 4 2 1 0,5 0,25 8 4 2 1 0,5 0,25
8 4 2 1 0,5 0,25 8 4 2 1 0,5 0,25