1) Использование цветных стеклянных контейнеров и хранение в темном месте. Янтарное стекло не пропускает свет с длиной волны меньше чем 470 нм, и таким образом обеспечивает защиту соединений, которые чувствительны к ультрафиолетовому свету.
2) В качестве дополнительной защиты от света, было предложено покрывать таблетки полимерными пленками, содержащие поглотители (абсорберы) ультрафиолетового света. В этом плане пленочные покрытия из винилацетата, содержащие оксибензон в качестве поглотителя ультрафиолетовых лучей, показали себя эффективно в уменьшении обесцвечивании и фотолитической деградации сульфасомидиновых таблеток.
Полимеризация
Полимеризация - процесс в котором две или более идентичные молекулы соединяются, образуя комплексную молекулу. Выявлено, что процесс полимеризации происходит при хранении концентрированных водных растворов аминопенициллина, также как и при хранении ампициллина натрия. Реактивные связи β-лактама в молекуле ампициллина раскрываются с помощью реакции с боковой цепью второй молекулы ампициллина, при этом образуется димер
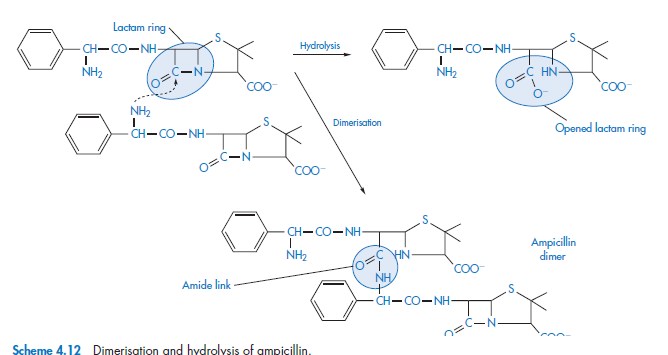
Процесс может продолжаться до образования высших полимеров. Такие полимеры показали себя высоко антигенными веществами в животных организмах, считается, что они учавствуют в выявлении пенициллоспецифических аллергических реакциях к ампициллину в человеке. Тенденция к димеризации ампициллина возрастает с увеличением основности функциональных групп боковой цепи, по увеличению основности циклациллин << ампициллин< эпициллин < амоксициллин.
Гидрат формальдегида, HOCH2OH, при определенных условиях может полимеризоваться в водном растворе с образованием формальдегида, HOCH2(OCH2)nOCH2OH, который появляется в виде белого осадка в растворе. Полимеризацию можно предотвратить путем добавления в раствор метанола 10-15%.
14. Стабильность лекарственных веществ. Кинетика химического распада в растворе. Порядок реакции. Реакции нулевого порядка. Реакции первого порядка. Реакции второго порядка. Приведите примеры.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD +... ––> еЕ +...
можно записать:
 (II.4)
(II.4)
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ.
Порядок химической реакции
Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции есть частный порядок реакции по данному компоненту.
Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. ( Реакции классифицируются по количеству реагирующих видов, концентрация которых определяет скорость, с которой происходит реакция, то есть порядок реакции.)
порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции.






 (II.4)
(II.4)

