Если компонент в растворе является неэлектролитом, его химический потенциал в разбавленном растворе при моляльности m, можно рассчитать из  и где М1- молекулярная масса растворителя.
и где М1- молекулярная масса растворителя.
Box3.5 Химический потенциал в двухфазной системе
Рассмотрим систему из двух фаз, a и b, находящихся в равновесии при постоянной температуре и давлении. Если небольшое количество вещества переходит из фазы a к фазе b, а также, так как изменение свободной энергии в целом равно нулю, мы имеем: *формула 3.46*. Где dGa и dGb это изменения свободной энергии, сопровождающие передачу материала для каждой фазы. Из уравнения 3.44 (приведена формула), и поэтому:

Уменьшение dn молей компонента в фазе a, приводит к увеличению ровно на dn молей этого компонента в фазе b, т.е. *формула 3.48*. Подстановка уравнения 3.48 в уравнение 3.47 приводит к результату *формула 3.49*.
В целом, химический потенциал компонента одинаков во всех фазах системы в состоянии равновесия при фиксированной температуре и давлении.
Box 3.6 Химический потенциал компонента в растворе

6. Физико-химические свойства лекарственных веществ в растворе. Осмотические свойства растворов лекарственных препаратов. Осмотическое давление. Осмолярность и осмоляльность. Клиническая значимость осмотических эффектов. Подготовка изотонического раствора.
Осмотические свойства растворов препаратов
Коллигативные свойства: величина давления пара, температуру замерзания и температуру кипения - степень изменения зависит от числа растворенных молекул находящиеся в растворе, а не от концентрации раствора. с фармацевтической точки зрения.наиболее важным из них является осмотическое давление,
Осмотическое давление
Всякий раз, когда раствор отделяют от растворителя c помощью мембраны, проницаемая только для молекул растворителя (называется «полупроницаемая мембрана»), возникает переход растворителя через мембрану в другой раствор. Это явление осмоса. Если раствор полностью ограничен полупроницаемой мембраной и погружен в растворитель, то возникает перепад давления по обе стороны мембраны, это называется «осмотическое давление». Растворитель проходит через мембрану, за счет неравенства химических потенциалов на другой стороне мембраны. Поскольку химический потенциал молекулы растворителя в растворе меньше чем в чистом растворителе, растворитель будет резко поступать в раствор, до тех пор, пока не установится равенство потенциалов. Уравнение, связывающее осмотическое давление раствора, П, с концентрацией раствора является уравнением Вант-Гоффа
Π V = n2RT 
Для учета аномального поведения электролитов в растворе, вводится поправочный коэффициент, i.
Поскольку изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации, получаем:
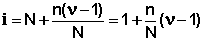
 ν – число ионов, на которое диссоциирует молекула
ν – число ионов, на которое диссоциирует молекула
Соотношение i/v называется «практический осмотический коэффициент» - ф
Для неидеальных растворов, активность и осмотическое давление связаны с выражением
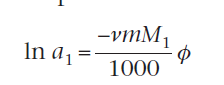 где M1 - молярная масса растворителя, m - полярность раствора.
где M1 - молярная масса растворителя, m - полярность раствора.
Отношение между осмотическим давлением и осмотически коэффициентом:
 Где СРЕДНЕЕ ЗНАЧЕНИЕ V1 - частичный моляльный объем растворителя.
Где СРЕДНЕЕ ЗНАЧЕНИЕ V1 - частичный моляльный объем растворителя.
Осмоляльнось и осмолярность
Экспериментально полученное осмотическое давление часто выражается как осмоляльность ξ m,являющийся массой растворенного вещества, которое при растворении в 1 кг воды будет влиять на осмотическое давление, П’, равное влиянию 1 моля идеального неионизированного вещества, растворенного в 1 кг воды. Единица измерения осмоляльности является осмоль, выражающий количество вещества, которое диссоциирует с образованием одного моля осмотически активных частиц, таким образом, 1 моль глюкозы (неионизированной) образует 1 осмоль растворенного вещества, в то время как 1 моль NaCl образует 2 осмоль (1 моль Na+ и 1 моль Cl-). В практике это означает, что 1 моляльный раствор NaCl будет иметь (приблизительно) двойную осмоляльность (осмотическое давление) в отличие от одномоляльного раствора глюкозы.
Согласно определению, Em=П/П’. Значение П’ может быть получен из уравнение  отметив, что для идеального неионизированного вещества v=ф=1, и поскольку m - едино, уравнение
отметив, что для идеального неионизированного вещества v=ф=1, и поскольку m - едино, уравнение
 ПРИМЕР 3.3 Расчет осмоляльности
ПРИМЕР 3.3 Расчет осмоляльности
Раствор NaCl 0.90% (M.м.=58,5) имеет осмотический коэффициент равное 0.928. Расчет осмоляльности в растворе.
ОТВЕТ
Осмоляльность определяется уравнением Em=vmф
Em= 2 x (9.0/58.5) x 0.928 = 286 мосмоль кг^(-1
Фармацевтические правила маркировки иногда требуют ведомости об осмолярности; например USP27 требует, чтобы препараты NaCl для иньекции должны быть маркированы именно таким образом. Осмолярность определяется как масса растворенного вещества, при растворении в 1 л раствора, осмотическое давление которого равно давлению оказываемого 1 моль идеального неионизированного вещества, растворенное в 1 л раствора.





 и где М1- молекулярная масса растворителя.
и где М1- молекулярная масса растворителя.


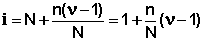
 ν – число ионов, на которое диссоциирует молекула
ν – число ионов, на которое диссоциирует молекула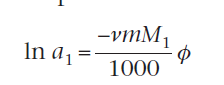 где M1 - молярная масса растворителя, m - полярность раствора.
где M1 - молярная масса растворителя, m - полярность раствора. Где СРЕДНЕЕ ЗНАЧЕНИЕ V1 - частичный моляльный объем растворителя.
Где СРЕДНЕЕ ЗНАЧЕНИЕ V1 - частичный моляльный объем растворителя. ПРИМЕР 3.3 Расчет осмоляльности
ПРИМЕР 3.3 Расчет осмоляльности

