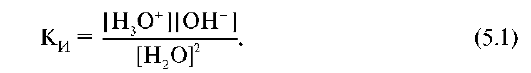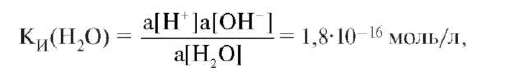Таким образом, согласно этой теории кислотой называют всякое вещество, молекулы которого (в том числе и ионы) способны отдавать протон, т.е. быть донором протонов; основанием называют всякое вещество, молекулы которого (в том числе и ионы) способны присоединять протон, т.е. быть акцептором протонов; амфолитом называют всякое вещество, которое является и донором, и акцептором протонов.
Данная теория объясняет кислотно-основные свойства не только нейтральных молекул, но и ионов. Кислота, отдавая протон, превращается в основание, которое является сопряженным этой кислоте. Понятия «кислота» и «основание» являются относительными понятиями, так как одни и те же частицы - молекулы или ионы - могут проявлять как основные, так и кислотные свойства в зависимости от партнера.

При протолитическом равновесии образуются кислотно-основные пары. Согласно протонной теории, гидролиз, реакции ионизации и нейтрализации не рассматриваются как особое явление, а считаются обычным переходом протонов от кислоты к основанию.

.

| НА
| +
| Н2О
| ↔
| А–
| +
| Н3О+
| | кислота
|
| основание
|
| сопряженное основание
|
| сопряженная кислота
| Образующаяся после отделения иона водорода частица А
|
называется сопряженным данной кислоте основанием, т.к. она способна снова присоединять к себе ион Н+.
Соответственно, частица, полученная после присоединения к основанию иона Н+, называется сопряженной данному основанию кислотой, т.к. способна отдавать его обратно:
| В
| +
| Н+
| ↔
| ВН+
| | основание
|
|
|
| сопряженная кислота
| |
Кислота и основание в кислотно-основной паре взаимосвязаны друг с другом. Чем сильнее (слабее) кислота, тем слабее (сильнее) сопряженное с ней основание. Например, в водном растворе хлороводородная кислота HCl сильнее, чем уксусная кислота СН3СООН, поэтому ацетат ион СН3СОО– будет более сильным основанием, чем хлорид ион Cl–.
|
|
|
|
| | |
Согласно протолитической теории, кислоты и основания могут быть трех типов: нейтральные, анионные и катионные.
В роли первых выступают нейтральные молекулы, способные отдавать или присоединять ион Н+, например: HCl, H2SO4, HNO3 (кислоты); NH3, CH3–O–CH3 (основания).
Анионные основания и кислоты представляют собой отрицательно заряженные ионы, например: HSO4–, HPO42–, HS–(кислоты); OH–, Cl–, NO3– (основания).
В роли катионных оснований и кислот выступают положительно заряженные ионы, например: NH4+, H3O+ (кислоты); H2N–NH3+, H2N–(CH2)2–NH3+ (основания).
Многие частицы (как молекулы, так и ионы) обладают амфотерными свойствами, т.е. в зависимости от условий могут выступать как в роли кислоты, так и в роли основания, например: H2O, NH3, HSO4–, H2N–NH3+ и т.д. Данные соединения называются амфипротными или амфолитами.
Теория Бренстеда-Лоури хоть и является более совершенной, чем теория Аррениуса, однако тоже имеет определенные недостатки, и не является всеобъемлющей. Так, она не применима ко многим веществам, проявляющим функцию кислоты, но не содержащим в своем составе ионов Н+, например: BCl3, AlCl3, BF3, FeCl3 и др

|
Водородный показатель pH
Вода как слабый электролит в малой степени подвергается ионизации:
H2O ↔ H+ + OH-.
Ионы в водном растворе подвергаются гидратации (aq.)
Для воды характерна протолитическая амфотерность. Реакция самоионизации (автопротолиза) воды, в ходе которой протон от одной молекулы воды (кислоты) переходит к другой молекуле воды (основанию) описывается уравнением:
H2O + H2O ↔ H3O+ + OH-.
Константа равновесия автопротолиза воды равна: 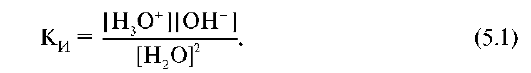
К константе ионизации применим закон действующих масс: 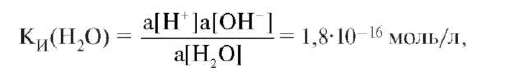
где a - активность.
Для краткости вместо H3O+ в кислотно-основном равновесии пишут
H+.
Так как вода находится в растворе в большом избытке и в малой степени подвергается ионизации, то можно отметить, что ее концентрация величина постоянная и равна 55,6 моль (1000 г: 18 г/моль = 56 моль) в литре воды.
Следовательно, произведение Ки(Н2O) и концентрации воды равны 1,8•10-16 моль/л • 55,6 моль/л = 10-14 моль2/л2. Таким образом, [H+][OH-] = 10-14 (при 25 °С) является постоянной величиной, обозначается Kw и называется константой автопротолиза воды. Иногда используют устаревшее название - ионное произведение воды.
Растворы, в которых концентрация ионов водорода и гидроксид-ионов одинакова - называют нейтральными растворами [H+] = [OH-] = = 10-7 моль/л. В кислых растворах [H+] > [OH-], [H+] > 10-7моль/л, а в щелочных [OH-] > [H+], [OH-] > 10-7 моль/л.
Для упрощения за основу принимают водородный показатель pH - десятичный логарифм концентрации водородных ионов, взятый с обратным знаком: pH = -lg[H+].
Интересные фактики:
Нарушение состояния изогидрии( постоянство рН) наблюдается при сердечнососудистых заболеваниях, при ишемии, сахарном диабете (развивается ацидоз). Кислотно-основное равновесие поддерживается дыханием, мочевыделением, потоотделением. Данные системы работают медленно, а немедленная нейтрализация кислых и щелочных продуктов метаболизма осуществляется буферными системами организма. Состояние изогидрии обеспечивается совместным действием ряда физико-химических и физиологических механизмов. Буферное действие обеспечивается путем совмещения нескольких протолитических равновесий.
Сила кислот определяется их способностью отдавать протон. Мерой этой способности служит константа кислотности (Ka).

Чем больше константа кислотности, тем сильнее кислота. Например, уксусная кислота сильнее, чем циановодородная кислота, так как Ka(CH3COOH) = 1,74•10-5, Ka(HCN) = 1•10-9. Для удобства расчетов и записи часто пользуются не самими константами, а их отрицательными десятичными логарифмами: pKa = -lgKa. Величину pKa называют силовым показателем кислоты. Чем больше величина pKa, тем слабее кислота.
Сильные кислоты практически полностью отдают свой протон молекулам воды, поэтому кислотой, присутствующей в растворе, является фактически ион гидроксония.
В связи с этим при расчете pH раствора сильной одноосновной кислоты концентрацию протонов приравнивают к концентрации кислоты
c (H3O+) = c (HB).
В растворах слабых кислот концентрация ионов гидроксония значительно ниже концентрации кислоты. Она рассчитывается на основании


обеих частей этого уравнения дает формулу для расчета pH растворов слабых кислот: pH = 0,5(pKa - lg c (HB)).