Улучшение состава
Гидролиз нередко катализируется ионами водорода (в кислотном катализе) или гидроксил-ионами (в основном катализе), а также другими кислотными или основными соединениями, которые в большинстве случаев встречаются в составе буферных систем. Последний тип известен как общий кислотно-основный катализ. Оба вида катализа будут рассмотрены более подробно в параграфе 4.4.1.
Доступны несколько методов стабилизации раствора препарата, который чувствителен к кислотно-основному гидролизу.
1)Обычный метод заключается в определении предельно устойчивой pH путём кинетических экспериментов в диапазоне значений pH и в разработке продукта в необходимом значении pH (параграф 4.4.1).
2)Изменение диэлектрической постоянной путём добавления неводных растворителей, как спирт, глицерин или пропиленгликоль, во многих случаях могут устранить гидролиз.
3)Как только часть препарата, находящегося в растворе, будет прогидролизована, можно подавить распад с помощью создания менее растворимого препарата.
Устойчивость пенициллина в суспензии прокаинпенициллина была значительно повышена благодаря уменьшению его собственной растворимости с помощью примесей, например, цитратов, декстрозы, сорбитола и глюконата.
4)Прибавление вещества, который создаёт комплекс с препаратом, может повысить устойчивость. Было показано, что добавление кофеина к водному раствору бензокаина, прокаина и тетракаина понижает основный гидролиз этих местных анестетиков данным путём.
5)Во многих случаях растворение препарата ПАВ’ами защищает от гидролиза, что описано в параграфе 4.4.1.
Изменение химического строения препарата
Проверка устойчивости лекарственных средств c помощью изменения химического строения при использовании соответствующих замещающих групп была предложена для препаратов, у которых такие изменения не уменьшают терапевтическую эффективность. Уравнение Гаммета линейной зависимости свободных энергий применимо для определения влияния заместительных групп на скорость реакции в боковой ароматической цепи, как гидролиз сложных эфиров,
log k = log k0 + σρ
где k и k0 – это постоянная скорость для замещенной и незамещенной групп, соответственно, σ – постоянная заместителя Гаммета (которая определяется в соответствии с природой заместителя и независимостью реакции), и ρ – постоянная реакции, которая зависит от реакции, условий реакции и природы боковой цепи, по которой проходит данная реакция. Соответственно, зависимость logk к постоянной Гаммета линейная, если к их отношению можно провести касательную ρ. Данное представление использовали, например в создании лучших заместительных групп для аллилбарбитуровой кислоты для достижения необходимой устойчивости.
Окисление
Окисление и гидратация могут протекать одновременно. Окисление, как правило, исключается за счёт сохранения в анаэробных условиях без возможности исследования механизма.
Окислительные процессы
Окисление включает в себя удаление положительно заряженного атома, радикала или электрона, или присоединение отрицательно заряженного атома или радикала. Распад, вызванный окислением, может возникнуть в результате самоокисления, когда реакция не катализируется и протекает достаточно медленно под действием молекулярного кислорода, или может быть цепным процессом, состоящим из трёх последовательных реакций – инициации, роста цепи и терминации. В первой стадии под действием УФ-излучения, высокой температуры или переходных металлов, например, меди или железа, которые в следовых количествах присутствуют почти во всех буферах, из органических соединений образуются свободные радикалы. Стадия роста цепи заключается во взаимодействии молекулярного кислорода со свободным радикалом R˙ с последующим образованием пероксильного радикала ROO˙, который после отщепляет Н от молекулы органического соединения и формирует гидропироксид ROOH, и таким образом создает новый свободный радикал 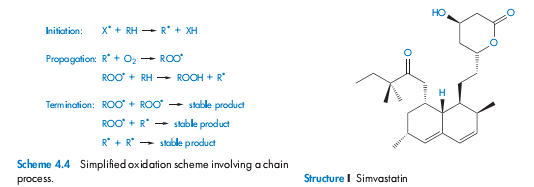
Реакция протекает, пока не разрушатся все свободные радикалы под действием ингибиторов или побочных реакций, которые в конечном счёте разрывают цепь. Характерный прогорклый запах окисленных жиров и масел обусловлен альдегидами, кетонами и короткоцепочечными жирными кислотами, являющимися продуктами разложения гидропероксидов. Пероксиды (ROOR❜) и гидропероксиды (ROOH) фотолабильны, распадаются на гидроксил (HO˙) и/ или алкоксил (RO˙), которые представляют собой высоко окисляющие молекулы. Наличие остаточного перкосида в полиоксиэтиленгликолях является причиной беспокойства, когда эти вспомогательные вещества добавляют в состав, как например, в случае фенпросталена.









