План:
1. Теория строения органических соединений А.М. Бутлерова.
2. Основные положения теории химического строения.
3. Изомерия и изомеры.
4. Химические формулы и модели молекул в органической химии.
1. Теория строения органических соединений А.М. Бутлерова.
Предпосылки теории строения
Подобно тому как в неорганической химии при изучении элементов и их соединений необходимо постоянно руководствоваться периодическим законом и Периодической системой химических элементов Д.И. Менделеева, в органической химии при изучении веществ необходимо опираться на теорию химического строения.
Основой создания теории химического строения органических соединений А.М. Бутлеровым послужило атомно-молекулярное учение (работы А.Авагадро и С.Канниццаро). Будет неправильным предполагать, что до ее создания в мире ничего не было известно об органических веществах и не предпринимались попытки обоснования строения органических соединений. К 1861 году (год создания А.М. Бутлеровым теории химического строения органических соединений) число известных органических соединений достигало сотен тысяч, а выделение органической химии как самостоятельной науки произошло еще в 1807 году (Й. Берцелиус).
Широкое изучение органических соединений началось в XVIII веке с работ А.Лавуазье, который показал, что вещества, получаемые из живых организмов, состоят из нескольких элементов – углерода, водорода, кислорода, азота, серы и фосфора. Огромное значение имело введение терминов «радикал» и «изомерия», а также формирование теории радикалов (Л. Гитон де Морво, А. Лавуазье, Ю. Либих, Ж. Дюма, Й. Берцелиус), успехи в синтезе органических соединений (мочевина, анилин, уксусная кислота, жиры, сахароподобные вещества и др.).
Термин «химическое строение», а также основы классической теории химического строения были впервые обнародованы А.М. Бутлеровым 19 сентября 1861 года в его докладе на Съезде немецких естествоиспытателей и врачей в Шпейере.
2. Основные положения теории химического строения.
Между строением и свойствами органических соединений существует взаимосвязь. Эту взаимосвязь объясняет теория химического строения А.М.Бутлерова. (1861г.)
1. Атомы, образующие молекулу органического вещества связаны между собой в определенном порядке, причем на связь с друг другом затрачивается по одной или несколько валентностей от каждого атома. Свободных валентностей нет.
 Последовательность соединения атомов Бутлеров назвал «химическим строением». Графически связи между атомами обозначаются чертой или точкой (рис. 1).
Последовательность соединения атомов Бутлеров назвал «химическим строением». Графически связи между атомами обозначаются чертой или точкой (рис. 1).
Рис. 1. Химическое строение молекулы метана: А – структурная формула, Б – электронная формула
2. Свойства органических соединений зависят от химического строения молекул, т.е. свойства органических соединений зависят от порядка соединения атомов в молекуле. Изучив свойства можно изобразить вещество.
Рассмотрим пример: вещество имеют брутто-формулу C2H6O. Известно, что при взаимодействии этого вещества с натрием выделяется водород, а при действии на него кислоты образуется вода.
C2H6O + Na = C2H5ONa + H2 ↑
C2H6O + HCl = C2H5Cl + H2O
Данному веществу может соответствовать две структурные формулы:
CH3-O-CH3 – ацетон (диметилкетон) и CH3-CH2-OH – этиловый спирт (этанол),
исходя из химических свойств, характерных для этого вещества делаем вывод, что это этанол.
Изомеры – это вещества, обладающие одинаковым качественным и количественным составом, но различным химическим строением. Выделяют несколько типов изомерии:
· структурная (линейная, разветвленная, углеродного скелета),
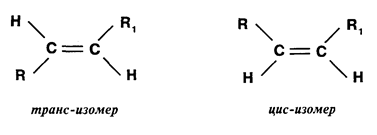
· геометрическая (цис- и транс- изомерия, характерная для соединений с кратной двойной связью (рис. 2)),
· оптическая (зеркальная),
·  стерео (пространственная, характерна для веществ, способных по разному располагаться в пространстве (рис. 3)).
стерео (пространственная, характерна для веществ, способных по разному располагаться в пространстве (рис. 3)).
Рис. 2. Пример геометрической изомерии

Рис.3. Пример стерео изомерии: а – циклогексан, форма «кресла», б – циклогексан, форма «ванна»
3. На химические свойства органических соединений оказывают влияние и другие атомы, присутствующие в молекуле. Такие группы атомов получили название функциональных групп, за счет того, что их наличие в молекуле вещества придает ему особые химические свойства.
Например: -OH (гидроксо-группа), -SH (тио-группа), -CO (карбонильная группа), -COOH (карбоксильная группа). Причем химические свойства органического вещества в меньшей степени зависят от углеводородного скелета, чем от функциональной группы.
Именно функциональные группы обеспечивают многообразие органических соединений, за счет чего их классифицируют (спирты, альдегиды, карбоновые кислоты и т.д.
К числу функциональных групп иногда относят и углерод-углеродные связи (кратные двойные и тройные). Если в молекуле органического вещества несколько одинаковых функциональных групп, то его называют гомополифунцкиональным (CH2 (OH)-CH(OH)-CH2(OH) – глицерин), если несколько, но разных – гетерополифункциональным (NH2-CH(R)-COOH – аминокислоты).
4. Валентность углерода в органических соединениях всегда равна четырем.
3. Изомерия и изомеры.
- Углерод образует цепи различной длины;
- Цепь может быть не только линейной, но и разветвленной.
Давайте рассмотрим первый представитель предельных углеводородов – метан. СН4
Как его не верти - он будет иметь одно и тоже строение. Следовательно, метан не имеет изомеров.
Второй представитель….этан. Исходя из валентности углерода, как бы не поворачивалась молекула в пространстве, нового расположения атомов не получается.
Подобным образом рассматриваем пропан, обращая внимание на то, что изгибая углеродную цепь ничего, принципиально нового, мы не получим. С3Н6
Одинарные связи обеспечивают свободное вращение атомов углерода относительно друг друга. Записываем общую формулу бутана и структурные формулы его изомеров на доске.
Соединения, имеющие одинаковую молекулярную формулу, но различное строение и разные свойства, называются изомерами. ( от греч. Изос – одинаковый, мерос - часть ). Т.о. изомерия – это явление при котором вещества одинакового состава имеют разное пространственное строение, следовательно, и свойства.





 Последовательность соединения атомов Бутлеров назвал «химическим строением». Графически связи между атомами обозначаются чертой или точкой (рис. 1).
Последовательность соединения атомов Бутлеров назвал «химическим строением». Графически связи между атомами обозначаются чертой или точкой (рис. 1). стерео (пространственная, характерна для веществ, способных по разному располагаться в пространстве (рис. 3)).
стерео (пространственная, характерна для веществ, способных по разному располагаться в пространстве (рис. 3)).



