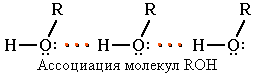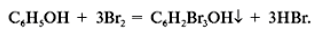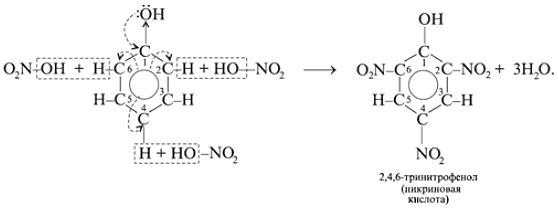-- Фенол - ядовит!!! При попадании на кожу вызывает ожоги, при этом он всасывается через кожу и вызывает отравление.
Раствор с массовой долей фенола 3-5% применяют как антисептик в медицине для дезинфекции помещений, хирургических инструментов.
-- Фенол и его производные ядовитые вещества, опасные для человека, животных и растений. Даже очень малое количество фенола, попавшее в водоем, приводит к изменению вкуса употребляемой в пищу рыбы. На производствах, связанных с получением и переработкой фенола, применяют оборудование, препятствующее проникновению вредных веществ в окружающую среду.
Биологическая роль соединений фенола (кодосхема)
| Положительная
| Отрицательная (токсическое действие)
|
| лекарственные препараты (пурген, парацетамол)
антисептики (3-5 % раствор –карболовая кислота)
эфирные масла (обладают сильными бактерицидными и противовирусными свойствами, стимулируют иммунную систему, повышают артериальное давление: - анетол в укропе, фенхеле, анисе - карвакрол и тимол в чабреце - эвгенол в гвоздике, базилике Флавоноиды (способствуют удалению радиоактивных элементов из организма)
| фенолформальдегидные смолы
пестициды, гербициды, инсектициды
загрязнение вод фенольными отходами
|
4. Физические и химические свойства фенола. Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой.
Физические свойства фенола Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей
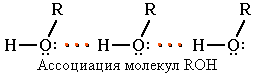
Это объясняет, почему у фенола довольно высокие температуры плавления (+43) и кипения (+182). Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:

Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена.
Химические свойства фенола
а) Рассмотрим реакции фенола по ОН-группе:

Кислотные свойства у фенола выражены сильнее, чем у спирта С2Н5ОН. Фенол – слабая кислота (карболовая).
б) Реакции фенола по бензольному кольцу:
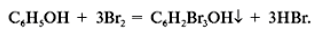
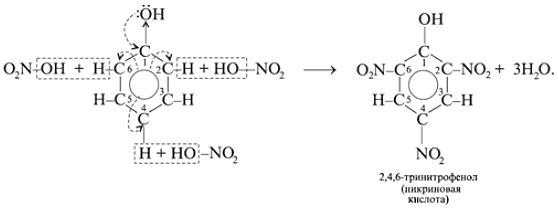
Какой вывод о взаимном влиянии атомов в молекуле фенола можно сделать?
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга. (кодосхема 3)

в) Качественная реакция на фенолы
С6Н5ОН + FeCl3 —> фиолетовое окрашивание С6Н5ОН + Br2 —> белый осадок С6Н4(ОН)2 + FeCl3 —> зеленое окрашивание,
С6Н3(ОН)3 + FeCl3 —> красное окрашивание,
Проводится ученический эксперимент по определению наличия фенолов в чае
5. Применение фенола на основе свойств.
Применение фенола.
Самостоятельная работа с учебником. Страница109.
Вопросы для самоконтроля
¾ Дайте определение спиртам. Что такое функциональная группа?
¾ Как классифицируют спирты по числу функциональных групп, по характеру углеводородного скелета, по характеру углерода, с которым связана гидроксогруппа?
¾ Имеют ли спирты запах, цвет? Какое у них агрегатное состояние?
¾ Почему первые представители спиртов - жидкости, а соответствующие им углеводороды - газы?
¾ Какие виды изомерии характерны для спиртов?
¾ Перечислите типы реакций, которые характерны для одноатомных спиртов.
¾ Как можно получить спирты?
¾ Какие углеводороды называют аренами?
¾ Какие углеводороды называют спиртами?
¾ Запишите молекулярную и структурную формулу бензола.
¾ Запишите молекулярную и структурную формулы спирта.
¾ Повторите химические свойства спиртов и аренов.
¾ Какую реакцию называют нитрованием?
¾ Будут ли отличаться химические свойства у соединений, в одном из которых группа -ОН связана непосредственно с бензольным ядром, а в другом через атом углерода!!!
¾ Ответить на вопросы учебника Г.Е.Рудзитис, Ф.Г.Фельдман. Страница 109 – 110.
¾ Осуществите следующее превращения:
а) СН4 --- С2Н2 ---- С6Н6 --- С6Н5CI ---- C6H5OH --- 2,4,6 трибромфенол
б) СН4 ---- CH3CI ---- C2H6 ---- C2H5CI --- C3H8 --- C3H7CI --- C6H14 ---- C6H6 ---- C6H5CI --- C6H5OH ---- пикриновая кислота
ПЛАН ЗАНЯТИЯ № 12
Дисциплина: Химия.
Тема: Альдегиды. Карбоновые кислоты.
Цель занятия: Ознакомиться с представителями кислородсодержащих органических соединений – альдегидами и карбоновыми кислотами. Изучить их свойства, способы получения, важнейшими представителями и их применением.
Планируемые результаты
Предметные: сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач; владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
Метапредметные: использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени: 2 часа
Вид занятия: Лекция.
План занятия:
1. Понятие об альдегидах. Альдегидная группа как функциональная.
2. Формальдегид и его свойства: окисление в соответствующую кислоту,восстановление в соответствующий спирт.
3. Получение альдегидов окислением соответствующих спиртов. Применение формальдегида на основе его свойств.
4. Понятие о карбоновых кислотах. Карбоксильная группа как функциональная.
5. Гомологический ряд предельных однооснóвных карбоновых кислот.
6. Получение карбоновых кислот окислением альдегидов. Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации. Применение уксусной кислоты на основе свойств. Высшие жирные кислоты на примере пальмитиновой и стеариновой.
Оснащение: Учебник.
Литература:
1. Химия 10 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.