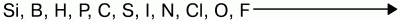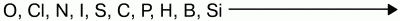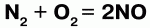План:
1. Окислительные и восстановительные свойства неметаллов в зависимости от их положения в ряду электроотрицательности.
1. Окислительные и восстановительные свойства неметаллов в зависимости от их положения в ряду электроотрицательности.
Исходя из положения неметаллов в периодической системе Менделеева, можно выявить свойства для них характерные. Можно определить количество электронов на внешнем энергетическом подуровне, местоположение неметаллов в конце малых и больших периодов, число электронов на внешнем подуровне соответствует номеру группы. В периоде идет возрастание способности присоединять электроны, а в группе это свойство можно наблюдать по мере уменьшения радиуса (в периоде снизу вверх).
Для неметаллов характерно свойство присоединять электроны, проявлять окислительные свойства. Наиболее они выражены у элементов VI и VII групп. Самый сильный окислитель – фтор.
Окислительные свойства неметаллов возрастают в последовательности:
Фтор никогда не проявляет восстановительных свойств. Другие неметаллы и вещества, им соответствующие, могут проявлять восстановительные свойства, но они слабее, чем у металлов.
Восстановительная способность неметаллов увеличивается от кислорода к кремнию в ряду:
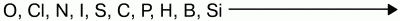
Так, хлор напрямую не взаимодействует с кислородом, но можно получить оксиды хлора (Cl2O, ClO2, Cl2O7), в которых хлор проявляет положительную степень окисления. Азот при высоких температурах вступает в реакцию с кислородом, выказывая восстановительные свойства:
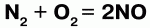
Сера проявляет как окислительные, так и восстановительные свойства:
S + O2 = SO2 – окислительные свойства серы;
S + H2 = H2S – восстановительные свойства серы.
Примеры окислительно-восстановительных реакций:
· восстановительные свойства – образование оксидов и фторидов неметаллов;
· окислительные свойства неметаллов – образование галогенидов, сульфидов, карбидов, нитридов, фосфидов.
| К о м а н д а А
| К о м а н д а B
|
| Na + S =
Fe + Cl2 =
H2 + N2 =
H2 + Cl2 =
H2 + О2 =
СH4 + O2 =
| Mg + F2 =
S + O2 =
C + O2 =
S + F2 =
P + Cl2 =
H2 + CuO =
|
Вопросы для самоконтроля
¾ Назовите тип кристаллической решетки, который характерен для металлов. Его особенности.
¾ Назовите типы кристаллических решеток, характерные для неметаллов.
¾ Назовите тип химической связи в металлах. Его особенности.
¾ Назовите тип химической связи в неметаллах.
¾ Определить свойства, характерные неметаллам (ставят знак +) и металлам (ставят знак -):
1. Твердые
2. Встречаются и в твердом, и в жидком, и в газообразном видах
3. Не имеют металлического блеска
4. Электро- и теплопроводны
5. Большинство не проводят электрический ток
6. Ковкие, пластичные, тягучие
7. В твердом состоянии – хрупкие
8. Имеют металлический блеск
¾ Вставьте слова, пропущенные в тексте.
Атомы ____ в отличие от атомов ____ легко принимают наружные электроны, являются ____
¾ Вставьте слова, пропущенные в тексте.
Неметаллические свойства элементов с увеличением порядкового номера в периодах ____
В группах неметаллические свойства элементов ____
¾ Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?
¾ Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
¾ Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
¾ Какую высшую степень окисления имеют следующие элементы?
| Азот
| +6
|
| Хлор
| +5
|
| Сера
| +4
|
| Кремний
| +7
|
¾ Определите, окислителем или восстановителем является сера в следующих реакциях:
1 H2+S=H2S
2 2SO2 + O2 → 2SO3
¾ Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно____.
• 4 • 5 • 6 • 7
¾ Наиболее электроотрицательными являются атомы…..
• серы • фосфора • кремния • хлора
¾ Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
a) 2, 1
b) 2, 8, 2
c) 2, 8, 7
ПЛАН ЗАНЯТИЯ № 1
Дисциплина: Химия.
Тема: Предмет органической химии. Сравнение органических веществ с неорганическими.
Цель занятия: Выяснить сущность предмета органической химии, охарактеризовать природные, искусственные и синтетические органические вещества. Сравнить органические вещества с неорганическими. Повторить что такое валентность, химическое строение как порядок соединения атомов в молекулы по валентности.
Планируемые результаты
Предметные: Понимать роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества, уметь характеризовать основные классы неорганических и органических соединений, владетьпредставлениями о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач.
Метапредметные: использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
Личностные: чувство гордости и уважения к истории и достижениям отечественной химической науки;
Норма времени: 2 часа
Вид занятия: Лекция.
План занятия:
1. Предмет органической химии.
2. Природные, искусственные и синтетические органические вещества.
3. Сравнение органических веществ с неорганическими.
4. Валентность.
5. Химическое строение как порядок соединения атомов в молекулы по валентности.
Оснащение: Учебник, модели молекул органических соединений.
Литература:
1. Химия 10 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.