Эффективность консервантов может усиливаться или ослабляться при:
•Взаимодействии с действующим веществом или другими компонентами лекарственного средства
•Взаимодействии с материалами первичной упаковки.
Определение эффективности антимикробных консервантов
•приготовление посевного материала тест-культур микроорганизмов
•искусственное заражение лекарственного средства суспензиями определенных тест-микроорганизмов
•инкубация контаминированных образцов при определенной температуре
•отбор проб через определенные интервалы времени и подсчет жизнеспособных клеток в 1 г (мл) лекарственного средства
•интерпретация результатов.
1. Тест-микроорганизмы: виды бактерий и грибов (фармакопейные), которые наиболее часто контаминируют лекарственные средства:
- Escherichia coli
- Pseudomonas aeruginosa
- Staphylococcus aureus
- Candida albicans
- Aspergillus brasiliensis
•Приготовление посевного материала культур микроорганизмов:
- Каждый тест-микроорганизм предварительно выращивают на подходящей агаризованной среде (скошенный агар). Делают смыв суспендирующей жидкостью (физраствор), переносят в другой сосуд и доводят концентрацию КОЕ до 10 8 /мл.
- Делают высев из каждой суспензии на агаризованную среду в чашках Петри для точного определения концентрации КОЕ/мл.
2. Каждый из контейнеров с испытуемым лекарственным средством инокулируют суспензией одного тест-микроорганизма до концентрации 10 5 – 10 6 КОЕ в 1 мл или 1 г ЛС.
Объем суспензии не должен составлять более 1% от объема образца. Образцы тщательно перемешивают и делают высев на агаризованную среду в чашках Петри для точного определения начальной концентрации КОЕ/мл.
3. Инокулированные образцы выдерживают при темепературе 20 - 25°С в защищенном от света месте.
4. Из каждого образца отбирают аликвоты (1 мл или 1 г) через определенные промежутки времени в зависимости от типа лекарственного средства и определяют число жизнеспособных микроорганизмов методом посева на чашки Петри.
5. Анализируют полученные результаты и делают вывод об эффективности антимикробного консерванта.
Критерий оценки антимикробной активности консервантов: уменьшение lg числа жизнеспособных микроорганизмов по сравнению с начальной концентрацией (на момент заражения – п.2).
ЛС для парентерального, офтальмологического применения
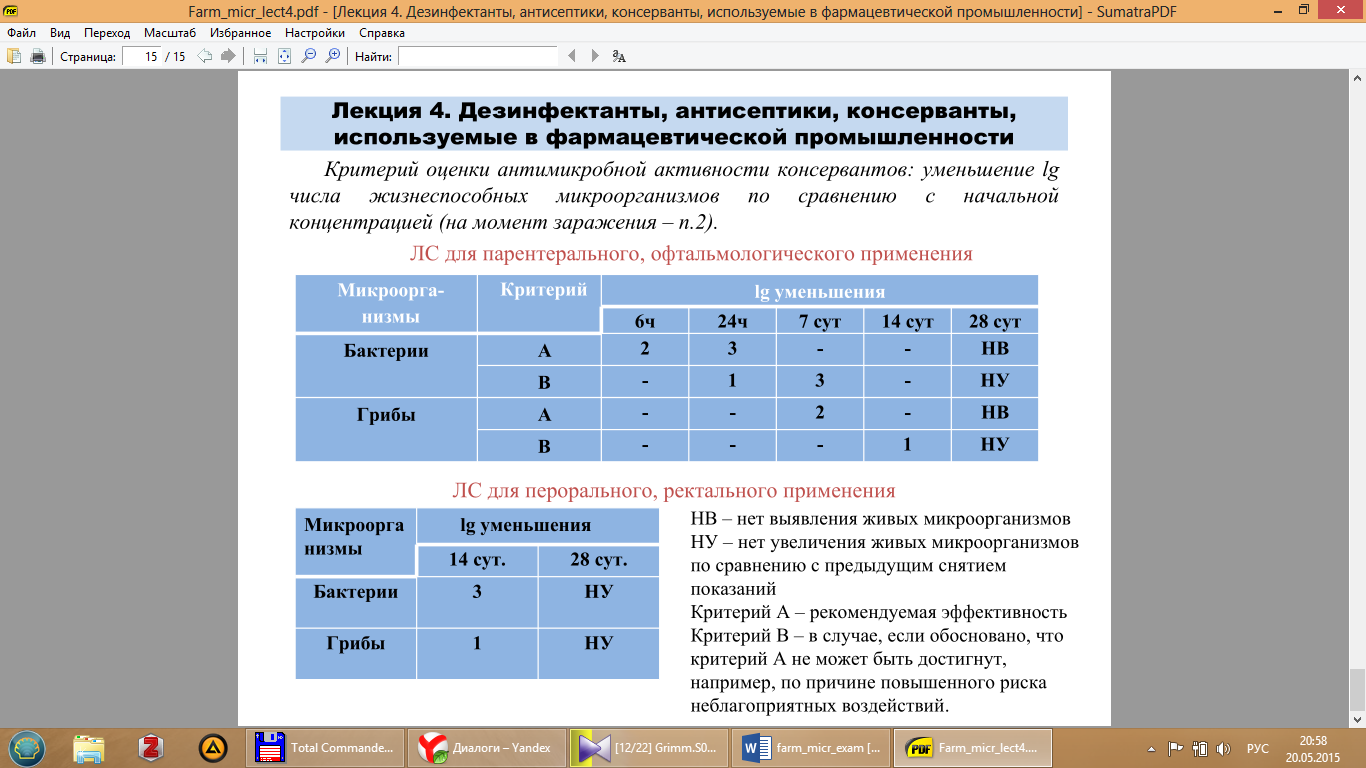
ЛС для перорального, ректального применения
 НВ – нет выявления живых микроорганизмов
НВ – нет выявления живых микроорганизмов
НУ – нет увеличения живых микроорганизмов по сравнению с предыдущим снятием показаний
Критерий А – рекомендуемая эффективность
Критерий В – в случае, если обосновано, что критерий А не может быть достигнут, например, по причине повышенного риска неблагоприятных воздействий.
Обеспечение качества. Система обеспечения качества в фармацевтическом производстве. Надлежащая производственная практика (GMP): основные положения. Нормативно-правовая база Республики Беларусь, устанавливающая принципы и правила GMP.
Производитель лекарственных средств должен организовать их производство так, чтобы:
• обеспечить их соответствие назначению, регистрационному досье;
• исключить риск для пациентов, связанный с недостаточной безопасностью, эффективностью,
качеством.
Для выполнения таких требований на предприятии должна быть организована фармацевтическая система обеспечения качества.
Обеспечение качества – это совокупность организационных мероприятий, предпринимаемых в целях гарантии соответствия качества ЛС их назначению.
Система обеспечения качества в производстве ЛС предполагает:
1. Четкое определение обязанностей руководства;
2. Создание ЛС путем планирования, разработки, исследования и внедрения с учетом требований правил надлежащей производственной и надлежащей лабораторной практики;
3. Составление четкой документации на все производственные и контрольные операции;
4. Производство, поставку и использование надлежащего сырья и упаковочных материалов, выбор и мониторинг поставщиков;
5. Изготовление, проверку и хранение готовой продукции в надлежащих условиях, исключающих риск получения некачественной продукции;
6. Качество продукции на протяжении всего срока годности при хранении, реализации и последующем обращении;
7. Выпуск ЛС в обращение только после того, как Уполномоченное лицо удостоверит, что каждая серия продукции была произведена и проконтролирована в соответствии с требованиями регистрационного досье и другими требованиями в отношении производства;
8. Проведение самоинспекции и/или аудита (контроля сторонней организации) качества, которые повышают эффективность системы обеспечения качества.
Фармацевтическое предприятие должно разработать руководство по качеству, содержащее описание системы управления качеством, включая обязательства ключевого персонала.

Качество, безопасность и эффективность ЛС должны быть подтверждены на всех этапах его разработки, испытания, производства и реализации.
Надлежащая производственная практика (GMP) – часть системы обеспечения качества, которая направлена на обеспечение высокого уровня качества, безопасности и эффективности ЛС и гарантирование того, что ЛС изготовлено в соответствии со своей формулой (составом), не содержит посторонних включений, маркировано надлежащим образом, упаковано и сохраняет свои свойства в течение всего срока годности.
Надлежащая производственная практика устанавливает требования к системе управления качеством, контролю качества, персоналу, помещениям и оборудованию, документации, производству продукции и проведению испытаний, порядку отзыва продукции и организации самоинспекций. Основной документ в РБ, который устанавливает принципы и правила GMP в сфере производства лекарственных средств, включая фармацевтические субстанции, - Технический кодекс установившейся практики (ТКП) 030-2013 (02040) – «Надлежащая производственная практика». Настоящий ТКП соответствует
Руководству по GMP Евросоюза (ЕС) с изменениями, обусловленными действующим законодательством РБ.
Принципы и правила производства и контроля качества ЛС в надлежащих условиях предусмотрены также
• Законом Республики Беларусь от 20 июля 2006 г. N 161-З "О ЛЕКАРСТВЕННЫХ СРЕДСТВАХ" (в ред. Законов Республики Беларусь от 17.11.2014г. №203-З),
• Государственной фармакопеей Республики Беларусь.
Основные положения GMP:
• Все производственные процессы должны быть четко определены и описаны, систематически проверяться и пересматриваться с учетом накопленного опыта;
• Все инструкции и процедуры должны быть даны в письменной форме ясно и однозначно, относиться к конкретным предметам и обеспечивать возможность выполнения операций;
• Во время процесса производства необходимо вести записи (вручную и/или с использованием записывающих устройств), которые подтверждают выполнение всех стадий процесса в соответствии с установленными процедурами и инструкциями, а также что количество и качество продукции на каждом этапе соответствуют запланированным;
• Любые отклонения должны быть запротоколированы и исследованы, должны быть приняты соответствующие корректирующие и предупреждающие действия;
• Предприятие должно иметь в наличии: обученный персонал, имеющий необходимую квалификацию, подходящие площади и помещения, необходимое оборудование, соответствующие исходные материалы, упаковочные материалы, этикетки, соответствующие условия хранения и транспортирования продукции;
• На каждую производственную серию продукции должны вестись протоколы, позволяющие проследить историю серии;
• При оптовой реализации продукции должен быть сведен к минимуму риск снижения ее качества;
• Должна быть организована система отзыва любой серии реализованной продукции, а также система расследования рекламаций на качество продукции, выявления несоответствий и принятия мер к предотвращению случаев несоответствия.
Неотъемлемая часть обеспечения качества ЛС – валидация.
Валидация – документально оформленные действия, которые в соответствии с принципами надлежащей производственной практики доказывают, что определенная процедура, процесс, деятельность или система приводят к ожидаемым результатам с заранее установленными критериями приемлемости (ТКП 030-2013. «Надлежащая производственная практика») Валидируются как процессы, так и методики испытаний.
Микробиологические требования к организации производства стерильной и нестерильной продукции. Чистые помещения, классы чистоты. Изолирующие технологии. Микробиологический мониторинг: объекты и программа.
Микробиологические требования к надлежащей организации производства фармацевтической продукции
По уровню контаминации фармацевтической продукции микроорганизмами ЛС подразделяют на стерильные и нестерильные.
• Нестерильные препараты производятся в неасептических условиях, приближенных к асептическим. Требуемый уровень чистоты обеспечивается проведением соответствующих мероприятий (определенная организация производственных помещений, выбор и правильная эксплуатация оборудования, микробиологический контроль производства и готовой продукции).
• Стерильная продукция производится в асептических условиях, которые исключают возможность ее загрязнения микроорганизмами, пирогенами, механическими частицами.
Стерильная продукция производится в чистых помещениях (зонах).
Чистое помещение (зона) – специально спроектированное, построенное и используемое помещение (зона) для изготовления ЛС, в котором концентрация частиц (механических, микроорганизмов) в воздушной среде постоянно контролируется и поддерживается в заданных пределах в соответствии с определенным классом чистоты.
Класс чистоты помещения (зоны) устанавливает пределы содержания частиц:
- микробных в производстве нестерильных ЛС
- микробных и механических в производстве стерильной продукции.
Чистые помещения (зоны) при производстве стерильных ЛС подразделяются на 4 класса:
• Класс А: локальная зона для проведения операций, представляющих высокий риск для качества продукции. Например, зона наполнения (розлива) стерильных растворов. Как правило, такие условия обеспечиваются ламинарным потоком воздуха на определенном месте.
Ламинар-бокс — лабораторный прибор для работы с объектами в стерильных условиях. Представляет собой шкаф, оборудованный осветителями, ультрафиолетовыми лампами и системой подачи стерильного воздуха. Стерильный воздух подаётся в бокс ламинарным потоком (равномерное движение воздуха без завихрений). Используется при микробиологических, молекулярно-биологических работах, работах с культурами клеток, тканей и органов.
• Класс В: чистая зона, непосредственно окружающая зону класса А, и предназначенная для асептического приготовления и наполнения.
• Классы С и D: чистые зоны для осуществления менее критичных стадий производства стерильной продукции (приготовление растворов, подлежащих стерилизующей фильтрации, операции с первичной упаковкой).
При выполнении операций в асептических условиях необходим микробиологический мониторинг производственной среды.
Микробиологический мониторинг – один из наиболее важных видов лабораторного контроля процесса асептического производства, предоставляющий информацию о качестве окружающей среды асептического технологического процесса, позволяющий предотвратить выпуск потенциально загрязненного продукта, а также предупредить возможность такого загрязнения в будущем за счет выявления неблагоприятных тенденций.
Микробиологический мониторинг является неотъемлемой частью GMP при производстве лекарств. Пределы микробной контаминации установлены только для эксплуатируемого состояния. «Оснащенное» состояние – условие, когда чистое помещение (зона) полностью подготовлено, оборудование установлено и готово к работе, но персонал отсутствует.
«Эксплуатируемое» состояние – условие, при котором система чистого помещения (зоны) и оборудования функционируют в установленном режиме с определенным количеством работающего персонала.










