- Содержимое контейнера (контейнеров) переносят на мембрану (мембраны) и немедленно фильтруют;
- Если раствор обладает антимикробным действием, мембрану промывают путем пропускания через нее определенного объема выбранного стерильного растворителя. Число циклов промывки должно быть не более 5 из расчета по 100 мл/цикл, даже если было показано, что такая промывка не полностью исключает антимикробное действие;
- Мембрану целиком переносят в питательную среду или в асептических условиях делят ее на две равные части, каждую из которых помещают в тиогликолевую среду и среду на основе гидролизата казеина и соевых бобов (# среду Сабуро);
- Инокулированные питательные среды инкубируют в течение не менее 14 дней при 30 - 35°С (тиогликолевая среда для выявления бактерий) и при 20-25°С (среда на основе гидролизата казеина и соевых бобов (# среда Сабуро) для выявления грибов).
Контроль: рост культур микроорганизмов в питательных средах этих же партий (проверка ростовых свойств) Отрицательный контроль: -положительный результат при проверке стерильности питательных сред этих же партий; - проверка на асептичность посева: через простерилизованную установку мембранной фильтрации пропускают заведомо стерильную жидкость и производят посев в питательные среды.
• Мембранная фильтрация твердых растворимых веществ
- Требуемое количество продукта растворяют в походящем растворителе:
растворителе, прилагаемом к ЛС, изотоническом растворе натрия хлорида, нейтральном растворе 1 г/л мясного или казеинового пептона; -Далее испытания продолжают как и для растворов. Контроль: рост культур микроорганизмов в питательных средах этих же партий (проверка ростовых свойств). Отрицательный контроль: - положительный результат при проверке стерильности питательных сред этих же партий; - отсутствие визуального роста при посеве растворителя в питательные среды (для ЛС в форме стерильных порошков, которые предварительно растворяют в растворителе); - проверка на асептичность посева: через простерилизованную установку мембранной фильтрации пропускают заведомо стерильную жидкость и производят посев в питательные среды. Прибор Стеритест - это прецизионный перистальтический насос специальной конструкции с регулируемой скоростью работы, позволяющий переносить жидкость (образец, промывочный раствор, среду) из исходной емкости в канистру (фильтроэлемент) Стеритест. Расходные канистры Стеритест представляют собой две пластиковые емкости, в дно каждой из которых впаян мембранный фильтр с порами 0.45 мкм, а в верхней части находятся 0.22 мкм гидрофобный вентиляционный фильтр и соединение с эластичной ПВХ трубкой, которая на другом конце соединена с одной или несколькими иглами (общими для обеих трубок).
4. Наблюдение и интерпретация результатов
• На протяжении периода инкубации, а также по его завершении оценивают наличие макроскопических признаков микробного роста в средах
• Если признаков микробного роста не обнаруживается, то продукт признают выдерживающим испытание на стерильность
• При наличии признаков микробного роста продукт не выдерживает испытание на стерильность
• Результаты испытания (нестерильность) могут быть признаны недостоверными лишь при выполнении не менее одного из перечисленных ниже критериев: - данные микробиологического мониторинга зоны проверки стерильности указывают на произошедшие сбои - проверка методики, используемой для проведения испытания, привела к обнаружению недочетов - наличие микробного роста в отрицательном контроле - Если результаты испытания признаны недостоверными, испытание повторяют. При отсутствии признаков микробного роста в ходе повторного испытания продукт признают стерильным. При наличии – продукт нестерилен и бракуется.
• Если внесение испытуемого материала приводит к помутнению питательной среды, образованию осадка или выпадению хлопьев вследствие чего наличие или отсутствие микробного роста не может быть легко определено визуально, следует через 14 суток после начала инкубации перенести соответствующую порцию инокулированной среды в свежую аналогичную среду и инкубировать первоначальные и повторные посевы еще 4 суток 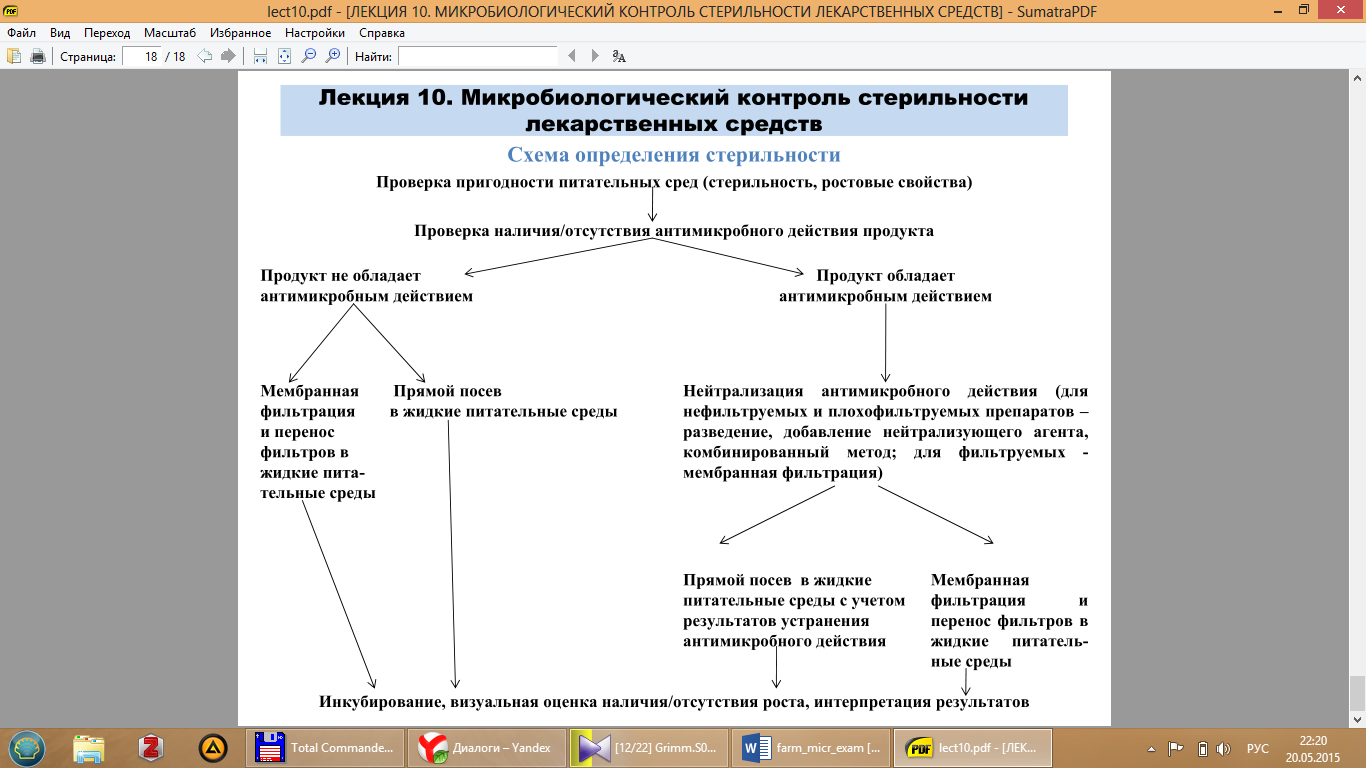
Противомикробные лекарственные средства, классификация. Критерии чувствительности микроорганизмов к противомикробным средствам (МПК и МБК). Группы микроорганизмов в зависимости от степени чувствительности к препаратам антимикробной терапии.
Все антимикробные (противомикробные) лекарственные средства можно разделить на 2 основные группы:
- Химиопрепараты;
- Биологические препараты
I. Химиопрепараты:
• антибиотики - группа природных или полусинтетических органических веществ, подавляющих рост и размножение микроорганизмов или вызывающих их гибель;
•синтетические антибактериальные средства (производные хинолона, имидазола, оксазолидинона и др.) - полностью синтетические препараты, не имеющие природных аналогов и оказывающие сходное с антибиотиками подавляющее влияние на рост бактерий;
•антисептики – синтетические противомикробные средства, предназначенные для подавления жизнедеятельности микроорганизмов в основном при местном применении (поверхность ран, слизистых оболочек);
•противогрибковые препараты (антимикотики) — вещества природного или синтетического происхождения, обладающие фунгицидным или фунгистатическим действием и применяемые для профилактики и лечения микозов;
•противовирусные препараты – средства, вызывающие гибель вирусов или угнетающие их размножение
II. Иммунобиологические препараты: • бактериальные препараты (пробиотики) – живые культуры микроорганизмов, как правило – представители нормальной микробиоты человека, способные выделять вещества с антимикробной активностью;
• бактериофаги – вирусы бактерий, которые используются с лечебной или профилактической целью; • антитела против микроорганизмов и их токсинов (препараты сывороток и иммуноглобулинов);
• препараты цитокинов - интерфероны, интерлейкины и др.
Химиотерапия противомикробными средствами – лечение бактериальных, вирусных и паразитарных заболеваний с помощью химиотерапевтических препаратов, которые избирательно подавляют развитие и размножение соответствующих инфекционных агентов в организме человека.
В клинической практике чаще используется термин антибиотикотерапия
Действие средств антимикробной терапии:
•бактериостатическое действие– прекращение роста и размножения бактерий за счет нарушения биохимических процессов в клетке (тетрациклин, левомицетин, макролиды);
•бактерицидное действие – гибель клетки (пенициллин, стрептомицин, цефалоспорины, аминогликозиды).
В клинической практике существуют два принципа назначения антибактериальных препаратов:
- эмпирическое
- этиотропное.
Эмпирическое назначение антибиотиков основано на знаниях о чувствительности бактерий – причины того или иного заболевания, эпидемиологических данных о резистентности микроорганизмов в регионе или стационаре, а также на симптоматике заболевания.
Преимущество эмпирического назначения химиопрепаратов является возможность быстрого начала терапии. Кроме того, при таком подходе исключаются затраты на проведение дополнительных исследований.
Этиотропное назначение антибиотиков основано на выделении возбудителя инфекции из очага инфекции и определении его чувствительности к антибиотикам.
Требования, предъявляемые к средствам антимикробной терапии:
• широкий спектр действия и способность оказывать антимикробный эффект в дозах, нетоксичных для макроорганизма,
• сохранение антимикробного эффекта в жидкостях и тканях организма, низкий уровень инактивации белками сыворотки крови и тканевыми ферментами;
• хорошее всасывание, распределение и выведение, обеспечивающие высокие терапевтические концентрации в макроорганизме в течение достаточно длительного времени; • отсутствие или медленное развитие резистентности при их применении; • отсутствие или небольшой процент побочных эффектов;
• достаточно длительный период полураспада (прием 1-2 раза в сутки);
• низкая стоимость на курс терапии и высокая эффективность;
• лекарственная форма должна быть удобной для практического использования в разных возрастных группах, при различной локализации процесса и стабильной при хранении.
На практике ни один из препаратов не отвечает всем требованиям.
При фармацевтической разработке генерических противомикробных средств необходимо провести оценку их антимикробной активности в сравнении с оригинальным препаратом в экспериментах in vitro с целью подтверждения соответствия воспроизводимого препарата референсному по спектру и степени антибактериальной активности.
• Оценка антимикробной активности базируется на определении чувствительности микроорганизмов к исследуемым лекарственным средствам.
• Мерой чувствительности микробов является минимальная концентрация препарата (мкг или ед/мл), которая подавляет рост микробов на питательных средах в стандартных условиях постановки опыта.
Количественные показатели, характеризующие микробиологическую активность антибактериальных
препаратов:
- МПК (минимальная подавляющая концентрация) или МИК (минимальная ингибирующая концентрация) – минимальная концентрация, подавляющая in vitro видимый рост исследуемого микроорганизма в жидкой или плотной среде. Соответствует наибольшему разведению (наименьшей концентрации) препарата, тормозящему рост исследуемой культуры в стандартных условиях опыта. Устанавливают посевом испытуемой культуры на плотные или жидкие среды, содержащие различные концентрации антимикробного препарата.
- МПК50 (МИК50) – к данной концентрации антибактериального средства чувствительно 50% исследуемых штаммов;
- МПК90 (МИК90) – к данной концентрации антибиотика чувствительно 90% исследуемых штаммов;
- МБК (минимальная бактерицидная концентрация) - минимальная концентрация антимикробного препарата, вызывающая при исследовании in vitro полную гибель бактерий в стандартных условиях опыта.
Как и МПК, МБК устанавливают посевом испытуемой культуры на плотные или жидкие среды, содержащие различные концентрации антимикробного препарата. В дальнейшем из стерильных зон или прозрачных пробирок делают высев на среды без препарата. Появление роста указывает на статическое действие препарата в данной концентрации, отсутствие – на бактерицидное. Обычно МБК соответствует либо превышает величину МПК.
Концентрация антибиотиков в месте локализации инфекции должна равняться или превышать МПК для данного возбудителя.
По степени чувствительности к антибактериальным препаратам бактерии разделяются на чувствительные, умеренно чувствительные (промежуточные) и устойчивые (резистентные).
Чувствительные - культуры, рост которых подавляется концентрациями препарата, создаваемыми в сыворотке крови больного в процессе назначения среднетерапевтических доз АБП (рекомендуемый режим дозирования).
Умеренно чувствительные (умеренно- устойчивыми) считаются культуры, подавляемые концентрациями, которые могут быть достигнуты при введении максимальных, но находящихся в пределах рекомендуемых доз препарата.
Устойчивые (резистентные) – микроорганизмы, рост которых не подавляется при введении даже максимально допустимых доз препарата. Такие микроорганизмы имеют механизмы резистентности. Бактериостатический эффект может быть достигнут только in vitro при высоких концентрациях лекарственного препарата, являющихся токсичными для человека.
Антимикробная активность одного и того же антибиотика не всегда совпадает при исследовании его в экспериментах in vitro и при лечении больного.
Причины: • активация или инактивация его в результате метаболических реакций макроорганизма,
• неадекватность условий, в которых проявляется действие антибиотика,
• гетерогенность микробных популяций по признаку устойчивости к антибиотикам.
Методы определения чувствительности микроорганизмов к антибиотикам: классификация, общие подходы к проведению. Диффузионные методы: метод бумажных дисков, Е-тест.
Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы:
1. Диффузионные методы:
• с использованием дисков с антибиотиками
• с помощью Е-тестов
2. Методы серийных разведений:
• разведение в жидкой питательной среде (бульоне)
• разведение в агаризованной среде
Методы определения чувствительности были разработаны во второй половине 60-х – начале 70-х годов XX века и с тех пор с методической точки зрения не претерпели принципиальных изменений.
Для всех методов общими являются следующие этапы:
- приготовление и проверка качества питательных сред
- приготовление суспензии исследуемых микроорганизмов (инокулюма)
- инокуляция
- для дифузионных методов – этап наложения дисков или полосок Е-теста на плотную питательную среду.
- инкубирование
- учет и интерпретация результатов
- формулировка рекомендаций по Лечению
Диффузионные методы основаны на диффузии антибактериального препарата (АБП) из носителя в плотную питательную среду, инокулированную микроорганизмом, и регистрации диаметра зоны ингибирования (задержки) роста исследуемого микроорганизма.
• Метод менее чувствителен и менее точен, чем метод серийных разведений, но на практике применяется чаще из-за своей простоты.
• Скорость диффузии в агар любого препарата зависит от его структуры, молекулярной массы, наличия примесей, состава и рН среды.
Метод бумажных дисков с антибиотиком (дискодиффузионный метод).
• Для проведения этого метода используют стандартные диски, содержащие определенное количество антибиотиков, и стандартную питательную среду, необходимую для роста данного вида микроорганизма. В определенных пределах величина диаметра зоны подавления роста обратно пропорциональна МПК. • На поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности. • Помещают диски, содержащие определенное количество антибиотика. • Инкубируют при уcловиях, благоприятных для каждого конкретного микроорганизма. • Измеряют диаметры зон задержки роста вокруг диска в миллиметрах (с учетом диаметра диска). • Оценивают результат по специальной таблице путем сопоставления диаметра зон задержки роста испытанной культуры с пограничными значениями диаметра зоны в таблице. • Исследуемую культуру относят к одной из трех категорий: чувствительная, умеренно- чувствительная и устойчивая 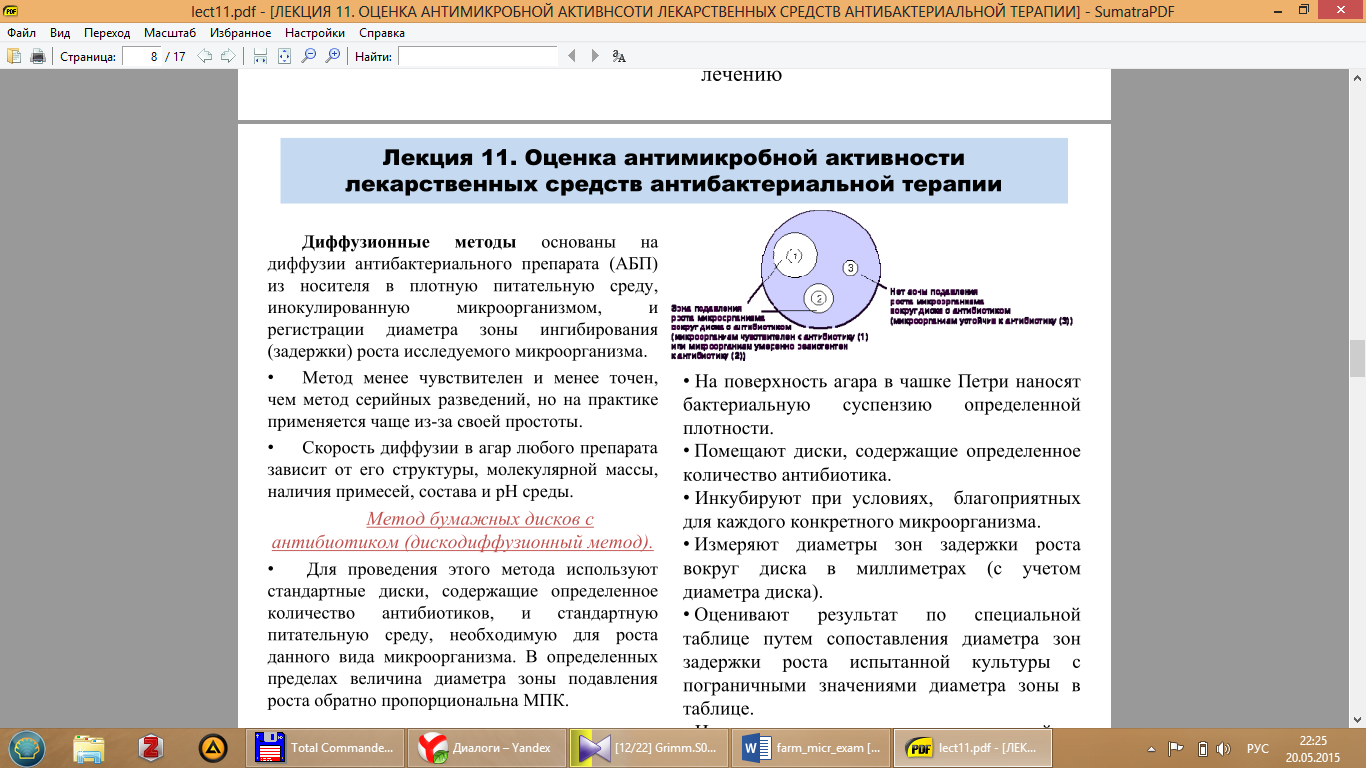
Е-тест (E-test или эпсилометрический метод)
Метод близок по технологии постановки к методу бумажных дисков.
• В качестве носителя используется узкая полоска полимера (0.5х6.0 см), на которую нанесен градиент концентраций АБП (от минимальных до максимальных). Значения концентрации АБП в каждом участке полоски нанесены на наружной (обращенной к исследователю) поверхности.
• Ингибирование роста микроорганизма вокруг полоски носителя происходит в зоне, где концентрация антибиотика, диффундирующего из носителя, выше МПК.
• В месте пересечения эллипсовидной зоны подавления роста с полоской Е- теста получают значение МПК.
Е-тест сочетает простоту постановки метода бумажных дисков и точность метода серийных разведений












