Из наиболее характерных свойств спиртовых гидроксигрупп в моносахаридах следует отметить реакции этерификации, ведущие к образованию сложных эфиров карбоновых и минеральных кислот.
Сложные эфиры.
Подбирая стехиометрические соотношения реагентов, можно получить различные по числу ацильных остатков сложные эфиры. При полном ацетилировании гексоз образуются пентаацетаты. Эта реакция широко используется в химии углеводов для количественного определения числа гидроксигрупп.
В зависимости от условий ацетилирования можно получить преимущественно пентаацетат одного аномера. Например, при ацетилировании D–глюкозы уксусным ангидридом в среде пиридина образуется пентаацетат β-D-глюкопиранозы:

Обозначение связи в циклических формах пунктирной линией указывает на то, что имеется в виду смесь α- и β-аномеров, или же положение полуацетального гидроксила не ясно.
Эфиры моносахаридов, содержащие остатки фосфорной кислоты имеют важное биологическое значение. Обычно в природе распространены фосфаты моносахаридов, содержащих остаток фосфорной кислоты либо у первичного гидроксила, например, глюкозо-6-фосфат, либо у гликозидного гидроксила – α-D-глюкозо-1-фосфат:

Метилирование. Использование в качестве метилирующих агентов йодистого метила или диметилсульфата в среде диметилформамида или диметилсульфоксида позволяет получить сполна метилированный продукт. Провести избирательное метилирование моносахарида не удаётся, поскольку в условиях реакции различия в свойствах гидроксигрупп проявляются очень слабо. Наибольшей активностью отличается полуацетальный гидроксил, который метилируется в первую очередь. Из остальных гидроксигрупп наиболее активны первичноспиртовый и С2–ОН. Обычно при метилировании образуются производные обоих аномеров, что показано на примере глюкозы:

В метилированном продукте в положениях 2,3,4,6 образуется простая эфирная связь, которая, как известно, устойчива к действию разбавленных кислот и оснований. Совсем иное поведение метоксигруппы у аномерного углеродного атома (положение С-1) – при действии разбавленной кислоты эта связь очень легко расщепляется с образованием свободного полуацетального гидроксила:

Химическая связь между аномерным атомом углерода моносахарида и остатком другого компонента называется гликозидной. Соединения, образованные путём замещения полуацетального гидроксила на различные заместители, называются гликозидами.
Следовательно, в пентаметилпроизводном моносахарида связи с участием спиртовых гидроксигрупп у С-2, С-3, С-4 и С-6 являются простыми эфирными, а с участием полуацетального гидроксила – гликозидной.
По этой причине полуацетальный гидроксил принято называть гликозидным гидроксилом.
При действии окислителей легче всего и в первую очередь окисляется аномерный центр с образованием альдоновых кислот (разд. 22.3.1.).
Путём избирательного окисления первичноспиртовой группы можно получить соответствующие уроновые кислоты. В этом случае необходима предварительная защита полуацетального гидроксила переводом моносахарида в гликозид.
Окисление проводят кислородом в присутствии платиновых катализаторов:
 Далее защиту гликозидного гидроксила снимают действием разбавленной минеральной кислоты (HCl или H2SO4). Уроновые кислоты в отличие от альдоновых и аровых (сахарных) кислот являются производными моносахаридов и представляют собой полигидроксиальдегидокислоты, способные существовать в циклических полуацетальных формах:
Далее защиту гликозидного гидроксила снимают действием разбавленной минеральной кислоты (HCl или H2SO4). Уроновые кислоты в отличие от альдоновых и аровых (сахарных) кислот являются производными моносахаридов и представляют собой полигидроксиальдегидокислоты, способные существовать в циклических полуацетальных формах:

Расположенные у двух соседних атомов углерода две гидроксигруппы (виц-диолы) способны взаимодействовать с альдегидами и/или кетонами. Эти реакции реализуются под контролем стереохимических факторов: в реакцию могут вступать только те пары гидроксигрупп, которые отстоят друг от друга до 0,3 нм, или же те, которые могут сближаться, не вызывая искажения конформации молекулы.
Если в качестве карбонильного реагента использовать, например, ацетон, то образуются изопропилиденовые производные.
Когда в реакции участвует цис-1,2-диольная группа, то образуется 1,3-диоксолановый цикл, который по существу представляет собой кеталь:

Действие оснований и кислот
Под действием разбавленных растворов щелочей моносахариды претерпевают эпимеризацию, т.е. изменение конфигурации по положению С-2 и изомеризацию типа альдоза  кетоза.
кетоза.
В щелочной среде концентрация ациклических форм (оксо-форм) моносахаридов повышается. Они легко превращаются в ендиольную форму, которая далее может перейти в карбонильную форму по-разному. Так, например, глюкоза, манноза и фруктоза образуют одинаковый ендиол, который при обратном превращении может перейти в исходную альдозу или ее эпимер, либо в кетозу. Эпимерные альдозы, например, глюкоза и манноза, а также соответствующая им кетоза – фруктоза имеют одинаковые конфигурации С-3, С-4 и С-5:

В более жестких условиях моносахариды под действием щелочей претерпевают глубокие изменения, сопровождающиеся разрывом углерод-углеродных связей. При нагревании в щелочной среде основным продуктом расщепления глюкозы и фруктозы является молочная кислота.
К действию разбавленных минеральных кислот моносахариды устойчивы даже при кратковременном нагревании. В сильнокислой среде и при нагревании протекают процессы внутримолекулярной дегидратации, в результате чего из пентоз образуется фурфурол, а из гексоз 5-гидроксиметилфурфурол:


Образование озазонов
Моносахариды взаимодействуют с избытком фенилгидразина с образованием озазонов. На первой стадии в реакцию вовлекается одна молекула фенилгидразина, что приводит к фенилгидразону. Далее происходит окисление соседней гидроксигруппы до карбонильной – у альдоз по положению С-2, а у кетоз – по С-1. Одновременно расщепляется фенилгидразон до кетоимина, который взаимодействует с двумя молекулами фенилгидразина, что приводит к озазону*:

Сравнивая между собой структуры D-глюкозы, D-маннозы и D-фруктозы, можно убедится в том, что для этих трех моносахаридов будет получен один и тот же озазон, поскольку происходящие превращения затрагивают только положения С-1 и С-2, а конфигурации у атомов C-3, С-4 и С-5 остаются неизменными:

Гликозиды
Среди огромного разнообразия производных моносахаридов особое место занимают те, которые образованы путем замещения полуацетального гидроксила на углеводные или неуглеводные остатки. Такие соединения называются гликозидами.
Простейший из них легко получить взаимодействием моносахарида с метанолом в присутствии сухого хлороводорода. Образуется смесь аномерных гликозидов:

Характерно, что гликозиды не способны к таутомерии в нейтральных водных растворах, не проявляют восстановительных свойств и не мутаротируют, что объясняется отсутствием полуацетального гидрокисла.
Гликозиды, как правило, весьма чувствительны к действию кислот: уже в слабокислой среде они гидролизуются с образованием исходного моносахарида:

Из приведенных выше реакций образования и гидролиза метилгликозида легко понять, что полуацетальный гидроксил, а также OCH3 – группа подвергаются нуклеофильному замещению на анионоидные группы.
Остаток моносахарида, образующийся путем отщепления полуацетального (гликозидного) гидроксила, называется гликозильным остатком. При составлении названия конкретного гликозильного остатка необходимо обозначить тип аномера, название моносахарида и размер цикла: например, β-D-фруктофуранозил-, β-D-галактопиранозил - и т.д.
Неуглеводный компонент в гликозидах называется агликоном.
Гликозиды классифицируют по природе того гетероатома, который непосредственно связан с аномерным атомом углерода гликозидного остатка:

О-гликозидная связь соединяет гликозильный остаток с неуглеводными компонентами, или же остатками других моносахаридов.
Если О-гликозидная связь осуществляется между моносахаридными остатками, то такие соединения относятся к олигосахаридам и полисахаридам.
Примером О-гликозида является один из главных компонентов корневища родиолы розовой – салидрозид (родиолозид). Агликоном салидрозида является n-гидроксифенилэтанол, соединенный с остатком β-D-глюкопиранозы:
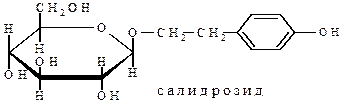
S-Гликозиды или тиогликозиды – это производные циклических форм сахаров, у которых полуацетальный гидроксил замещен на алкилтио- или арилтиогруппу. Примером S-гликозида является гликозид синигрин, содержащийся в семенах сарепской и черной горчицы. Этот гликозид образован агликоном аллилизотиоцианатом, а углеводный компонент представлен остатком β-D-глюкопиранозы:

N-гликозиды. Известные соединения этого ряда представлены преимущественно тремя группами:
гликозиламины – это продукты замещения гликозидного (полуацетального) гидроксила на аминогруппу или замещенную аминогруппу;
гликозиламиды – это N-гликозиды, в которых углерод аномерного центра связан с атомом азота амидного фрагмента;
нуклеозиды – это N-гликозиды, в которых гликозильный остаток связан с гетероатомом азота гетероцикла.

К нуклеозидам относятся N-гликозиды пуриновых и пиримидиновых оснований, которые будут рассматриваться в разделе 25.10.
С-Гликозидами называются соединения, в которых между агликоном и гликозильным остатком сформирована С-С-связь. Остаток агликона, как правило, связан с аномерным углеродным атомом. К сожалению, данное название нельзя считать удачным, но оно стало уже традиционным и ими пользуются все специалисты в области химии природных соединений. Примером С-гликозида является витексин, представляющий собой 8-С-β-D-глюкопиранозид апигенина, содержащийся в разных видах боярышника.
 Итак, гликозиды различаются между собой природой агликона, моносахаридного (углеводного) остатка и природой гетероатома, связывающего агликон с гликозильным фрагментом. Однако, несмотря на столь существенные различия, гликозиды имеют ряд важных общих свойств, которые сводятся к следующему:
Итак, гликозиды различаются между собой природой агликона, моносахаридного (углеводного) остатка и природой гетероатома, связывающего агликон с гликозильным фрагментом. Однако, несмотря на столь существенные различия, гликозиды имеют ряд важных общих свойств, которые сводятся к следующему:
они относительно легко подвергаются кислотному гидролизу (за исключением С-гликозидов), который сопровождается разрывом гликозидной связи и образованием агликона и моносахарида (или моносахаридов);
гликозиды, как правило, не проявляют карбонильной функции и, в этой связи, относительно устойчивы к действию окислителей и восстановителей;
за исключением гликозиламинов в остальных гликозидах гликозильный остаток представлен в циклической форме и характеризуется определенной конфигурацией гликозидного центра и гликозидной связи.
Отдельные представители
Пентозы
Пентозы отвечают общей формуле С5H10O5 и в природе чаще всего встречаются либо в составе гликозидов, либо сложных полисахаридов, известных под названием пентозанов. Отдельные пентозы в значительных количествах в свободном виде содержаться в древесине хвойных деревьев. К числу наиболее часто встречающихся пентоз относятся L-арабиноза, D-ксилоза, D-рибоза и D-дезоксирибоза:

L-Арабиноза – широко распространенная в природе пентоза. Входит в состав камедей – полисахаридов растительного происхождения. Так, абрикосовая камедь содержит до 41% арабинозы.
D-Ксилоза входит в состав ксиланов – пентозанов, являющихся составными компонентами древесины, соломы, мякины, подсолнечной лузги и т.д.
Гидролизом указанных пентозанов – камедей и ксиланов получают соответственно арабинозу и ксилозу.
D-Рибоза и 2-дезокси-D-рибоза – важнейшие из альдопентоз. Они входят в состав нуклеозидов, а также нуклеотидов – структурных единиц РНК и ДНК.
22.5.2. Гексозы *
D-Глюкоза (декстроза, виноградный сахар). Наиболее распространенный моносахарид. В свободном виде встречается практически во всех фруктах, меде. Такие важнейшие полисахариды, как крахмал и гликоген (животный крахмал) построены из остатков α-D-глюкопиранозы, а клетчатка состоит из β-D-глюкопиранозы. D-Глюкоза используется в медицине.
D-Галактоза – пространственный изомер D-глюкозы, отличающийся от последней конфигурацией С-4. Является структурным фрагментом лактозы,раффинозы (трисахарид – галактозилсахароза), многих полисахаридов, сфингогликолипидов.
D-Манноза – пространственный изомер D-глюкозы, отличающийся от последней конфигурацией C-2. В свободном виде содержится в кожуре цитрусовых, а также является структурным фрагментом полисахаридов – маннанов, гидролизом которых получают данный моносахарид.
D-Фруктоза (фруктовый сахар, левулеза). Самый сладкий из всех моносахаридов. Слаще сахарозы в 1,5 раза. В свободном виде содержится в спелых фруктах и меде. Является структурным фрагментом растительного полисахарида – инулина, откуда её и получают.
D-Фруктоза используется в качестве заменителя сахарозы для больных сахарным диабетом.
 L-Сорбоза - моносахарид L-ряда, представляет собой стереоизомер фруктозы. В больших количествах получают из D-сорбита микробиологическим окислением (культура Acetobacter xylinum). Является промежуточным соединением в производстве L-аскорбиновой кислоты.
L-Сорбоза - моносахарид L-ряда, представляет собой стереоизомер фруктозы. В больших количествах получают из D-сорбита микробиологическим окислением (культура Acetobacter xylinum). Является промежуточным соединением в производстве L-аскорбиновой кислоты.
Альдиты
Альдиты (альдитолы, сахарные спирты) - многоатомные спирты, образующиеся при восстановлении моносахаридов.
Например, при восстановлении D-глюкозы образуется D-сорбит (син. D-глюцит), D-маннозы – D-маннит. Восстановлением же фруктозы можно получить как D-глюцит (D-сорбит), так и D-маннит. При восстановлении галактозы образуется D-галактид (дульцит):

Из пентоз аналогичным путем можно получить соответствующие пятиатомные спирты. Например, D-арабит получают восстановлением D-арабинозы, ксилит – ксилозы и т.д.

Альдиты, как правило, имеют слабый сладкий вкус, легко растворимы в воде. Сорбит, маннит и ксилит широко используются в качестве заменителей сахара.
D-сорбит является промежуточным соединением в синтезе аскорбиновой кислоты.
Аминосахара
Аминосахара (дезоксиаминосахара). Если спиртовую гидроксигруппу заместить на атом водорода, то образуется дезоксимоносахарид (сравните рибозу и дезоксирибозу, разд. 22.5.2.). При замещении же ОН-группы на аминогруппу образуются дезоксиаминосахара, (аминогруппа находится вместо недостающей гидроксигруппы).
Аминосахара благодаря аминогруппе относятся к так называемым основным моносахаридам.
Наиболее распространёнными в природе аминосахарами являются 2-амино- и 3-аминосахара:

Глюкозамин является структурной единицей полисахарида хитина – главной составной части оболочек насекомых и панциря ракообразных, а галактозамин – составная часть полисахаридов, входящих в состав хрящей. В настоящее время на основе глюкозамина и галактозамина созданы эффективные лечебные средства.
2,6-диамино-2,6-дезокси-D-глюкопираноза входит в состав антибиотиков-аминогликозидов (неомицин, канамицин, гентамицин и др.).
Уроновые кислоты
Относятся к кислым моносахаридам, поскольку вместо первичной спиртовой группы –СН2ОН содержат карбоксигруппу. В их названиях используется словосочетание уроновая кислота взамен суффикса –оза.
Например, глюкуроновая кислота, галактуроновая кислота:

Уроновые кислоты, как это видно из их структурных формул, способны к образованию соответствующих циклических форм. Широко распространены в природе. Галактуроновая кислота является структурным фрагментом пектинов, а также полисахаридов бактерий. Глюкуроновая кислота вместе с глюкозамином входит в состав мукополисахарида – гиалуроновой кислоты, которая содержится в стекловидном теле глаза, синовиальной жидкости, пуповине и т.д. Регулирует избирательную проницаемость тканей.
Сложные углеводы
В разделе 22.1. была приведена классификация, согласно которой сложные углеводы подразделяют на олиго- и полисахариды.
В олигосахаридах число моносахаридных остатков колеблется от 2-х до 10-20, а в полисахаридах их гораздо больше. Строго говоря, олиго- и полисахариды сформированы по одному и тому же принципу: они состоят из моносахаридных остатков, соединённых между собой гликозидной связью.
Структурные различия между олиго- и полисахаридами заключаются в количестве моносахаридных остатков.
Дисахариды
В образовании гликозидной связи всегда участвует аномерный атом углерода первого моносахаридного остатка и атом кислорода второго остатка, что схематично можно представить следующими примерами:
Схема 22.2. Пути формирования гликозидной связи в дисахаридах.

Сопоставляя между собой строение образованных дисахаридов, можно увидеть одну существенную разницу: в структурах I и II в моносахаридном остатке «В» присутствует свободный полуацетальный гидроксил, а в структуре III гликозидная связь образована при участии обоих полуацетальных гидрокслов.
Структуры I и II, благодаря свободному полуацетальному гидроксилу в моносахаридном остатке «В», способны к таутомерным превращениям, что может привести к оксоформам со свободной альдегидной группой:

В структуре III моносахаридные остатки связаны между собой при участии своих полуацетальных гидроксигрупп, откуда следует, что данный дисахард не способен к таутомерным превращениям. Таким образом, для структуры III исключается возможность перехода одного из моносахаридных остатков в оксо-форму (альдегидную форму).
Наличие свободного полуацетального гидроксила обусловливает восстанавливающие свойства дисахаридов и другие реакции, характерные для моносахаридов: образование гидразонов, озазонов, гликозидов и т.д. Такие дисахариды способны к мутаротации.
В зависимости от того, какие гидроксигруппы принимают участие в образовании гликозидной связи в дисахаридах, их делят на два типа:
- восстанавливающие дисахариды – это дисахариды, в которых гликозидная связь сформирована при участии полуацетального гидроксила одного моносахарида и спиртового гидроксила второго моносахарида. В таком случае у второго моносахаридного остатка имеется свободная полуацетальная гидроксигруппа. К данному типу дисахаридов относятся мальтоза, целлобиоза, лактоза;
- невосстанавливающие дисахариды – это дисахариды, в которых гликозидная связь сформирована при участии полуацетальных гидроксилов обоих моносахаридов (в схеме 22.2. структура III). Примером такого дисахарида является сахароза.
Практически все известные дисахариды получили свои тривиальные названия до того, как было установлено их строение.
Использование систематической номенклатуры позволяет очень легко понять строение дисахарида.
В восстанавливающих дисахаридах тот моносахаридный остаток, который предоставляет для гликозидной связи свой полуацетальный гидроксил рассматривают в качестве заместителя. Понятно, что к его названию добавляют окончание «ил». Например, глюкопиранозил, галактопиранозил и т.д. «гликозил». Второй же моносахаридный остаток рассматривается в качестве основного фрагмента, в котором водород спиртового гидроксила замещён на гликозильный остаток. Например:

В невосстанавливающих дисахаридах первый моносахаридный остаток называют гликозил, а второй – гликозидом.

В этих же названиях указывают конфигурацию моносахаридных остатков, а также последовательность (порядок) их соединения: 1→1; 1→4; 1→6 и т.д.







 Далее защиту гликозидного гидроксила снимают действием разбавленной минеральной кислоты (HCl или H2SO4). Уроновые кислоты в отличие от альдоновых и аровых (сахарных) кислот являются производными моносахаридов и представляют собой полигидроксиальдегидокислоты, способные существовать в циклических полуацетальных формах:
Далее защиту гликозидного гидроксила снимают действием разбавленной минеральной кислоты (HCl или H2SO4). Уроновые кислоты в отличие от альдоновых и аровых (сахарных) кислот являются производными моносахаридов и представляют собой полигидроксиальдегидокислоты, способные существовать в циклических полуацетальных формах:

 кетоза.
кетоза.







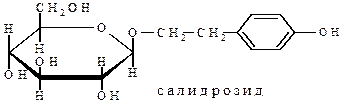


 Итак, гликозиды различаются между собой природой агликона, моносахаридного (углеводного) остатка и природой гетероатома, связывающего агликон с гликозильным фрагментом. Однако, несмотря на столь существенные различия, гликозиды имеют ряд важных общих свойств, которые сводятся к следующему:
Итак, гликозиды различаются между собой природой агликона, моносахаридного (углеводного) остатка и природой гетероатома, связывающего агликон с гликозильным фрагментом. Однако, несмотря на столь существенные различия, гликозиды имеют ряд важных общих свойств, которые сводятся к следующему:
 L-Сорбоза - моносахарид L-ряда, представляет собой стереоизомер фруктозы. В больших количествах получают из D-сорбита микробиологическим окислением (культура Acetobacter xylinum). Является промежуточным соединением в производстве L-аскорбиновой кислоты.
L-Сорбоза - моносахарид L-ряда, представляет собой стереоизомер фруктозы. В больших количествах получают из D-сорбита микробиологическим окислением (культура Acetobacter xylinum). Является промежуточным соединением в производстве L-аскорбиновой кислоты.










