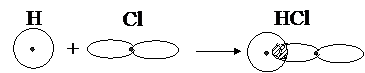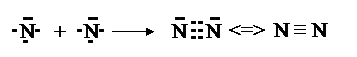Химическая природа элемента, а следовательно, и свойства, определяются способностью терять и приобретать электроны. Все свойства атома определяются силами взаимодействия между положительно заряженным ядром и отрицательно заряженными электронами. При движении по периодам и группам таблицы Д. И. Менделеева (сверху вниз) заряд ядра и суммарный заряд электронов увеличиваются, и силы притяжения между ними возрастают. Однако следует иметь в виду, что если заряд ядра можно условно рассматривать как точечный, то электроны распределяются по энергетическим уровням. С увеличением числа уровней (слоев) электроны удаляются от ядра, и силы притяжения между ядром и электронами ослабляются. Далее надо учесть, что каждый уровень «расщепляется» на подуровни. Среди подуровней появляются d - и f -подуровни, наиболее плотно заполненные электронами. Начинает действовать эффект d - и f -сжатия, конкурирующий с удалением электронов от ядра.
Все свойства атомов закономерно изменяются по периодам и группам.
1) Энергия ионизации ( I) – количество энергии, необходимое для отрыва электронов от невозбужденного атома
Эо + I ® Э+ + ē.
Энергия ионизации определяется в кДж/моль, выраженную в эВ/атом, её часто называют потенциалом ионизации.
Для многоэлектронных атомов существует несколько значений энергии ионизации, соответствующих отрыву 1-го, 2-го, 3-го и так далее электронов. При этом I1<I2<I3, так как с увеличением числа отрываемых электронов растет заряд образующегося положительного иона, который сильнее притягивает к себе электрон.
По периоду энергия ионизации имеет тенденцию возрастания, обусловленную увеличением заряда ядра. Число электронных слоев при этом остается одним и тем же.
По группе сверху вниз энергия ионизации уменьшается вследствие возрастания расстояния от электрона до ядра и усиления эффекта экранирования.
2) Сродство к электрону ( F) – энергетический эффект процесса присоединения электрона к нейтральному атому
Эо + ē ® Э- ± F.
Подобно энергии ионизациисродство к электрону обычно выражают в кДж/моль или в эВ/атом.
Электроны в атоме удерживаются полем ядра. Это поле притягивает и свободные электроны, если они окажутся рядом. Одновременно эти электроны испытывают отталкивание электронов атома. Если энергия притяжения дополнительного электрона превышает энергию его отталкивания от электронных оболочек, то образуется устойчивый отрицательно заряженный однозарядный ион. При присоединении двух и более электронов к атому энергия отталкивания всегда больше энергии притяжения – сродство атома к двум и более электронам всегда отрицательно. Поэтому одноатомные многозарядные отрицательные ионы (O-2, S-2, N-3 и т.п.) в свободном состоянии существовать не могут. Сродство к электрону известно не для всех атомов.
По периоду сродство к электрону увеличивается, так как увеличивается заряд ядра. Максимальным сродством к электрону обладают атомы галогенов.
По группе сродство к электрону несколько уменьшается, так как возрастает число электронных слоев.
3) Электроотрицательность (ЭО) – способность атома к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения: ЭО = f(I,F).
Существует примерно 20 шкал электроотрицательности. Наиболее используемая – шкала Полинга, в которой электроотрицательность 3 Li принята за 1, а 9 F равна 4 (максимальное значение). ЭОLi = 1, ЭОF = 4.
По периоду электроотрицательность увеличивается, а по группе уменьшается.
4) Атомный радиус. Атом не имеет строго определенных границ, вследствие волнового характера движения электрона,
поэтому различают:
орбитальный радиус – теоретически рассчитанное положение главного максимума плотности внешних электронных облаков,
эффективный радиус – половина расстояния между центрами химически связанных атомов.
По периоду атомный радиус уменьшается. В семействах d - и f -элементов происходит более плавное уменьшение атомного радиуса за счет d, f -сжатия, то есть число электронных слоев одинаковое, а увеличение заряда ядра усиливает притяжение электрона к ядру, следовательно, радиус атома уменьшается. Например,
19K)))) 29Cu))))
r = 2,36Å r = 1,28 Å
По группе радиус атома увеличивается, так как возрастает число электронных слоев.
КОНТРОЛЬНЫЕ ВОПРОСЫ
2.1. Раскройте физический смысл главного, орбитального, магнитного, спинового квантовых чисел.
2.2. Чем отличается s -орбиталь от p -, d -, f -орбиталей?
2.3. Составьте сводную энергетическую диаграмму уровней, подуровней и атомных орбиталей атомов элементов от водорода до криптона (Z=1 – 36).
2.4. Как информация о квантовых числах отражается в таблице Д. И. Менделеева?
2.5. Приведите структуру Периодической системы.
2.6. Объясните, чем обусловлено различное количество элементов в 1-, 2-, 3-, 4-м периодах?
2.7. Руководствуясь Периодической системой Д. И. Менделеева, укажите координаты (период, группа, подгруппа) элементов со следующими порядковыми номерами: 8, 13, 30, 48, 67, 89.
2.8. Укажите расположение s -, p -, d -, f -элементов в таблице Д. И. Менделеева, приведите их валентные электроны.
2.9. Для электронов атома с электронной конфигурацией 1 s 22 s 22 p 3 напишите значения всех квантовых чисел.
2.10. Запишите последовательность заполнения электронами подуровней согласно принципу наименьшей энергии.
2.11. Для валентных электронов атома с конфигурацией 1 s 22 s 22 p 63 s 23 p 64 s 23 d 2 напишите значения квантовых чисел.
2.12. Нарисуйте пространственную форму электронных орбиталей валентных электронов атомов 15P и 20Ca.
2.13. Объясните общую закономерность изменения потенциалов ионизации, электроотрицательности, радиуса атомов, восстановительной способности в зависимости от их порядкового номера (по периоду).
2.14. Объясните общую закономерность изменения потенциалов ионизации, электроотрицательности, радиуса атомов, восстановительной способности у элементов одной группы.
ХИМИЧЕСКАЯ СВЯЗЬ
3.1. Ковалентная связь. Механизмы образования и свойства ковалентной связи
Химическая связь обуславливает образование устойчивой системы. В зависимости от характера распределения электронной плотности в веществе различают следующие виды химической связи: 1) ковалентная; 2) ионная; 3) металлическая; 4) водородная; 5) межмолекулярные взаимодействия. [1-9, 17]
Ковалентная связь – химическая связь между атомами, осуществляемая обобществленными электронами.
Способность атома к образованию определенного числа химических связей называют валентностью. Количественной мерой валентности в методе валентных связей считают число неспаренных электронов:
для s - и p - элементов – электроны внешних уровней,
для d - и f - элементов – электроны внешних и предвнешних уровней.
 Спаренные электроны могут разъединяться при наличии свободных орбиталей того же энергетического уровня. Например, у титана 22Ti 4 s 23 d 2, при получении дополнительной энергии (возбуждении) происходит распаривание неподеленной пары электронов внешнего 4 s подуровня, электроны переходят на более высокий 4 р -подуровень:
Спаренные электроны могут разъединяться при наличии свободных орбиталей того же энергетического уровня. Например, у титана 22Ti 4 s 23 d 2, при получении дополнительной энергии (возбуждении) происходит распаривание неподеленной пары электронов внешнего 4 s подуровня, электроны переходят на более высокий 4 р -подуровень:
Рассмотрим механизмы образования ковалентной связи. обменный механизм образования ковалентной связи осуществляется в случае обобществления непарных электронов двух атомов: А· + ·В = А: В.
Образование ковалентной связи по обменному механизму показывают обычнос использованием формулы Льюиса, например образование ковалентной связи в молекуле водорода H2. Молекула H2 состоит из двух атомов, и поскольку каждый атом имеет по одному неспаренному электрону, то возможно образование только одной связи:
H 1s1 ↔ Н• H · + · H = H: H <=> H – H.
Связи в молекуле могут обозначаться парой электронов (формула Льюиса), а также черточкой «–» (структурная формула).
В пространстве образование молекулы H2 происходит за счет перекрывания s- орбиталей, имеющих сферическую форму, рис.3.1.
Рис. 3.1. Перекрывание электронных облаков при образовании молекулы H2
 Изобразим образование ковалентной связи в молекуле HCl. Атомы водорода и хлора имеют один и семь валентных электронов соответственно:
Изобразим образование ковалентной связи в молекуле HCl. Атомы водорода и хлора имеют один и семь валентных электронов соответственно:
Обозначив точками электроны, получаем молекулу HCl:

Поскольку у атома хлора в связи принимает участие лишь один p -электрон, то графически связь HCl представлена на рис.3.2.
Рис. 3.2. Перекрывание электронных облаков при образовании молекулы HCl
Представим образование нескольких связей в одной молекуле. Молекула аммиака NH3 состоит из атома N и трех атомов H:
Атом азота (N 2 s 22 p 3) имеет одну неподеленную пару электронов на 2 s -орбитали и три неспаренных p -электрона. Соответственно, атом азота может образовать три связи. Также три связи создает атом азота с другим атомом азота в случае молеклы N2.
Если между атомами возникла одна ковалентная связь (одна общая электронная пара), то она называется одинарной (Н – Н, Н – Сl, H – N); если две общие электронные пары – двойной ( О = О, О = С = О); три общих электронных пары – тройной ( N ≡ N, -C≡ C-, – C ≡ N).





 Спаренные электроны могут разъединяться при наличии свободных орбиталей того же энергетического уровня. Например, у титана 22Ti 4 s 23 d 2, при получении дополнительной энергии (возбуждении) происходит распаривание неподеленной пары электронов внешнего 4 s подуровня, электроны переходят на более высокий 4 р -подуровень:
Спаренные электроны могут разъединяться при наличии свободных орбиталей того же энергетического уровня. Например, у титана 22Ti 4 s 23 d 2, при получении дополнительной энергии (возбуждении) происходит распаривание неподеленной пары электронов внешнего 4 s подуровня, электроны переходят на более высокий 4 р -подуровень:

 Изобразим образование ковалентной связи в молекуле HCl. Атомы водорода и хлора имеют один и семь валентных электронов соответственно:
Изобразим образование ковалентной связи в молекуле HCl. Атомы водорода и хлора имеют один и семь валентных электронов соответственно: