Процессы, которые в природе происходят сами собой, называются самопроизвольными. Процессы, которые для своего протекания требуют затраты энергии, называются несамопризвольными. Определение условий, при которых процесс протекает самопроизвольно, представляет большой теоретический и практический интерес.
Второй закон термодинамики (постулат Кельвина–Планка): невозможен процесс, единственным результатом которого было бы превращение теплоты в работу.
Постулат Клаузиуса: тепло не может самопроизвольно передаваться от менее нагретого к более нагретому телу.
Суть второго закона сводится к тому, что самопроизвольно протекают процессы, сопровождающиеся убылью энергии.
Математически выражается как 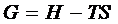 .
.
Значение энергии Гиббса Δ G химической реакции рассматривается как изменение свободной энергии системы – энергии, используемой для совершения полезной работы.
Стандартная энергия Гиббса есть изменение энергии Гиббса Δ G 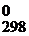 при образовании 1 моля вещества из простых веществ с учетом агрегатного состояния при стандартных условиях.
при образовании 1 моля вещества из простых веществ с учетом агрегатного состояния при стандартных условиях.
Стандартная энергия Гиббса для веществ приведена в таблицах.
Единица измерения: кДж/моль.
Рассчитать изменение стандартной энергии Гиббса можно по закону Гесса:
Δ G 0298, х.р. = (b1Δ G  + b2Δ G
+ b2Δ G  +...) – (a1Δ G
+...) – (a1Δ G  + a2Δ G
+ a2Δ G 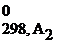 +...),
+...),
либо 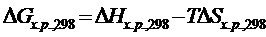 .
.
При расчете Δ G 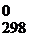 химической реакции, согласно второму закону термодинамики, от полной энергии, связанной с Δ Н реакции, отнимается энергия «беспорядка», т.е. – произведение Т ∙Δ S. В результате получается «энергия порядка», а порядок характеризует работу, которую может совершить система.
химической реакции, согласно второму закону термодинамики, от полной энергии, связанной с Δ Н реакции, отнимается энергия «беспорядка», т.е. – произведение Т ∙Δ S. В результате получается «энергия порядка», а порядок характеризует работу, которую может совершить система.
Энергия Гиббса Δ G –есть мера термодинамической вероятности протекания процесса.
Если свободная энергия системы уменьшается (Δ G х.р.<0), значит, химическая реакция термодинамически вероятна и протекает в прямом направлении.
Реакция не может протекать самопроизвольно, если Δ G х.р.>0, т.е., если свободная энергия возрастает, то на совершение работы требуются затраты энергии извне.
При Δ G х.р.=0 система находится в состоянии термодинамического равновесия.
Подводя итог, можно свести в виде таблицы формулы расчета всех четырех термодинамических функций (табл. 4.2).
КОНТРОЛЬНЫЕ ВОПРОСЫ
4.1. Что изучает химическая термодинамика?
4.2. Приведите определения понятий «система», «состояние», «функция состояния».
4.3. Укажите, какой физический смысл имеют следующие функции состояния: U, H, S, G.
4.4. Сформулируйте первый закон термодинамики и приведите его выражения для различных условий.
4.5. Какие уравнения называют термохимическими? Приведите примеры.
4.6. Что понимается под энтальпией образования вещества?
4.7. Каким образом можно рассчитать тепловой эффект химической реакции, если известны теплоты образования исходных веществ и продуктов реакции?
4.8. Сформулируйте закон Гесса и следствия из него.
4.9. Какие параметры необходимо измерить, чтобы рассчитать тепловой эффект реакции нейтрализации?
4.10. Сформулируйте второй закон термодинамики. Оцените влияние температуры на направление эндотермической реакции.
Таблица 4.2
Физический смысл, единицы измерения и формулы расчета термодинамических функций
| №
| Термодинамическая функция
|
| обозна-чение
| единицы
измерения
| физический
смысл
| формула расчета функции
|
|
| U
|
кДж
|
U = U кин + U пот
| U = Q – A;
Up = Q – P Δ V, P Δ V = Δ n RT
|
|
| H
|
кДж/моль
|
H = U + PV
|
Δ Н 0298, х.р. = (b1Δ H  + b2Δ H + b2Δ H  ) – (a1Δ H ) – (a1Δ H  + a2Δ H + a2Δ H 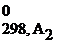 ) )
|
|
| S
|
Дж/моль·К
|
S = K ln W
|
Δ S 0298, х.р. = (b1 S  + b2 S + b2 S  +...) – (a1 S +...) – (a1 S  + a2 S + a2 S 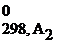 +...) +...)
|
|
| G
|
кДж/моль
|
G = H – TS
| Δ G 0298, х.р. = (b1Δ G  + b2Δ G + b2Δ G  ) – (a1Δ G ) – (a1Δ G  + a2Δ G + a2Δ G 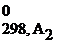 )
Δ G )
Δ G 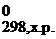 = Δ H = Δ H 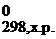 − Т×Δ S − Т×Δ S 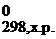
|





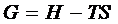 .
.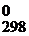 при образовании 1 моля вещества из простых веществ с учетом агрегатного состояния при стандартных условиях.
при образовании 1 моля вещества из простых веществ с учетом агрегатного состояния при стандартных условиях. + b2Δ G
+ b2Δ G  +...) – (a1Δ G
+...) – (a1Δ G  + a2Δ G
+ a2Δ G 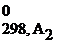 +...),
+...),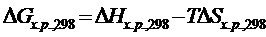 .
.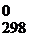 химической реакции, согласно второму закону термодинамики, от полной энергии, связанной с Δ Н реакции, отнимается энергия «беспорядка», т.е. – произведение Т ∙Δ S. В результате получается «энергия порядка», а порядок характеризует работу, которую может совершить система.
химической реакции, согласно второму закону термодинамики, от полной энергии, связанной с Δ Н реакции, отнимается энергия «беспорядка», т.е. – произведение Т ∙Δ S. В результате получается «энергия порядка», а порядок характеризует работу, которую может совершить система.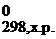 = Δ H
= Δ H 


