Вода является слабым электролитом. Диссоциация воды выражается равновесием: НОН D Н+ + ОН  .
.
Для воды и разбавленных водных растворов произведение равновесных концентраций ионов водорода и гидроксид-ионов является величиной постоянной и при 298 К равно 10-14 моль/л, т.е. [H+]·[OH  ] = 10-14, и называется ионным произведением воды.
] = 10-14, и называется ионным произведением воды.
Постоянство ионного произведения воды означает, что в любом водном растворе – нейтральном, кислом или щелочном всегда присутствуют оба вида ионов Н+ и ОН  , где Н+ – носители кислотных свойств, ОН
, где Н+ – носители кислотных свойств, ОН  – носители основных свойств. Характер среды определяется теми ионами, концентрация которых больше.
– носители основных свойств. Характер среды определяется теми ионами, концентрация которых больше.
[H+] = [ОH-] = 10-7 моль/л – нейтральная среда;
[H+] > [ОH-]; [H+] > 10-7 моль/л – кислая среда;
[H+] < [ОH-]; [H+] < 10-7 моль/л – щелочная среда.
Для характеристики среды удобно пользоваться
водородным показателем – десятичный lg концентрации ионов водорода, взятый с обратным знаком: рН = – lg [H+], или гидроксидным показателем – десятичный lg концентрации гидроксид-ионов, взятый с обратным знаком: рОН = – lg [ОH  ].
].
Тогда ионное произведение воды может быть выражено:
рН + рОН = 14.
Таким образом, кислая среда рН<7; нейтральная среда рН =7; щелочная среда рН >7.
Например, рассчитаем рН 0,001 М раствора КОН.
Гидроксид калия КОН диссоциирует на ионы: КОН D К+ + ОН  .
.
Считаем, что степень диссоциации составляет 100 %, тогда концентрация ионов ОН  равна концентрации раствора щелочи, то есть 10-3 М. Из правила «ионного произведения воды» определяем концентрацию ионов [H+]:
равна концентрации раствора щелочи, то есть 10-3 М. Из правила «ионного произведения воды» определяем концентрацию ионов [H+]:
[H+] = 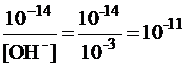 моль/л.
моль/л.
Определяем рН раствора: рН = –lg [H+] = –lg 10-11 = 11. Поскольку рН > 7, среда щелочная.
Гидролиз солей
Гидролизом солей называют реакции обмена между водой и растворенными в ней солями, в результате которого катион или анион соли образует с составными частями молекулы воды новое прочное соединение, а в растворе появляется некоторое избыточное количество ионов Н+ или ОН  , сообщающее раствору кислотные или щелочные свойства.
, сообщающее раствору кислотные или щелочные свойства.
Для оценки рН раствора соли при ее гидролизе можно воспользоваться схемой, в которой учитывается сила кислот и оснований, образующих данную соль. Сильный электролит определяет рН раствора.
Например:
| Zn(NO3)2
| Li2CO3
| (NH4)2S
| RbNO3
|
| Zn(OH)2
| HNO3
| LiOH
| H2CO3
| NH4OH
| H2S
| RbOH
| HNO3
|
| слабый
| сильный
| сильный
| слабый
| слабый
| слабый
| сильный
| сильный
|
| pH < 7
| pH > 7
| pH ≈ 7
| гидролизу не подвергается
|
а) Соль, образованная слабым основанием и сильной кислотой – Zn(NO3)2.
При написании реакции взаимодействия соли с водой, проводим обмен между ионами соли и воды, при необходимости уравниваем стехиометрические коэффициенты и получаем уравнение реакции гидролиза в молекулярном виде:
Zn(NO3)2 + 2H+OH  = Zn(OH)2 + 2 HNO3.
= Zn(OH)2 + 2 HNO3.
Далее записываем уравнение реакции гидролиза в ионно-молекулярном виде. Для этого сначала, пользуясь приведенным выше перечнем электролитов, подчеркиваем слабые электролиты:
Zn(NO3)2 + 2HOH = Zn(OH)2 + 2HNO3.
Молекулы слабых электролитов оставляем без изменения, а остальные молекулы запишем в ионном виде:
Zn2+ + 2(NO3)  + 2HOH = Zn(OH)2 + 2H+ + 2(NO3)
+ 2HOH = Zn(OH)2 + 2H+ + 2(NO3)  .
.
Проводим сокращение и приводим уравнение реакции:
Zn2+ + 2НОН = Zn(OH)2 + 2H+.
Таким образом, между солью и водой происходит взаимодействие, образуется прочное соединение Zn(OH)2 и появляется избыток ионов Н+, что определяет кислую среду, рН которой < 7.
Следует, однако, иметь в виду, что полученное уравнение реакции гидролиза дается в упрощенном виде и не дает полной информации об истинном составе всех получающихся продуктов. Так, при гидролизе солей многозарядных катионов и анионов процесс идет по ступеням и, как правило, заканчивается на I ступени. Например, гидролиз рассматриваемой соли Zn(NO3)2 по первой ступени выражается следующими уравнениями:
в молекулярном виде:
Zn(NO3)2 + HOH = Zn(OH)NO3 + HNO3;
в ионно-молекулярном виде:
Zn2+ + 2(NO3)  + HOH = Zn(OH)+ + 2(NO3)
+ HOH = Zn(OH)+ + 2(NO3)  + H+;
+ H+;
в сокращенном виде:
Zn2+ + HOH = Zn(OH)+ + H+.
В данном случае в процессе гидролиза образуется основная соль Zn(OH)NO3 – нитрат-гидроксид цинка.
б) Соль образована сильным основанием и слабой кислотой – Li2CO3.
В молекулярном виде:
Li2CO3 + 2Н+ОН  = 2LiOH + H2CO3;
= 2LiOH + H2CO3;
в ионно-молекулярном виде:
2Li+ + CO  + 2HOH = 2Li2+ + 2OH
+ 2HOH = 2Li2+ + 2OH  + H2CO3;
+ H2CO3;
в сокращенном виде:
CO  + 2НОН = 2ОН
+ 2НОН = 2ОН  + Н2СО3.
+ Н2СО3.
Так как в результате реакции гидролиза появляется избыток ионов ОН  , то среда щелочная и рН > 7.
, то среда щелочная и рН > 7.
Гидролиз по первой ступени выражается следующими уравнениями:
в молекулярном виде:
Li2CO3 + НОН = LiНСО3 + LiOH;
в ионно-молекулярном виде:
2Li+ + CO  + HOH = 2Li+ + (HCO3)
+ HOH = 2Li+ + (HCO3)  + OH
+ OH  ;
;
в сокращенном виде:
CO  + НОН = (HCO3)
+ НОН = (HCO3)  + OH
+ OH  .
.
В результате гидролиза образуется кислая соль LiHCO3 – гидрокарбонат лития.
в) Соль образована слабым основанием и слабой кислотой – (NH4)2S.
В молекулярном виде:
(NH4)2S + 2Н+ОН  = 2 NH4OH + H2S;
= 2 NH4OH + H2S;
в ионно-молекулярном виде:
2NH4+ + S  + 2HOH = 2 NH4OH + H2S.
+ 2HOH = 2 NH4OH + H2S.
В результате реакции гидролиза образовались прочные соединения NH4OH и H2S, т.е. происходит необратимый гидролиз соли. А так как в правой части отсутствует избыток ионов Н+ или ОН  , то рН раствора не меняется, среда нейтральная (рН ≈ 7). Незначительные отклонения рН от 7 в ту или иную сторону зависят от степени диссоциации NH4OH и H2S.
, то рН раствора не меняется, среда нейтральная (рН ≈ 7). Незначительные отклонения рН от 7 в ту или иную сторону зависят от степени диссоциации NH4OH и H2S.
г) Соль образована сильным основанием и сильной кислотой – RbNO3.
В молекулярном виде:
RbNO3+ Н+ОН  = RbOH + HNO3;
= RbOH + HNO3;
в ионно-молекулярном виде:
Rb+ + NO  + HOH = Rb+ + OH
+ HOH = Rb+ + OH  + H+ + NO
+ H+ + NO  ;
;
в сокращенном виде:
НОН = Н+ + ОН  .
.
Таким образом, по сокращенному виду, отражающему суть реакции, очевидно, что в данном случае процесс связан с диссоциацией молекул воды, а молекулы соли в реакции не участвуют. То есть соль, образованная сильным основанием и сильной кислотой, гидролизу не подвергается. Так как в правой части реакции присутствуют ионы Н+ и ОН  , то среда будет нейтральная и рН = 7.
, то среда будет нейтральная и рН = 7.
Количественно гидролиз можно охарактеризовать:
1) константой гидролиза К г – константа равновесияпроцесса гидролиза;
2) степенью гидролиза β – отношение числа молекул, подвергшихся гидролизу, к общему числу молекул.
Поскольку гидролиз – процесс обратимый, то рано или поздно устанавливается равновесие, и его можно сдвинуть в ту или иную сторону. Для усиления гидролиза необходимо: повысить температуру, (так как гидролиз эндотермический процесс), разбавить раствор, снизить концентрацию продуктов гидролиза. Для подавления гидролиза: снизить температуру; повысить концентрацию продуктов гидролиза.





 .
. 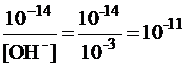 моль/л.
моль/л. + 2HOH = 2Li2+ + 2OH
+ 2HOH = 2Li2+ + 2OH  + 2HOH = 2 NH4OH + H2S.
+ 2HOH = 2 NH4OH + H2S. + HOH = Rb+ + OH
+ HOH = Rb+ + OH 

