Кислородсодержащие кислоты: серная (H2SO4), азотная (HNO3), фосфорная (H3PO4), хлорная (HClO4) и другие.
Если в кислотах атомы неметаллов, их образующие, будут иметь высокие степени окисления, то металлы могут восстанавливать кислоты до различных степеней окисления, сами при этом окисляясь до ионного состояния.
9.4.4. Взаимодействие металлов с серной кислотой. Серная кислота может восстанавливаться или до S2- или, чаще, до S(IV). Степень восстановления серы зависит от активности металла, концентрации кислоты и температуры.
Металл – восстановитель.
Окислители: могут быть ионы водорода либо ионы серы (VI).
А) р а з б а в л е н н а я
Если серная кислота разбавлена, то диполи воды притягиваются к молекуле H2SO4, выделяется энергия гидратации, которая затрачивается на отрыв ионов водорода, в результате ионы водорода получают по сравнению с серой (VI), окруженной отрицательными ионами кислорода, преимущество. Поэтому выделяется водород и образуется сульфат металла.
Мe0 + zН2SO4(разб)= Мe2(SO4)z + Н20 ↑,
Мez+ + z ē = Мe0 j0вос = j0 Mez+/Me,
2Н+ + 2ē = Н20 j0ок = j H+/ H = – 0,059·pH
Вероятность осуществления реакции рассчитывается аналогично варианту взаимодействия металлов с бескислородными кислотами. Водород вытесняют из разбавленной серной кислоты те металлы, электродный потенциал которых меньше потенциала водородного электрода с учетом перенапряжения ( ).
).
Б) к о н ц е н т р и р о в а н н а я
Если серная кислота концентрированная, то число диссоциированных молекул мало и ионы водорода теряют свое преимущество. К тому же потенциалы восстановления S(VI) немного, но все-таки более положительны, чем водорода, поэтому восстанавливается сера. Общая схема взаимодействия выглядит следующим образом:
Me0 + H2SO4(конц) = Me2(SO4)z + H2O + соединение S.
Какое соединение серы образуется при взаимодействии, зависит от активности металла. Сульфат-ион может восстанавливаться до соединений серы, где степень окисления серы понижается («+4» в SO2; «0» в S; «–2» – в H2S). Чем активнее металл, т.е. меньше величина электродного потенциала, тем полнее происходит восстановление сульфат-иона.
Сильноактивные металлы:
SO  + 10H+ + 8 ē = H2S + 4H2O, j
+ 10H+ + 8 ē = H2S + 4H2O, j  = +0,311 B;
= +0,311 B;
Среднеактивные металлы:
HSO  + 7H+ + 6 ē = S + 4H2O, j
+ 7H+ + 6 ē = S + 4H2O, j 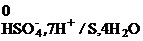 = +0,351 B;
= +0,351 B;
Слабоактивные металлы:
H2SO4 + 2H+ + 2 ē = SO2 + 2H2O, j 0 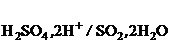 = +0,438 B.
= +0,438 B.
Концентрированная серная кислота с малой концентрацией ионов Н+ может при нагревании окислять металлы, которые в ряду активности не могут вытеснять водород. Металлы, склонные к пассивации (Fe, Cr, Al, Ti), при взаимодействии с концентрированной серной кислотой, покрываются оксидной пленкой (Al2O3, Ti2O3), выделяется немного SO2, и далее не растворяются.
9.4.5. Взаимодействие металлов с азотной кислотой. Азотная кислота является сильнейшим окислителем, как и её соли. Атом азота N 2s22p3 не может иметь степень окисления «+5», так как он не имеет свободных орбиталей на валентном уровне, но s -электроны атома азота могут образовать неустойчивую связь еще с одним атомом кислорода, и в этом состоянии азот проявляет себя как очень сильный окислитель. Продуктами восстановления соединений, соответствующих оксиду N2O5 (азотный ангидрид), могут быть диоксид азота NO2, азотистый ангидрид N2O3, монооксид азота NO, закись азота N2O, азот N2, аммиак NH3.
Отметим при этом, что N2O3 неустойчив и при небольшом нагревании диспропорционирует на NO и NO2. «бурый газ» (NO2) – устойчивое соединение, и NOлегко переходит в него, окисляясь кислородом воздуха. За исключением N2O («веселящего газа»), все оксиды азота ядовиты.
Азотная кислота растворяет практически все металлы, за исключением золота и группы платиновых металлов, так как она является сильным окислителем и все ее соли (нитраты) хорошо растворимы в воде.
Взаимодействие металлов с таким сильным окислителем, как азотная кислота, может приводить к образованию продуктов с разными степенями окисления азота: «+4» в NO2, «+3» в HNO2, «+2» в NO, «0» в N2, «–3» в NH3.
При взаимодействии металлов с азотной кислотой металл – восстановитель, окислителем всегда является нитрат-ион. Поскольку потенциал восстановления N(V) гораздо более положителен, чем водорода, то водород никогда не выделяется при взаимодействии металлов с азотной кислотой.
А) к о н ц е н т р и р о в а н н а я HNO3
Взаимодействие с к о н ц е н т р и р о в а н н о й азотной кислотой протекает по схеме:
Me0 + HNO3(конц) → Me(NO3)z + H2O + NO2↑
Me0 - zē → Mez+ j0вос = j0 Mez+/Me,
(N+5O3)- + 2H+ + ē →N+4O2+ H2O j0ок = +0,78 В.
Термодинамическую возможность реакции оцениваем по формуле Δ G 0 = –z FE 0 = – z F (φ0ок – φ0вос).
В концентрированной HNO3 пассивируются Fe, Cr, Al.
Fe(Cr,Al) + HNO3→Fe2O3 (Cr2O3,Al2O3) + NO2 ↑ + H2O.
конц.
Б) р а з б а в л е н н а я
Если азотная кислота разбавленная, то молекул кислоты в растворе меньше, поэтому каждой молекуле достается разное количество электронов. Степень окисления N(V) меняется значительнее, все зависит от активности металла:
Me0 + HNO3(разб) → Me(NO3)z + H2O + соединения азота.
Me – z ē → Me z + ;
NO  + 4H+ + 3ē → N+2O + 2H2O, φ
+ 4H+ + 3ē → N+2O + 2H2O, φ  = 0,96 В;
= 0,96 В;
NO  + 6H+ + 5ē → ½N2 + 3H2O, φ
+ 6H+ + 5ē → ½N2 + 3H2O, φ  = 1,24 В;
= 1,24 В;
NO  + 9H+ + 8ē → N-3H3 + 3H2O, φ
+ 9H+ + 8ē → N-3H3 + 3H2O, φ  = 0,87 В.
= 0,87 В.
Активные металлы восстанавливают азот до NH3 и его комплексного иона – аммония, слабоактивные – до NO.
Обычно при взаимодействии металлов с азотной кислотой продуктами реакции являются несколько оксидов, но чаще всего они выделяются совместно и преобладание одного из оксидов определяется концентрацией азотной кислоты и температурой процесса.
9.4.6. Взаимодействие металлов со смесями кислот. Многие металлы с положительным электродным потенциалом, образующие устойчивые оксидные пленки, не растворяются в какой-либо отдельной кислоте, а растворяются и травятся в смесях кислот. Такие смеси состоят из кислоты, обладающей ярко выраженными окислительными свойствами (HNO3, H2SO4, H2SeO4, HClO3, HClO4), и кислоты, анион которой образует устойчивые комплексные ионы с катионом металла (HCl, HF и т.д.).
Взаимодействие металла со смесями кислот происходит по реакции
Me + HF + HNO3 → H m-z [Me z +F m ] + NO + H2O.
Металл окисляется, анион окислительной кислоты восстанавливается.
Например, палладий растворяется в смеси кислот по реакции:
3Pd + 4HNO3 + 18 HCl → 3H2[PdCl6] + 4NO + 8H2O.
Аналогично в смесях кислот ведут себя золото, платиновые металлы, ниобий, тантал.
КОНТРОЛЬНЫЕ ВОПРОСЫ
9.1. Какую роль играют металлы в окислительно-восстановительных процессах?
9.2. Какими параметрами можно оценить химическую активность металла как элемента и простого вещества?
9.3. Какими свойствами обладают оксиды металлов в разных степенях окисления?
9.4. Как оценить термодинамическую вероятность взаимодействия металлов с водой, кислотами, диссоциирующими с образованием Н+ и растворами щелочей?
9.5. Какие продукты реакции следует ожидать при взаимодействии различных металлов с азотной кислотой и почему? Как влияет на это концентрация раствора?
9.6. Какие продукты следует ожидать при взаимодействии металлов с разбавленной и концентрированной серной кислотой? Прокомментируйте ответ.
9.7. Какие ионы окисляют металлы при растворении их:
а) в разбавленной и концентрированной серной кислоте;
б) в водных растворах щелочей;
в) в разбавленной и концентрированной азотной кислоте?





 ).
). + 10H+ + 8 ē = H2S + 4H2O, j
+ 10H+ + 8 ē = H2S + 4H2O, j  = +0,311 B;
= +0,311 B; + 7H+ + 6 ē = S + 4H2O, j
+ 7H+ + 6 ē = S + 4H2O, j 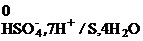 = +0,351 B;
= +0,351 B;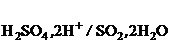 = +0,438 B.
= +0,438 B. + 4H+ + 3ē → N+2O + 2H2O, φ
+ 4H+ + 3ē → N+2O + 2H2O, φ  = 0,96 В;
= 0,96 В; = 1,24 В;
= 1,24 В; = 0,87 В.
= 0,87 В.


