Из двух электродов может быть составлена электрохимическая система – гальванический элемент.
Гальванический элемент – устройство, в котором химическая энергия окислительно-восстановительных процессов преобразуется в электрическую.
Гальванический элемент состоит из двух электродов и ионного проводника между ними. В качестве электродов используются металлы, уголь и другие вещества, обладающие электронной проводимостью (проводники 1-го рода). Отдельный электрод в гальваническом элементе иногда называют полуэлементом. Ионным проводником (проводником 2-го рода) служат растворы или расплавы электролитов. Для обеспечения работы гальванического элемента, электроды соединяют друг с другом металлическим проводником, называемым внешней цепью. В качестве ионного проводника используется «соляный мостик» – изогнутая (U-образная) стеклянная трубка, заполненная насыщенным раствором хлорида калия KCl. Внутреннюю цепь составляет собственно гальванический элемент.
Существуют определенные правила записи электрохимических систем:
· слева располагают электрод, имеющий более отрицательный потенциал (знак «–»), справа – электрод, имеющий более положительный потенциал (знак «+»):
(–) Al │ AlCl3 ║ NiCl2 │Ni (+)
или в ионной форме:
Al │ Al3+ ║ Ni2+ │Ni;
· растворы отделяют вертикальной пунктирной линией, если они контактируют друг с другом:
Pt, H2│HCl ¦ CuCl2│Cu;
двумя вертикальными линиями – если между ними находится соляный мостик:
Zn │ Zn2+ ║ Ag+ │Ag.
Гальванический элемент может быть сделан из двух одинаковых электродов, помещенных в растворы с различными концентрациями солей (активностями катионов). Металлический электрод, помещенный в более разбавленный раствор, выполняет функцию отрицательного, а помещенный в более концентрированный – положительного электрода. Такая разновидность гальванического элементаназывается концентрационным гальваническим элементом. Схема концентрационного гальванического элемента также может быть записана в виде:
(–) Zn | Zn2+ || Zn2+ | Zn (+).
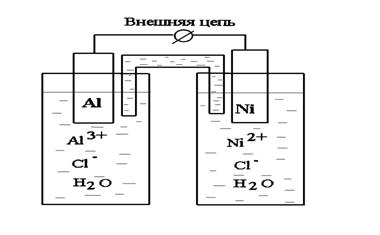
Составим гальванический элемент, состоящий из двух металлов, Al и Ni, погруженных в растворы собственных солей (рис. 8.1).
Рис. 8.1. Схема гальванического элемента
Данный гальванический элемент может быть представлен следующей схемой:
Пользуясь табличными данными, выписываем значения стандартных электродных потенциалов для каждого электрода:

 = –1,66 В;
= –1,66 В; 
 = –0,25 В.
= –0,25 В.
В паре Al – Ni алюминий имеет более отрицательное значение электродного потенциала, поэтому на схеме гальванического элемента записан слева и обозначен знаком «–», никелевый электрод по сравнению с алюминиевым является более положительным (знак «+»), поэтому записан справа. При замыкании внешней цепи электроны начинают переходить от алюминиевого электрода к никелевому, что на схеме указывается в виде стрелки сверху.
Во внутренней цепи протекают следующие реакции на электродах:
на аноде – процесс отдачи электронов, т.е. окисление
(–) А: Al0 – 3 ē → Al3+ (окисление);
на катоде - процесс приема электронов, т.е. востановление
(+) К: Ni2+ + 2 ē → Ni0 (восстановление).
Электроны по внешней цепи движутся от восстановителя к окислителю, с анода на катод (А→К ).
Приведем расчет электродных потенциалов с учетом концентраций растворов, например 0,001 моль/л.
Для этого используем уравнение Нернста для металлического электрода:

 =
= 
 +
+  lg [Me z+ ],
lg [Me z+ ],
где 
 – стандартный электродный потенциал,
– стандартный электродный потенциал,
z – количество электронов, участвующих в элементарном акте окисления или восстановления;
[Me z+ ] – концентрация ионов металла в растворе.

 = -1,66 +
= -1,66 +  lg (0,001) = -1,66 +
lg (0,001) = -1,66 +  (-3) = -1,72 В.
(-3) = -1,72 В.

 = -0,25 +
= -0,25 +  lg (0,001) = -0,25 +
lg (0,001) = -0,25 +  (-3) = -0,34 В.
(-3) = -0,34 В.
Проводим расчет ЭДС (E) гальванического элемента и Δ G  протекающей в нем реакции, помня, что z берется с учетом наименьшего общего кратного коэффициентов электронного баланса:
протекающей в нем реакции, помня, что z берется с учетом наименьшего общего кратного коэффициентов электронного баланса:
E = φок. - φвосст. = -0,34 - (-1,72) = 1,38 В.
Δ G  = -z F E = -6×96500×1,38×10-3 = -799 кДж.
= -z F E = -6×96500×1,38×10-3 = -799 кДж.
Так как значение Δ G  < 0, то процесс в данном гальваническом элементе термодинамически вероятен.
< 0, то процесс в данном гальваническом элементе термодинамически вероятен.







 = –1,66 В;
= –1,66 В;  = –0,25 В.
= –0,25 В. =
=  +
+  lg [Me z+ ],
lg [Me z+ ], = -1,66 +
= -1,66 +  lg (0,001) = -1,66 +
lg (0,001) = -1,66 +  = -0,25 +
= -0,25 +  lg (0,001) = -0,25 +
lg (0,001) = -0,25 +  протекающей в нем реакции, помня, что z берется с учетом наименьшего общего кратного коэффициентов электронного баланса:
протекающей в нем реакции, помня, что z берется с учетом наименьшего общего кратного коэффициентов электронного баланса: = -z F E = -6×96500×1,38×10-3 = -799 кДж.
= -z F E = -6×96500×1,38×10-3 = -799 кДж.

