Металлы – это элементы, атомы которых имеют минимальное количество электронов на внешнем энергетическом уровне. Степень окисления определяется числом неспаренных электронов
в нормальном и возбужденном состояниях. Восстановительную активность атома элемента определяют потенциалом ионизации валентных электронов. Реакции взаимодействия металла с электролитами являются окислительно-восстановительными, где металл выступает в качестве восстановителя, а ион водорода Н+ либо анион кислоты – в виде окислителя. Для суждения о возможности реакции металла с водой, кислотами, щелочами необходимо определение величины D G химической реакции, исходя из уравнения:
D G = – zFE,
где z – число электронов в уравнении окислительно-восстано-вительной реакции; F – число Фарадея; Е – ЭДС процесса, равное разности электродного потенциала окислителя (jокисл) и электродного потенциала восстановителя (jвосст).
При условии, что jокисл > jвосст, реакция между металлом
и водой, кислотой, щелочью, растворами солей возможна.
Взаимодействие металла с электролитами – гетерогенные реакции и протекают в несколько стадий.
В результате подвода частиц электролита к поверхности металла изменяется поверхностное натяжение, происходит адсорбция частиц электролита.
Окислитель как более электроотрицательный элемент оттягивает электроны с поверхности металла. Энергия взаимодействия электролита и металла идет на разрушение связи (кристаллической решетки), в результате чего возможно образование оксида или гидроксида металла. Если образуется растворимый продукт, то поверхность металла обнажается, и новые частицы электролита подходят к ней, процесс продолжается. Если продукты реакции нерастворимы, то поверхность металла блокируется и взаимодействие прекращается.
Система металл – электролит характеризуется потенциалом φ, и взаимодействие идет по схеме:
восстановитель 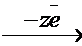 окислитель.
окислитель.
Следовательно, реакция термодинамически возможна, если φок > φвос, тогда Δ G = – zFE = – zF (φок – φвос) <0.
Активность взаимодействия металла с электролитом характеризуется значением стандартного электродного потенциала, φ0
Металлы по активности условно делят на 3 группы (табл. 9.1):
Таблица 9.1
Классификация металлов по активности их взаимодействия с электролитами
| Группа
| Mez+/Me
| φ0Mez+/Me
| Признак
|
|
I. Сильно -активные
| Li+/Li
K+/K
Na+/Na
Mg2+/Mg
| -3,04
-2,92
-2,71
-2,36
|
φ0< -1,66 В
|
|
ΙI. Средне - активные
| Al3+/Al
Ti2+/Ti
Zn2+/Zn
Cr3+/Cr
| -1,66
-1,67
-0,76
-0,74
|
-1,66 < φ0 <-0,44
|
|
III. Слабо - активные
| Fe2+/Fe
Cu2+/Cu
Ag+/Ag
| -0,44
+0,34
+0,79
|
φ0> -0,44 В
|
I. Сильноактивные – металлы, потенциал которых меньше –1,66 В (например, металлы IA и IIA групп).
II. Среднеактивные – металлы, которые имеют потенциал менее –1,66, но более –0,44 В (например, Al, Ti, Mn, Nb, Zn, Ga).
III. Слабоактивные – металлы, потенциал которых больше –0,44 В (например, Fe, Co, Ni, Sn, Pb, Cu, Ag).
Рассмотрим некоторые типичные случаи взаимодействия металлов с активными средами.
9.4.1. Взаимодействие металлов с бескислородными кислотами. Бескислородные кислоты – растворы галогеноводородов в воде: соляная (НСl), плавиковая (HF), бромоводородная (HBr), йодоводородная (HI), сероводородная (H2S) и т.д.
Наиболее типичная реакция для свободных металлов и бескислородных кислот протекает по схеме:
Мe0 + 2Н+= Мez+ + Н20 ↑,
Мez+ + z ē = Мe0 j0вос = j0 Mez+/Me,
2Н+ + 2ē = Н20 j0ок = j H+/ H = – 0,059· pH.
Металл – восстановитель, следовательно, отдает электроны.
Окислителем являются ионы водорода, и реакция сопровождается выделением газообразного водорода в случае металлов, которые в ряду активности находятся левее водорода.
Рассчитав Δ G 0 = – zFE 0 = – zF (j0ок – j0вос) = –zF(j0H+/H – j0Mez+/Me), делаем вывод о возможности протекания реакции.
Выясним, не окажут ли кинетические затруднения (поляризация, которая может быть вызвана образованием нерастворимой пленки и т.п.) влияние на ход реакции. Возможные кинетические затруднения в протекании реакции рассчитываем с учетом значений перенапряжения η:
Δ G ' = – zF (φ'ок – φ'вос) = – zF [(φ0ок – ηок) – (φ0вос + ηвос)].
Перенапряжение выделения водорода на разных металлах различно и зависит от рН. Значения перенапряжения – табличные данные.
Данная реакция термодинамически возможна, если электродный потенциал металла j  (jвосст) меньше потенциала окислителя (j
(jвосст) меньше потенциала окислителя (j 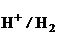 ). Потенциал водородного электрода в слабо- кислой среде (рН» 0) равен нулю.
). Потенциал водородного электрода в слабо- кислой среде (рН» 0) равен нулю.
Таким образом, все металлы, у которых электродный потенциал меньше нуля, могут восстанавливать водород из соляной кислоты, за исключением свинца (Рb), который образует нерастворимое соединение PbCl2, большое перенапряжение по водороду (η = 1,56 В), т.е. в данном случае имеются кинетические затруднения.
9.4.2. Взаимодействие металлов с водой. Металлы высокой химической активности (сильные восстановители) могут разлагать воду с вытеснением водорода при комнатной температуре, менее активные металлы вступают в реакцию с водой при нагревании, образуя соответствующие гидроксиды или оксиды:
Мe0 + 2 НOH= Мe(OH)z + Н20 ↑,
Мez+ + z ē = Мe0 j0вос = j0 Mez+/Me,
2НOH + 2ē = Н20 + 2ОН- j0ок = j H+/ H = – 0,059· pH.
Металл – восстановитель.
Окислителем являются ионы водорода в составе молекулы воды. Термодинамические и кинетические расчеты проводятся аналогично предыдущему.
Возможность протекания данной реакции определяется по величине энергии Гиббса или сравнением jокисл и jвосст:
При условии, что jокисл (Н2О/Н2,ОН-) больше jвосст (Me z +/Me), реакция взаимодействия металла с водой возможна.
Потенциал водородного электрода определяется выражением
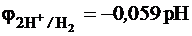 .
.
Так как вода имеет рН равный 7,  = –0,414 В. Однако выделение водорода на металлах может сопровождаться поляризацией, т. е. сдвигом потенциала, определяемого величиной перенапряжения (h). Потенциал выделения водорода на металлах определяется с учетом перенапряжения по формуле
= –0,414 В. Однако выделение водорода на металлах может сопровождаться поляризацией, т. е. сдвигом потенциала, определяемого величиной перенапряжения (h). Потенциал выделения водорода на металлах определяется с учетом перенапряжения по формуле
 = –0,414 - h.
= –0,414 - h.
Исходя из вышеизложенного, металлы, электродный потенциал которых отрицательнее (с учетом перенапряжения) потенциала водородного электрода при рН=7 ( = –0,414 В), могут восстанавливать водород из воды.
= –0,414 В), могут восстанавливать водород из воды.
Наряду с термодинамическим расчетом, необходимо учитывать, что многие металлы покрыты оксидными пленками (Al – Al2O3, Ti – TiO2, Be – BeO). Поэтому лишь в отсутствии кинетических затруднений, когда оксидная пленка снята механически или химически, при условии, что 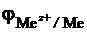 < - 0,414 B, можно наблюдать выделение Н2 при реакции с водой.
< - 0,414 B, можно наблюдать выделение Н2 при реакции с водой.
9.4.3. Взаимодействие металлов с растворами щелочей. Взаимодействие металлов с растворами щелочей происходит по реакции:
Me0 + H+OH- + NaOH → H2↑+ 1), 2), 3 ).
Мez+ + z ē = Мe0 j0вос = j0 Mez+/Me,
2НOH + 2ē = Н20 + 2ОН- j0ок = j H+/ H = – 0,059· pH.
При взаимодействии с растворами щелочей металл –восстановитель. Окислителем будут ионы водорода в составе молекулы воды.
Продукты реакции в зависимости от природы металла различны:
1. Если металл не способен к образованию комплексного соединения в растворе щелочи, то он присоединяет столько ОН–-групп, чтобы скомпенсировать степень окисления иона металла. Например, при взаимодействии магния со щелочами продуктом реакции, кроме водорода, является Mg(OH)2,
2. Если металл способен к образованию комплексного соединения в растворе щелочи (например, бериллий, цинк, алюминий), то он присоединяет столько ОН–-групп, что в результате образуется комплексный ион, в котором лигандами являются гидроксид-ионы. Таким образом взаимодействуют с растворами щелочей только амфотерные металлы, электродные потенциалы которых меньше –0,82 В. С щелочными растворами они взаимодействуют по реакции:
Al + NaOH + H2O → Na3[Al(OH)6] + H2;
Na[Al(OH)4]
Zn + NaOH + H2O → Na2[Zn(OH)4] + H2.
Be + NaOH + H2O → Na2[Be(OH)4] + H2.
3. Если металл пассивируется в растворе щелочи, то образуется оксид металла. Так, при взаимодействии титана со щелочами продуктом реакции, кроме водорода, является TiO.





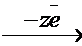 окислитель.
окислитель. (jвосст) меньше потенциала окислителя (j
(jвосст) меньше потенциала окислителя (j 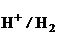 ). Потенциал водородного электрода в слабо- кислой среде (рН» 0) равен нулю.
). Потенциал водородного электрода в слабо- кислой среде (рН» 0) равен нулю.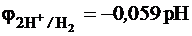 .
. = –0,414 В. Однако выделение водорода на металлах может сопровождаться поляризацией, т. е. сдвигом потенциала, определяемого величиной перенапряжения (h). Потенциал выделения водорода на металлах определяется с учетом перенапряжения по формуле
= –0,414 В. Однако выделение водорода на металлах может сопровождаться поляризацией, т. е. сдвигом потенциала, определяемого величиной перенапряжения (h). Потенциал выделения водорода на металлах определяется с учетом перенапряжения по формуле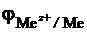 < - 0,414 B, можно наблюдать выделение Н2 при реакции с водой.
< - 0,414 B, можно наблюдать выделение Н2 при реакции с водой.

