Электрод – система, состоящая из проводника 1-го рода (металл, уголь), находящегося в контакте с проводником 2-го рода (раствор, расплав), носителем которого являются ионы.
Электрод представляет собой электрохимическую систему, которая состоит как минимум из двух фаз. На границе раздела фаз протекают гетерогенные реакции, в результате которых происходит переход заряженных частиц через границу раздела, что сопровождается образованием на этой границе ДЭС (двойного электрического слоя).
Равновесные процессы передачи электронов, записываемые как Ox + zē D Red, называются потенциалопределяющими.
Потенциал является электрической характеристикой электрода.
Потенциал электрохимической системы, измеренный при стандартных условиях, называется стандартным электродным потенциалом, единица измерения – В.
Для системы Ox + zē D Red обозначается как φ0Ox/Red.
Абсолютные значения стандартных потенциалов не определяются. Значения электродных потенциалов обычно берутся относительно системы H+ + ē → ½H20, у которой стандартный потенциал принят за 0. Стандартные потенциалы окислительно-восстановительных систем приводятся в таблицах.
Величины стандартных потенциалов металлов (φ 0) являются мерой восстановительной способности их атомов и мерой окислительной способности ионов металлов. Чем более отрицательное значение имеет потенциал системы Меz+/Ме, тем более сильной восстановительной способностью обладает атом. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. Например, к наиболее сильным восстановителям (в водном растворе) относится литий (φ 0Li+/Li = -3,04 B), а к наиболее сильным окислителям – ионы золота Au3+, Au+ (φ 0Au3+/Au = +1,50 B, φ 0Au+/Au = +1,69 B).
Потенциал электрохимической системы зависит от природы металла и электролита, температуры, концентрации электролита.
Для процесса Ox + zē D Red эта зависимость выражается уравнением Нернста:

 =
= 
 +
+ 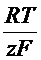 ln
ln 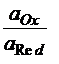 ,
,
где φ 0 Ox / Red – стандартный электродный потенциал;
z – число электронов, участвующих в данной потенциалопределяющей реакции;
R – универсальная газовая постоянная (8,31  );
);
T – температура, К;
F – постоянная Фарадея (96500  );
);
aox, ared – активности окисленной и восстановленной форм.
Для разбавленных растворов, где активность приблизительно равна концентрации, при 298 К, после подстановки постоянных величин уравнение примет вид:

 =
= 
 +
+ 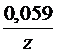 lg
lg  .
.
При записи электродов, вертикальной чертой (│) обозначают границу раздела фаз металл – электролит и придерживаются следующих правил:
1) слева указываются вещества, находящиеся в растворе; справа – вещества, образующие другую фазу или электродный материал:
Cu2+│Cu.
2) если одна фаза содержит несколько веществ, то их символы разделяют запятыми:
Co3+, Co2+│Pt.
3) при записи уравнения электродной реакции слева указывают вещества в окисленной форме и электроны, справа вещества в восстановленной форме: Ox + zē D Red
2H+ + 2 ē D H2
Co3+ + ē D Co2+.






 =
=  +
+ 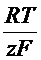 ln
ln 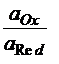 ,
, );
); );
);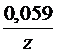 lg
lg  .
.


