

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
На аноде в первую очередь окисляются вещества, имеющие наиболее отрицательные значения потенциалов, т.е. более сильные восстановители.
На нерастворимом аноде (изготовляют из угля, графита, платины, иридия) окисляются последовательно:
1) анионы бескислородных кислот (например, С1  , Вг
, Вг  , I
, I  ) достаточно легко,
) достаточно легко,
2) молекулы воды с выделением кислорода (2HOH–4ē=O2+4H+), если раствор содержит анионы кислородсодержащих кислот, так как для разряда анионов требуется значительно более высокий анодный потенциал, чем для реакции анодного окисления воды.
При электролизе водных растворов на растворимом аноде (изготавливают из меди, серебра, цинка, кадмия, никеля и других металлов) в первую очередь будет идти процесс с наименьшей величиной φ, т.е. растворение материала электрода (табл. 8.2).
Таблица 8.2
Aнодные процессы
| Анод | Вещества, содержащиеся в водном растворе | Продукты электролиза |
| нерастворимый | анионы бескислородных кислот:
С1  , Вг , Вг  , I , I  … …
| 2Х  - 2e → Х2 - 2e → Х2
|
кислородсодержащие анионы:
SO  ; NO ; NO  ; CO ; CO 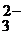 ; PO ; PO  ; SO ; SO 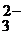 … …
| 2HOH–4ē=O2+4H+ | |
| растворимый | металл анода: Ni, Cu, Pb, Zn | Мe0 -zē= Мez+ |
Основываясь на приведенных схемах, нетрудно прийти к выводу, что при электролизе, например, водного раствора KBr на катоде выделяется водород, в катодном пространстве происходит накопление KOH, а на аноде выделяется бром. При электролизе раствора CuSO4 на катоде образуется медь, а на аноде выделяется кислород и одновременно увеличивается концентрация серной кислоты в анодном пространстве. При электролизе раствора CuSO4 с медным (растворимым) анодом пойдет процесс окисления анода, т.е. растворения медного электрода.
При электролизе водных растворов H2SO4, KOH, NaOH химическому превращению фактически подвергается вода.
Пример 1. Электролиз водного раствора Fe(NO3)2, анод – растворимый из железа.
Чтобы определить наличие в растворе заряженных частиц, записываем уравнение диссоциации соли и уравнение реакции гидролиза:
Fe(NO3)2 = Fe2+ + 2(NO3)  ;
;
Fe2+ + H2O = (FeOH)+ + H+, pH < 7.
Исходя из приведенного, укажем молекулы и ионы, которые могут разряжаться на аноде и катоде.
(–) Катод (+) Анод
← Fe2+ → H2O
← H+ → (NO3) 
→ Fe0
Fe2+ + 2 ē = Fe0
2H+ + 2 ē = H2 2Fe0 - 4 ē = 2Fe2+.
В результате электролиза раствора электролита Fe(NO3)2 с растворимым анодом протекают следующие электродные процессы:
K: 2H+ +2 ē → H02
Fe2+ + 2 ē = Fe0.
A: Fe0 – 2 ē → Fe2+
Пример 2. Электролиз водного раствора Fe(NO3)2, нерастворимый анод (например Pt).
Проанализируем, какие изменения произошли в системе: теперь отсутствует Fe0, а Pt как нерастворимый электрод только пропускает через себя электроны. Следовательно, катодные реакции сохраняются прежними, а на аноде конкурируют Н2О и (NO3)  . Для простейшего объяснения следует иметь в виду, что частица (NO3)
. Для простейшего объяснения следует иметь в виду, что частица (NO3)  имеет более сложную структуру, чем Н2О, поэтому на аноде электроны будут отдавать кислород воды. То же самое будет происходить, если окажется не нитратная соль, а сульфат, фосфат, карбонат или любая другая соль кислородсодержащей кислоты, т.е. в этих случае тоже разрядке подвергается Н2О.
имеет более сложную структуру, чем Н2О, поэтому на аноде электроны будут отдавать кислород воды. То же самое будет происходить, если окажется не нитратная соль, а сульфат, фосфат, карбонат или любая другая соль кислородсодержащей кислоты, т.е. в этих случае тоже разрядке подвергается Н2О.
Если же электролизу подвергаются галогениды, то учитывая, что Н2О по структуре сложнее, в анодной реакции отдавать электроны будут галогениды, например: 2Cl  – 2
– 2  → Cl
→ Cl 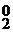 .
.
Записываем реакции на аноде и катоде для раствора Fe(NO3)2 с нерастворимым анодом:
(–) Катод (+) Анод (нерастворимый)
← Fe2+ → H2O
← H+ → (NO3) 
Fe2+ + 2 ē = Fe0
2H+ + 2 ē = H2 2H2O - 4 ē = O2 + 4H+.
При электролизе водных растворов, содержащих анионы кислородсодержащих кислот, происходит разложение воды. Потому что для разряда анионов кислородсодержащих кислот, который сопровождается выделением кислорода, требуется значительно более высокий анодный потенциал, чем для реакции анодного окисления воды.
Пример 3. Электролиз расплава Fe(NO3)2, растворимый анод (Fe0).
В расплаве происходит диссоциация:
Fe(NO3)2 = Fe2+ + 2(NO3)  .
.
Ввиду отсутствия воды, гидролиз не происходит, и ионы Н+ не образуются.
(–) Катод (+) Анод
← Fe2+ → (NO3) 
→ Fe0
Fe2+ + 2 ē → Fe0 Fe0 - 2 ē → Fe2+.
Суммируя уравнения катодного и анодного процессов (с учетом электронного баланса), получим окислительно-восстановительную реакцию, протекающую при электролизе расплава соли с растворимым анодом:
Fe2+ +Fe0 → Fe0 + Fe2+.
Процессы электролиза подчиняются законам Фарадея.
Расчет массы вещества (m), выделившегося на катоде либо окисленного на аноде, проводим по формуле, отражающей закон Фарадея: количество веществ, подвергающихся окислению на аноде или восстановлению на катоде электрохимической системы, определяется как
m = α · I · τ · BТ, α =  ,
,
где α – электрохимический эквивалент вещества,
А – атомная масса металла;
z – валентность металла;
F – число Фарадея (96500 Кл/моль);
I – сила тока,
τ – время электролиза в секундах.
|
|
|

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
© cyberpedia.su 2017-2026 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!