Цель лекций –
Ключевые слова (термины) -
План лекции:
- Современные направления селекционных разработок. Селекция производственных штаммов для повышения продуктивности; ускорения роста; повышения энергии брожения; приобретения способности роста в необычных условиях.
- Индуцированный мутагенез. Ступенчатый отбор. Селективные методы отбора. Использование конструктивных мутантов в селекций. Мутанты с изменой регуляцией метаболизма.
- Локализованный и сайт-специфический мутагенез. Воздействие мутагенов на определенную часть генома. Использование транспозонов, трансдуцирующих фагов, F’и R’ плазмид, содержащих определенные участки бактериального генома в локализованном мутагенезе.
- Клонирование, выделение и обработка мутагеном фрагментов ДНК. Введение в реципиентные штаммы. Транспозонный мутагенез.
1. Современные направления селекционных разработок. Селекция производственных штаммов для повышения продуктивности; ускорения роста; повышения энергии брожения; приобретения способности роста в необычных условиях.
Селекция (от лат. selectio — выбор, отбор) — это наука о путях и методах создания новых и улучшения уже существующих сортов культурных растений, пород домашних животных и штаммов микроорганизмов с ценными для практики признаками и свойствами.
Задачи селекции вытекают из ее определения — это выведение новых и совершенствование уже существующих сортов растений, пород животных и штаммов микроорганизмов.
Сортом, породой и штаммом называют устойчивую группу (популяцию) живых организмов, искусственно созданную человеком и имеющую определенные наследственные особенности. Все особи внутри породы, сорта и штамма имеют сходные наследственно закрепленные морфологические, физиолого-биохимические и хозяйственные признаки и свойства, а также однотипную реакцию на факторы внешней среды.
Основными направлениями селекции являются:
1. Высокая урожайность сортов растений, плодовитость и продуктивность пород животных;
2. Качество продукции (например, вкус, внешний вид, лежкость плодов и овощей, химический состав зерна — содержание белка, клейковины, незаменимых аминокислот и т. д.);
3. Физиологические свойства (скороспелость, засухоустойчивость, зимостойкость, устойчивость к болезням, вредителям и неблагоприятным климатическим условиям);
4. Интенсивный путь развития (у растений — отзывчивость на удобрения, полив, а у животных — «оплата» корма и т. п.).
Цели и задачи селекции как науки обусловлены уровнем агротехники и зоотехники, уровнем индустриализации растениеводства и животноводства. Например, в условиях дефицита пресной воды уже выведены сорта ячменя, которые дают удовлетворительные урожаи при орошении морской водой. Выведены породы кур, не снижающие продуктивности в условиях большой скученности животных на птицефабриках. Для России и Беларуси очень важно создание сортов, продуктивных в условиях мороза без снега при ясной погоде, поздних заморозков и т. д.
Микроорганизмы (бактерии, микроскопические грибы, простейшие и др.) играют исключительно важную роль в биосфере и хозяйственной деятельности человека (см. гл. 5,6). Из более чем 100 тыс. видов известных в природе микроорганизмов человеком используется несколько сотен, и число это растет. Качественный скачок в их использовании произошел в последние десятилетия, когда были установлены многие генетические механизмы регуляции биохимических процессов в клетках микроорганизмов.
Многие из них продуцируют десятки видов органических веществ — аминокислот, белков, антибиотиков, витаминов, липи-дов, нуклеиновых кислот, ферментов, пигментов, Сахаров и т. п., широко используемых в разных областях промышленности и медицины. Такие отрасли пищевой промышленности, как хлебопечение, производство спирта, молочных продуктов, виноделие и многие другие, основаны на деятельности микроорганизмов.
Микробиологическая промышленность предъявляет к продуцентам различных соединений жесткие требования, которые важны для технологии производства; это высокая скорость роста, использование для жизнедеятельности дешевых субстратов и устойчивость к заражению посторонними микроорганизмами. Научная основа этой промышленности — умение создавать микроорганизмы с новыми, заранее определенными генетическими свойствами и умение использовать их в промышленных масштабах.
Селекция микроорганизмов (в отличие от селекции растений и животных) имеет ряд особенностей: 1) у селекционера имеется неограниченное количество материала для работы: за считанные дни в чашках Петри или пробирках на питательных средах можно вырастить миллиарды клеток; 2) более эффективное использование мутационного процесса, поскольку геном микроорганизмов гаплоидный, что позволяет выявить любые мутации уже в первом поколении; 3) простота генетической организации бактерий: значительно меньшее количество генов, их генетическая регуляция более простая, взаимодействия генов просты или отсутствуют.
Эти особенности накладывают свой отпечаток на выбор методов селекции микроорганизмов, которые во многом существенно отличаются от методов селекции растений и животных. Например, в селекции микроорганизмов обычно учитываются их естественные способности синтезировать какие-либо полезные для человека соединения (аминокислоты, витамины, ферменты и др.). В случае использования методов генной инженерии можно заставить бактерии и другие микроорганизмы продуцировать те соединения, синтез которых в естественных природных условиях им никогда не был присущ (например, гормоны человека и животных, биологически активные соединения).
Природные микроорганизмы, как правило, обладают низкой продуктивностью содержащихся в них веществ, которые интересуют селекционера. Для использования же в микробиологической промышленности нужны высокопродуктивные штаммы, которые создаются различными методами селекции, в том числе отбором среди природных микроорганизмов.
Отбору высокопродуктивных штаммов предшествует целенаправленная работа селекционера с генетическим материалом исходных микроорганизмов. В частности, широко используют раз-личные способы рекомбинирования генов: конъюгацию, трансдукцию, трансформацию и другие генетические процессы. Например, конъюгация (обмен генетическим материалом между бактериями) позволила создать штамм Pseudomonas putida, способный утилизировать углеводороды нефти.
Часто прибегают к трансдукции (перенос гена из одной бактерии в другую посредством бактериофагов), трансформации (перенос ДНК, изолированной из одних клеток, в другие) и амплификации (увеличение числа копий нужного гена).
Так, у многих микроорганизмов гены биосинтеза антибиотиков или их регуляторы находятся в плазмиде, а не в хромосоме. Поэтому увеличение числа этих плазмид путем амплификации позволяет существенно повысить выход антибиотиков.
Важнейшим этапом в селекционной работе является индуцирование мутаций. Экспериментальное получение мутаций открывает почти неограниченные перспективы для создания высокопродуктивных штаммов. Вероятность возникновения мутаций у микроорганизмов (1x10-10— 1 х 10-6) ниже, чем у всех других организмов (1x10-6—1x10-4). Но вероятность выделения мутаций по данному гену у бактерий значительно выше, чем у растений и животных, поскольку получить многомиллионное потомство у микроорганизмов довольно просто и сделать это можно быстро.
Для выявления мутаций служат селективные среды, на которых способны расти мутанты, но погибают родительские клетки дикого типа. Проводится также отбор по окраске и форме колоний, скорости роста мутантов и диких форм и т. д.
Отбор по продуктивности (например, продуцентов антибиотиков) осуществляется по степени антагонизма и угнетения роста чувствительного штамма. Дня этого штамм-продуцент высевается на «газон» чувствительной культуры. По размеру пятна, где отсутствует рост чувствительного штамма вокруг колонии штамма-продуцента, судят о степени его активности (в данном случае антибиотической). Для размножения, естественно, отбираются наиболее продуктивные полонии. В результате селекции производительность продуцентов удается увеличить в сотни и тысячи раз. Например, путем комбинирования мутагенеза и отбора в работе с грибом Penicillium был увеличен выход антибиотика пенициллина примерно в 10 тыс. раз по сравнению с исходным диким штаммом.
Важным подходом в селекционной работе с микроорганизмами является получение рекомбинантов путем слияния протопластов, или гибридизации, разных штаммов бактерий. Слияние протопластов позволяет объединить генетические материалы и таких микроорганизмов, которые в естественных условиях не скрещиваются.
2. Индуцированный мутагенез. Ступенчатый отбор. Селективные методы отбора. Использование конструктивных мутантов в селекций. Мутанты с изменой регуляцией метаболизма.
Искусственно полученные мутантные формы являются ценным материалом для селекции, поскольку в контролируемых условиях можно получить мутации, встречающиеся в природе очень редко или вообще не обнаруживаемые. Мутагенез широко применяется в селекции микроорганизмов и растений.
Для получения индуцированных мутаций у растений используют самые различные мутагены. Дозу этих мутагенов подбирают таким образом, чтобы погибало не более 30-50% обработанных объектов. Например, при использовании ионизирующего излучения такая критическая доза составляет от 1-3 до 10-15 и даже 50-100 килорентген. При использовании химических мутагенов применяют их водные растворы с концентрацией 0,01-0,2%; время обработки – от 6 до 24 часов и более.
Обработке подвергают пыльцу, семена, проростки, почки, черенки, луковицы, клубни и другие части растений. Растения, выращенные из обработанных семян (почек, черенков и т.д.) обозначаются символом M 1 (первое мутантное поколение). В M 1отбор вести трудно, поскольку большая часть мутаций рецессивна и не проявляется в фенотипе. Кроме того, наряду с мутациями часто встречаются и ненаследуемые изменения: фенокопии, тераты, морфозы. Поэтому выделение мутаций начинают в M 2 (втором мутантном поколении), когда проявляется хотя бы часть рецессивных мутаций, а вероятность сохранения ненаследственных изменений снижается. Обычно отбор продолжается в течение 2-3 поколений, хотя в некоторых случаях для выбраковки ненаследуемых изменений требуется до 5-7 поколений (такие ненаследственные изменения, сохраняющиеся на протяжении нескольких поколений, называют длительными модификациями).
Полученные мутантные формы или непосредственно дают начало новому сорту (например, карликовые томаты с желтыми или оранжевыми плодами) или используются в дальнейшей селекционной работе.
Однако применение индуцированных мутаций в селекции все же ограничено, поскольку мутации приводят к разрушению исторически сложившихся генетических комплексов. У животных мутации практически всегда приводят к снижению жизнеспособности или бесплодию. Поэтому в селекции стараются использовать уже известные мутации, которые прошли испытание естественным отбором.
Наследственные изменения какого-либо признака - мутации - возникают в результате структурных изменений генов или хромосомных перестроек. Большинство возникающих изменений относится к вредным или бесполезным. Но какая-то часть мутаций оказывается полезной для селекционера: появляются формы неполегающие, иммунные, с цитоплазматической стерильностью, скороспелые и т. д.
Одно из преимуществ метода мутагенеза перед методом гибридизации - возможность получения форм с совершенно новыми ценными признаками, отсутствовавшими ранее у данной культуры, например с резко измененным химическим составом (сорт подсолнечника Первенец).
Мутации вызываются многими радиационными и химическими мутагенами. К радиационным мутагенам относятся различные виды излучения: нейтроны, альфа-частицы, гамма-лучи, рентгеновские лучи, лазер и т. д. Наиболее простой метод получения мутаций - обработка радиационными мутагенами семян или пыльцы растений, которая затем используется для опыления. Для хронического облучения вегетирующих растений их выращивают на специальных площадках, в центре которых помещен источник облучения. Наибольший процент мутаций имеет место при дозах облучения, близких к критическим, когда более половины обработанных растений погибает. Но выход полезных мутаций при больших дозах, как правило, невысок, поэтому дозы применяют в 1,5-2 раза ниже критических. При облучении семян пшеницы, ячменя, гороха применяется доза 50-100 гр (1 гр=100 рад), а при облучении пыльцы дозы уменьшаются до нескольких грей.
Радиационные мутагены обычно вызывают широкий спектр мутаций, но обладают меньшей направленностью действия, чем различные химические мутагены, у которых доля полезных мутаций значительно выше (30—60% и более). Среди мутантов, полученных при помощи химических веществ, чаще обнаруживаются формы с полезными изменениями нескольких признаков или свойств.
В закрытом эксикаторе создается атмосфера, насыщенная парами мутагена, который легко проникает в семена. Химическими мутагенами обрабатывают также черенки, клубни, вводят их в стебель растения и т. д.
Количество и ценность возникающих мутаций зависят от вида облучения или химического мутагена, от дозы облучения и концентрации мутагенов, от состояния объекта обработки и от условий облучения (температуры, влажности и т. д.). На знании этих особенностей основана разработка приемов снижения повреждающего эффекта мутагенов.
Мутабильность зависит и от генотипа растения. Разные сорта дают неодинаковый процент мутантов при обработке одним и тем же мутагеном.
Для выявления мутантов обработанные семена высевают и в первом поколении (M1) отбирают доминантные мутации, но они редки. Рецессивные мутации выявляют в М2 и М3. Растения с ценными отклонениями отбирают и проверяют по потомству обычными методами. Менее трудоемок метод пересева. При этом семена без отборов пересевают несколько раз, а после прекращения расщепления отбирают растения, которые затем проверяют по потомству. Перекрестное опыление создает дополнительные затруднения при выявлении мутаций.
Пути использования индуцированных мутантов различны. Возможен отбор ценных мутантов с изменениями, как по отдельным признакам, так и по их комплексу. Мутанты широко используются для гибридизации, их скрещивают друг с другом и с сортами, в том числе и с исходными. Скрещивание ряда мутантов, устойчивых к отдельным расам болезни, позволяет создавать формы, устойчивые ко многим ее расам. Индуцированный мутагенез позволяет решать и специфические селекционные задачи - разрывать сцепление генов, получать транслокации (перемещения хромосомных сегментов) и т. д.
Мутационная изменчивость. Это естественный фактор эволюции. В популяции клеток в каждом поколении по каждому гену обнаруживается 105 - 107 мутантных клеток. Благодаря спонтанным мутациям микроорганизмы легко приспосабливаются к новым условиям существования. Частота мутаций возрастает после действия мутагенных факторов. Индуцированные мутации позволяют получить биообъект с высокими полезными продуктивными свойствами.
Так, мутанты некоторых прототрофов становятся способными к синтезу необычных продуктов. Так, если Streptomyces grisius синтезирует хлортетрациклин, то мутант полученный на его основе – тетрациклин.
Мутационные изменения приводят к физиологическим и морфологическим изменениям клетки. Поэтому у мутанта становятся иными требования к питательной среде и к условиям культивирования. У суперпродуцентов положительные мутанты встречаются реже, т.к. их геном уже насыщен мутациями.
Отбор положительных мутантов. Для этого проверяют тысячи мутантных культур, используют скрининговые методы или естественный отбор. Например, хересные винные дрожжи (Saccharomyces oviformis), при переокислении спирта образуют продукты, которые придают вину хересный букет. Но такие дрожжи чувствительны к концентрациям спирта выше 15%. Так, при длительном повышении содержания спирта до 18% и пользуясь методом естественного отбора, удалось выделить штамм, который образует херес при повышенных концентрациях спирта.
Положительные мутанты можно выделять успешнее, если знать особенности их метаболизма. При этом можно увеличить частоту получения положительных мутантов путем использования химических или биохимических факторов: селективная детоксикация питательного субстрата; добавление в питательную среду ингибитора целевого продукта; увеличение проницаемости клеточной мембраны; усиление выведения продукта из клетки; использование ауксотрофных мутантов; применение катаболитной репрессии; перевод ферментов из категории индуцируемых в разряд конституционных и т.д.
Так, при селективной детоксикации питательного субстрата токсические вещества взаимодействуют с продуктом сверхсинтеза. В результате детоксицируется субстрат и сохраняется выживаемость мутанта. Так получают бета-лактамные антибиотики, которые комплексируются с ионами тяжелых металлов или с токсическими аналогами аминоксилот.
Гибридизация микроорганизмов. Ранее этот метод селекции применялся редко, так как для микроорганизмов не свойственно скрещивание (половое размножение). Например, при гибридизации грибов используют вегетативную гибридизацию, которая аналогична половому процессу размножения. При этом генетический материал двух вегетативных клеток грибов обменивается при клеточном слиянии (парасексуальный цикл). Этот процесс можно оптимизировать методами клеточной инженерии.
Другой вид гибридизации – слияние протопластов. Протопласты – это клетки, лишенные клеточной стенки. Ее можно удалить следующими способами: выращивание клеток в присутствии антибиотиков, которые препятствуют образованию клеточной стенки; действие ферментом лизоцимом или комплексом ферментов микробного генеза (“дрожжелитин”).
Слиянию протопластов способствуют некоторые стимуляторы (полиэтиленгликоль). В гибридах затем легко образуется нормальная клеточная стенка.
Гибридизация микроорганизмов позволяет:
· интегрировать в одной клетке нужные свойства двух и более штаммов или видов. Так, дрожжи штамма Saccharomyces serevisiaе были скрещены с пивными дрожжами вида Saccharomyces carllsbergensis. Полученный гибрид полностью гидролизовал раффинозу до моносахаридов. Это не было характерно для родительских видов дрожжей;
· отбирать рекомбинанты второго поколения, т.е. после рекомбинации хромосом. При этом появляются клетки с новыми свойствами. Так, пивные дрожжи, сбраживающие сахарозу и мальтозу скрестили с дикими штаммами дрожжей, которые не сбраживали оба дисахарида. Получили гибрид, который не сбраживал сахарозу, но ассимилировал мальтозу. Такие клоны гибридов применяют при изготовлении “бархатного” пива (с несброженной сахарозой) и кваса;
· ввести в геном микроорганизма мутации других штаммов. Это сокращает длительность ступенчатого отбора. Так был получен штамм E. coli для производства треонина;
· инокулировать в бактерию гены, которые не характерны для данного вида или увеличить число уже существующих генов. Это повышает продуктивность микроорганизма по данному гену. Например, в E. coli были введены гены, определяющие синтез амилазы, целлюлазы, сахаразы и т.д.
3. Локализованный и сайт-специфический мутагенез. Воздействие мутагенов на определенную часть генома. Использование транспозонов, трансдуцирующих фагов, F’и R’ плазмид, содержащих определенные участки бактериального генома в локализованном мутагенезе.
Развитие генной инженерии революционизировало процесс получения мутаций в конкретных участках генома и анализ последствий этих мутаций на молекулярном уровне. Совокупность методов получения мутаций, основанных на использовании генно-инженерных подходов, называют направленным, или сайт-специфическим мутагенезом. Прообразом направленного мутагенеза является простая обработка клонированного гена химическими мутагенами in vitro, которая приводит к четкой локализации возникающих мутаций в пределах этого гена. В настоящее время разработано много эффективных методов сайт-специфического мутагенеза, позволяющих сознательно производить мутационные замены конкретных нуклеотидов. Направленное получение мутаций в сегментах рекомбинантных генов, введение мутантных генов в организм и исследование влияния полученных мутаций на функционирование гена – этот подход прямо противоположен классическим методам получения мутаций. Совокупность таких подходов получила название обратной генетики. Кроме того, возможность замены конкретных аминокислот в белках с известной первичной структурой, а также объединение в одной полипептидной цепи доменов различных белков и ферментов позволили, по сути дела, конструировать in vitro новые белки, не встречающиеся в природе, и привели к созданию в молекулярной генетике нового направления – белковой инженерии. В следующих разделах этой главы будут рассмотрены основные методы направленного мутагенеза и белковой инженерии, а также некоторые впечатляющие результаты, полученные с применением этих методов.
Получение делеций и вставок
Делецией называют потерю части нуклеотидов в геноме организма. Такой вид мутаций удобнее всего использовать для локализации (картирования) функционально значимых участков генов и кодируемых этими генами белков. Действительно, последовательное удаление все новых и новых участков ДНК на границах генов с помощью делеций оказалось исключительно плодотворным в обнаружении регуляторных элементов генов, исследовании их структурно-функциональных особенностей, взаимного расположения и влияния друг на друга. Простой и эффективный метод получения делеций любого размера разработан с использованием экзонуклеазы Bal31 для удаления нуклеотидов в окрестностях сайтов рестрикции (рис. II.16).
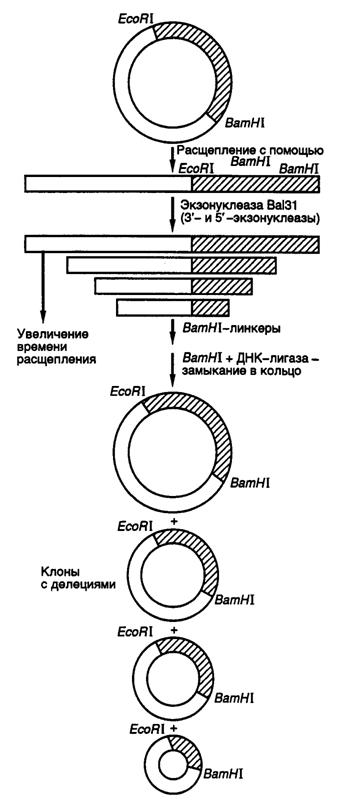
Рис. II.16. Получение делеций с помощью нуклеазы Bal31
Ген, клонированный в плазмиде, расщепляют по уникальному сайту рестрикции и образовавшиеся линейные молекулы ДНК инкубируют в присутствии экзонуклеазы Bal31. При этом экзонуклеаза последовательно удаляет нуклеотиды с обоих концов ДНК, причем количество удаляемых нуклеотидов прямо пропорционально времени инкубации ДНК с нуклеазой, а также зависит от температуры инкубации и концентрации фермента. В результате подобного действия образуется набор фрагментов ДНК разной длины, содержащих делеции различных размеров по обе стороны выбранного сайта рестрикции. К "тупым" концам таких молекул ДНК с помощью ДНК-лигазы присоединяют двухцепочечные олигонуклеотидные линкеры, содержащие уникальный (часто исходный) сайт рестрикции, обрабатывают соответствующей рестриктазой, замыкают молекулы в кольцо посредством лигирования и затем вводят их в бактериальные клетки. Точное картирование концов делеций осуществляют секвенированием соответствующих участков ДНК мутантных плазмид. В результате получают набор делеций разного размера, положение которых в исследуемом фрагменте ДНК строго локализовано.
Небольшие делеции в окрестностях сайтов рестрикции можно получать быстрее удалением "липких" концов линеаризованной плазмидной ДНК после рестрикции с последующим замыканием линейной ДНК в кольцо лигированием по образовавшимся "тупым" концам. В этом случае размер делеции соответствует размеру одноцепочечных "липких" концов в сайтах рестрикции. Кроме того, такой метод допускает простую проверку наличия мутаций в требуемом участке ДНК, так как в результате мутации происходит потеря уникального сайта рестрикции.
Для получения вставок коротких или протяженных последовательностей нуклеотидов в исследуемые участки клонируемых генов также разработаны эффективные и надежные методы. В простейшем случае такая задача решается путем расщепления исследуемого гена рестриктазой по уникальному сайту рестрикции и встраивания по этому сайту фрагмента природной ДНК или синтетического двухцепочечного олигонуклеотида, который фланкирован соответствующими "липкими" концами. Лигирование может проводиться и по "тупым" концам. В таком случае последовательности нуклеотидов на концах вставки уже не имеют существенного значения для встраивания этого фрагмента по сайту рестрикции.
Для создания множественных вставок коротких или протяженных последовательностей нуклеотидов в исследуемых участках ДНК в основном используют два подхода. В первом случае с помощью панкреатической ДНКазы в низких концентрациях в присутствии ионов Mn2+ вносят случайным образом один двухцепочечный разрыв в каждую векторную плазмиду, содержащую клонированный ген. К концам образовавшихся линейных молекул ДНК присоединяют с помощью ДНК-лигазы синтетические олигонуклеотидные линкеры, содержащие сайт рестрикции, который отсутствует в исследуемой плазмиде. Образовавшиеся линейные молекулы ДНК с линкерами обрабатывают рестриктазой, узнающей сайт рестрикции линкера, что приводит к образованию "липких" концов, и замыкают в кольцо с помощью ДНК-лигазы. В итоге кольцевые молекулы ДНК содержат исследуемый клонированный ген, в котором имеется по одной вставке локализованных случайным образом (в соответствии с расположением исходных двухцепочечных разрывов) олигонуклеотидных линкеров. Во втором случае статистические разрывы в двухцепочечной ДНК получают путем частичного (неполного) гидролиза мелкощепящими рестриктазами, которые узнают сайт рестрикции длиной в 4 нуклеотида. Метод получения вставок с использованием синтетических олигонуклеотидных линкеров получил название сканирования линкером.
Химический мутагенез
Делеции и вставки, создаваемые в структурных частях генов, как правило, их инактивируют, особенно в тех случаях, когда такие мутации приводят к сдвигу открытых рамок считывания. Поэтому делеции и вставки in vitro используют главным образом для поиска и изучения регуляторных элементов генов, влияющих на эффективность их экспрессии. Большое значение для исследования функционирования белков имеют методы мутагенеза in vitro, направленные на получение точковых мутаций, следствием которых являются одиночные замены аминокислот в полипептидных цепях.
Распространенным методом введения большого числа точковых мутаций разной локализации в исследуемые части генов in vitro является химический мутагенез одноцепочечных участков рекомбинантных ДНК. Принцип подобных методов заключается в том, что некоторые химические мутагены, такие как бисульфит натрия, гидроксиламин или метоксиламин, действуют только на одноцепочечные участки ДНК. Следовательно, получив молекулы ДНК, содержащие одноцепочечные бреши в исследуемых участках генов, можно с помощью бисульфита натрия дезаминировать остатки цитозина в этих участках, т.е. превратить их в остатки урацила. После достройки цепи такой мутагенизированной молекулы ДНК с помощью фрагмента Кленова ДНК-полимеразы I E. coli происходит замена исходных G С-пар на T–U. Затем мутагенизированные молекулы ДНК с помощью трансформации вводят в бактериальные клетки, где по завершении первого раунда репликации в молекуле осуществляется замена остатков U на T и полная замена G–С-пары на A–T, т.е. имеет место обычная транзиция.
Одноцепочечные мутагенизированные участки ДНК удобно получать путем гибридизации одноцепочечной ДНК вектора с двухцепочечной ДНК того же вектора, содержащего клонированный ген или его участок, который необходимо мутагенизировать. В этом случае в образующемся гибриде-гетеродуплексе, одна цепь которого принадлежит вектору без вставки, а другая – вектору со вставкой, происходит выпетливание последовательности вставки в виде одноцепочечного участка ДНК. Обсуждаемый подход к получению статистического набора точковых мутаций с использованием химических мутагенов позволяет легко создавать большое число мутантных молекул ДНК, содержащих одну или несколько мутаций в разных сочетаниях. Последующий отбор мутантов на основе новых биохимических или иных параметров мутантных белков (исчезновение, ослабление или усиление ферментативной активности, появление новой активности или новых иммунологических свойств и т.п.) позволяет идентифицировать остатки аминокислот в исследуемых белках, отвечающие за эти изменения.
Несмотря на удобство введения такого рода мутаций в ДНК in vitro, химический мутагенез накладывает ограничения на спектр возникающих мутаций, так как лишь определенные остатки нуклеотидов ДНК претерпевают обязательные изменения. Поэтому многие мутации никогда не могут быть получены с помощью химических мутагенов. Проблему можно частично решить, используя для репарации одноцепочечных брешей ДНК аналоги нуклеотидов, например N-гидроксицитозинтрифосфат, который в составе ДНК одинаково хорошо спаривается с A и G, или создавая такие условия, при которых репарирующая ДНК-полимераза начинает ошибочно включать в синтезируемую цепь ДНК некомплементарные матрице нуклеотиды. Все перечисленные выше методы локального мутагенеза, осуществляемого in vitro, позволяют, в конечном счете, получать набор случайных мутаций, локализованных на определенном исследуемом участке ДНК. Мутагенизированные молекулы ДНК из одной реакционной пробирки представляют собой сложную смесь, в которой каждая молекула несет несколько независимо возникших мутаций. Для введения мутаций в определенный локус исследуемого гена необходимо проводить трудоемкую процедуру отбора, сопряженную с анализом большого числа мутантов. Подлинную революцию в направленном мутагенезе произвела разработка методов с использованием синтетических олигонуклеотидов.
^








