Разработка метода полимеразной цепной реакции принципиально изменила ситуацию в исследованиях по направленному мутагенезу. Использование ПЦР для направленного мутагенеза основано на применении в качестве праймеров олигонуклеотидов, не полностью комплементарных матричной ДНК. Повышенные требования к комплементарности накладываются лишь на последний, 3’-концевой, нуклеотид праймера, но даже в случае 3’-концевой некомплементарности праймеры часто продолжают функционировать в системе ПЦР, хотя и с разной эффективностью. В то же время некоторая способность 17-нуклеотидного праймера инициировать ПЦР проявляется даже при наличии всего восьми нуклеотидов, комплементарных матрице, три из которых расположены на его 3’-конце. Таким образом, простейшим способом введения сайт-специфических мутаций в амплифицируемый фрагмент ДНК является использование праймеров, частично комплементарных матрице, т.е. содержащих необходимые мутантные нуклеотиды. Этот способ применяется для создания в амплифицируемом продукте новых сайтов рестрикции для последующего его клонирования. Такой подход удобен для встраивания амплифицируемого продукта в экспрессирующий вектор в одной открытой рамке считывания (ОРС) с инициирующим ATG-кодоном вектора. Действительно, как уже обсуждалось в главе 7, экспрессирующие векторы часто содержат 5’-концевую часть будущего рекомбинантного гена, включая регуляторные последовательности, промотор, ATG-кодон и иногда дополнительные кодоны нескольких последующих аминокислот. При конструировании таких векторов в последовательности, следующие за ATG-кодоном, вводят сайты рестрикции, по которым и встраивают фрагмент экспрессируемого гена, кодоны которого (для полноценной экспрессии гена) должны находиться в одной ОРС с ATG-кодоном вектора. Положение природных сайтов рестрикции в клонируемом гене редко отвечает требованиям ОРС вектора. Поэтому введение искусственных сайтов рестрикции в клонируемый фрагмент с помощью праймеров, не полностью комплементарных матрице, является хорошим решением проблемы.
Вырожденные праймеры, которые представляют собой сложную смесь олигонуклеотидов, содержащих многие точковые мутации, также используют для сканирования мутациями определенных участков ДНК. В таком классическом варианте постановки ПЦР кроме точковых мутаций можно легко получать делеции и вставки. Дальнейшим усовершенствованием метода направленного мутагенеза с помощью ПЦР явилась разработка подхода к получению гибридных генов с помощью перекрывающихся праймеров (рис. II.18). Этот метод позволяет не только целенаправленно получать точковые мутации, делеции и вставки, но и гибридные молекулы ДНК без применения ДНК-лигазы.
Для получения точковых мутаций используют пару праймеров, в которых изменен соответствующий нуклеотид или небольшая группа нуклеотидов (мутантный сайт обозначен на рис. II.18, 1 прямоугольниками внутри праймеров). При этом внутренние праймеры b и с комплементарны друг другу.

^ Рис. II.18. Использование ПЦР для получения мутаций
Получение точковых мутаций (1), делеций (2) и вставок (3): a и d – внешние праймеры, b и c – внутренние праймеры. AB и CD – фрагменты ДНК, образовавшиеся в результате ПЦР с использованием праймеров a и b, а также c и d соответственно. После гибридизации друг с другом объединяемых фрагментов ДНК сформировавшимися комплементарными последовательностями нуклеотидов одноцепочечные участки достраиваются ДНК-полимеразой в процессе ПЦР
В первых ПЦР в отдельных пробирках амплифицируют правую и левую части мутагенизируемого сегмента ДНК с использованием пар праймеров a + b и с + d, что приводит к образованию двух фрагментов ДНК, перекрывающихся на участках, которые содержат включенные праймеры (этапы 1 и 2). Фрагменты очищают от праймеров, смешивают друг с другом в эквимолярном соотношении и после цикла тепловой денатурации и ренатурации используют в качестве матрицы в другой ПЦР с внешними праймерами a и d (этап 3). На этом этапе в первом цикле ПЦР происходит достройка цепей перекрывающихся фрагментов ДНК (пунктирные линии на рис. II.12, 1), и образовавшийся фрагмент двухцепочечной ДНК, содержащий требуемую мутацию, далее служит матрицей для амплификации и по завершении ПЦР присутствует в реакционной смеси в препаративном количестве.
Тот же принцип объединения двух фрагментов ДНК, перекрывающихся за счет праймеров, используется при получении делеций и вставок. Для создания делеции (на рис. II.18, 2 обозначена прямоугольниками на цепях ДНК) берут внутренние праймеры b и с, 5’-концы которых комплементарны матрице по одну сторону делетируемой последовательности нуклеотидов, а 3’-концы – последовательности нуклеотидов, фланкирующей другой ее конец. Образующиеся при этом продукты ПЦР AB и СD перекрываются в точке делеции и далее используются, как и в предыдущем случае. При получении вставок (см. рис. II.18, 3) применяют внутренние праймеры b и с, комплементарные друг другу своими 5’-концевыми частями, которые соответствуют образуемой олигонуклеотидной вставке во фрагмент матричной ДНК. 3’-Концы этих праймеров комплементарны участкам ДНК-матрицы, непосредственно примыкающим к сайту, в который производится вставка олигонуклеотида.
С помощью метода ПЦР удается легко получать и множественные мутации в конкретных участках ДНК. В этом случае амплификацию мутагенизируемого сегмента ДНК производят в присутствии трех (вместо четырех) дезоксирибонуклеозидтрифосфатов, причем один из них вводят в реакционную смесь в высокой концентрации. Именно этот нуклеотид преимущественно включается в амплифицируемый фрагмент ДНК вместо недостающего нуклеотида, что сопровождается накоплением в ДНК-продукте множественных случайных мутаций в виде соответствующих замен нуклеотидов. В таких искусственных условиях мутации возникают за счет снижения точности функционирования ДНК-полимеразы.
4. Клонирование, выделение и обработка мутагеном фрагментов ДНК. Введение в реципиентные штаммы. Транспозонный мутагенез.
Используют однокомпонентную и двухкомпонентную системы транспозонного мутагенеза. В однокомпонентной системе транспозонный мутагенез вызывается перемещением по геному автономного мобильного элемента (например, Ac элемента кукурузы), который содержит в своем составе ген транспозазы под контролем конститутивного промотора CaMV 35S и необходимые для транспозиции инвертированные повторы на 5' и 3' концах (Рис.4). О присутствии автономного элемента в геноме судят по проявлению маркерных генов, введенных в состав транспозона (например, генов hpt, bar и др., см. Табл.1). Как правило, сам Ac элемент встраивают в ген spt (Табл.1) или другой ген устойчивости к антибиотикам или гербицидам, входящий в состав Т-ДНК вектора, с помощью которого мобильный элемент был перенесен в растения A. thaliana. Это приводит к инактивации маркерного гена. В результате эксцизии Ас из состава Т-ДНК, происходит восстановление функции маркерного гена и растения становятся устойчивыми к стрептомицину. Контроль за дальнейшими перемещениями автономного элемента по геному не проводится, однако частоту транспозиций автономного элемента можно контролировать, если входящий в его состав ген транспозазы подставить под контроль индуцибельного промотора (например, промотора гена теплового шока).
При появлении в линии с автономным элементом растений с морфологическими изменениями об инсерционной природе изменений судят по наличию мозаицизма (соматических реверсий к исходному фенотипу) у потомков. При необходимости, для этой же цели можно провести анализ совместного наследования мутантного фенотипа и маркерных генов, входящих в состав самого транспозона (например, гена гигромицин-устойчивости).
Духкомпонентнаясистематранспозонного мутагенеза основана на совместном использовании двух элементов - модифицированного автономного элемента - источника транспозазы и неавтономного элемента (рис. 5). Для транспозонного мутагенеза A. thaliana чаще всего используют транспозоны кукурузы.
Перемещение неавтономного элемента (Ds или dSpm), не имеющего гена транспозазы в своем составе, происходит благодаря присутствию второго элемента (модифицированного Ac или Spm), который является источником транспозазы, но утрачивает способность к выходу из состава Т-ДНК и самостоятельным перемещениям. Это может достигаться с помощью делеции важных для транспозиции участков автономных элементов - например, делецией фланкирующих повторов.
Работа по транспозонному мутагенезу с двухкомпонентной системой состоит из нескольких этапов:
1. С помощью трансформации A.tumefaciens в составе Т-ДНК раздельно (в независимых экспериментах) передаются источник транспозазы (модифицированный автономный элемент) и неавтономный элемент. В результате получают две линии A. thaliana: линию, содержащую в составе Т-ДНК источник транспозазы, и линию, имеющую в области Т-ДНК неавтономный элемент. О наличии в геноме инсерций Т-ДНК судят по проявлению генов устойчивости к антибиотикам, маркирующих Т-ДНК. Для дальнейшей работы отбирают те линии трансформантов, которые содержат только одну инсерцию Т-ДНК в геноме.
2. Скрещивая растения двух линий (имеющей в геноме источник транспозазы и имеющей неавтономный элемент), получают гибриды F1, в геноме которых имеются оба элемента. В клетках полученных гибридов под влиянием транспозазы неавтономный элемент начинает перемещаться по геному. Поскольку большинство возникающих мутаций являются рецессивными, их можно обнаружить только в следующем семенном поколении (при условии, что мутации возникли в инициальных клетках). Чтобы убедиться в том, что транспозиции неавтономного элемента действительно происходят, автономный элемент вводят в ген устойчивости к антибиотику, что нарушает его работу (например, ген spt, определяющий устойчивость к стрептомицину, рис. 9). При эксцизии автономного элемента из Т-ДНК работа маркерного гена восстанавливается и по устойчивости к антибиотику можно убедиться в наличии эксцизий. Для контроля за присутствием в геноме неавтономного элемента и его выходом из Т-ДНК судят по проявлению дополнительных маркерных генов, которые входят в состав самого элемента.
3. Поиск видимых мутаций, вызванных инсерциейтранспозона. Их можно обнаружить, начиная с F2 поколения.
4. По наличию соматических реверсий, связанных с выходом транспозона из интересующего гена (вторичной транспозицией), подтверждают, что полученная мутация имеет инсерционную природу.
5. После обнаружения инсерционной мутации для дальнейших экспериментов по клонированию гена «вытягиванием гена за транспозон» следует выбрать растение, в котором транспозон прекращает дальнейшие перемещения и постоянно находится в исследуемом гене (маркирует его). С этой целью в той же семье, где был обнаружен мутант, или в его семенном потомстве, отбирают растения, которые не имеют маркеров Т-ДНК области, в состав которой входит источник транспозазы. В качестве негативных условных селективных маркеров Т-ДНК используют гены цитозиндеаминазы (codA) и цитохромаP450 (SU1), вызывающие чувствительность растений к 5-флуорцитозину и фотодинамическому гербициду R7402, соответственно. Часто применяется генIAAH, кодирующий гидролазу индолацетамида, который делает растения чувствительными к аналогу гербицида - нафтален-ацетоамину (NAM). При выращивании проростков в присутствии NAM выживают только те, которые не содержат в геноме ген IAAH, а следовательно и Т-ДНК. В таких растениях инсерция неавтономного элемента оказывается закрепленной в определенном месте.
Если маркировать негативным селективным маркером не только Т-ДНК, в состав которой включен источник транспозазы (модифицированный автономный элемент), но и неавтономный элемент, то с помощью NAMможно отбирать проростки cинсерцией неавтономного элемента в область, не сцепленную с первоначальным местом его локализации в геноме в составе Т-ДНК (рис. 6). Как уже отмечалось, частота перемещений транспозона в области, удаленные на расстояние >10 сМ от первоначальной локализации, или в другие хромосомы невелика. Тем не менее, растения, в которых произошли эти редкие события, можно отобрать на селективной среде. Такой прием позволяет использовать транспозонный мутагенез для получения мутаций в разных областях генома.
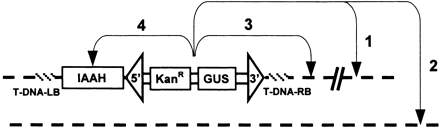
Рисунок 6. Контроль за эксцизией транспозона из области Т-ДНК (Parinovetal., 1999). Только после перемещения транспозона в удаленный район той же (1) или другой хромосомы (2) в семенном потомстве можно найти растения, устойчивые к NAM. При перемещении в сцепленные участки хромосомы (3) рекомбинация между геном IAAH и транспозоном маловероятна и потомки не проявят устойчивости к NAM. Исключением являются случаи транспозиции внутрь самого гена IAAH (4), которые могут нарушить его работу и привести к появлению устойчивости к NAM у потомства
Возможность управлять активностью перемещений Ds элемента с помощью отбора растений с геном транспозазы или без него является важнейшим преимуществом двукомпонентной системы транспозонного мутагенеза в сравнении с однокомпонентной. Скрестив растение со стабилизированным транспозоном с растением, имеющим источник транспозазы, можно вновь вызвать перемещения неавтономного элемента. В то же время однокомпонентная система значительно проще двукомпонентной системы в методическом отношении.
В настоящее время в международных банках семян содержатся линии A. thaliana, которые могут быть использованы дляодно- и двухкомпонентного транспозонного мутагенеза. Если задача заключается в насыщении мутациями определенного района хромосомы, то заранее можно выбрать линию, содержащую инсерцию Т-ДНК с транспозоном в интересующем районе хромосомы. Сведения о локализации инсерций имеются в базах данных.
Транспозонный мутагенез используется и для получения мутаций в конкретном гене (для получения дополнительных аллелей, для клонирования методом «вытягивания за транспозон»). С этой целью также используются линии с транспозонами, локализованными близко от интересующего гена. Если в распоряжении исследователя уже имеется рецессивная мутация, полученная в результате химического или радиационного мутагенеза, то для маркирования гена целесообразно вводить транспозон в растение, гетерозиготное по ранее полученной мутации. В этом случае инсерция в аллель дикого типа будет приводить к появлению мутантных секторов уже у гибридов F1 поколения.
Исследование структуры многочисленных неспецифических элиситоров при отсутствии специфических заставило, как было сказано выше, рассматривать процесс индукции устойчивости как неспецифический, а специфичность видеть в супрессии защитных реакций. Противоречия между данными генетических и биохимических исследований по вопросу о том, что является специфичным — индукция или супрессия, были разрешены методами молекулярной генетики. Для получения ответа на поставленный вопрос были использованы две методологии.
Получение мутаций гена, определяющего специфичность, и изучение реакции растения на заражение мутантным штаммом. Зондами для идентификации генов специфичности могут быть измененные последовательности информационных молекул или мобильные элементы генома (транспозоны).
У большинства фитопатогенных вирусов геном содержит всего несколько цистронов, поэтому доступен для полного секвенирования (определения последовательности оснований нуклеиновой кислоты). Поэтому для идентификации avr-генов можно использовать искусственно-полученные мутанты или даже природные варианты вируса с измененной вирулентностью.
У клеточных организмов для идентификации avr-генов используют транспозонный мутагенез. Транспозоны (tn) или инсерционные последовательности (is) представляют собой участки ДНК с повторяющимися последовательностями оснований на концах. Благодаря такой структуре они могут встраиваться в разные участки цепочки ДНК, при этом ген, в который внедрился транспозон, может быть полностью или частично инактивирован. Среди трансформированных транспозоном клеток отбирают по реакции на заражение клетки с измененной вирулентностью, выделяют из них ДНК и гибридизацией с транспозоном (зондом) определяют участок ДНК, ответственный за вирулентность.
Трансформация гена вирулентности из одних штаммов в другие. Для ее проведения необходимо: 1) с помощью ферментов, разрезающих молекулу ДНК (рестриктаз), разбить геном паразита на отдельные фрагменты; 2) клонировать их в модельном организме (кишечной палочке), создав библиотеку генов; 3) соединить их с вектором, в который встроен маркерный ген (устойчивости к антибиотику, прототрофности), необходимый для отбора трансформированных клеток; 4) обработать вектором протопласты реципиентного штамма и по маркерному гену отобрать трансформированные клетки; 5) по изменению реакции растения на заражение отобрать клон, в который встроен участок ДНК, отвечающий за специфическую патогенность (табл. 7.3). Если специфичность обусловлена индукцией устойчивости (специфическая индукция), то реакция сорта А на заражение трансформированной расой b изменится с восприимчивой на устойчивую, а сорт В сохранит реакцию устойчивости (1-й вариант). Если же специфичность обусловлена супрессией устойчивости, то, наоборот, реакция сорта В изменится с устойчивости на восприимчивость, а сорт А останется восприимчивым (2-й вариант).
Сложность данной методики обусловлена необходимостью отбора среди большого числа фрагментов ДНК из библиотеки генов фрагмента, связанного со специфической вирулентностью. Вопрос можно сформулировать так: сколько трансформантов надо проверить на растении, чтобы с высокой степенью вероятности среди них был обнаружен искомый? Число трансформантов можно установить с помощью следующего уравнения:
N = ln (1 - P) / ln (1 - f),
где P — вероятность присутствия гена, a f — часть генома, представленная в одном клоне. Например, если размер генома бактерий из рода Erwinia составляет 4,5 х 10в6 пар нуклеотидов (нп), а средний размер клонированных фрагментов — около 15 тысяч пар (тнп), то с вероятностью P = 0,99 искомый ген может быть обнаружен в одном из 1500 трансформантов. Следовательно, необходимо по маркерному гену отобрать более 1500 трансформированных клонов, в которые встроен вектор, и каждым клоном индивидуально заразить растение-хозяина, чтобы выделить клон с измененной вирулентностью. Для облегчения работы рекомендуют а) использовать крупнощепящие рестриктазы, разбивающие молекулы ДНК на большие фрагменты; б) в качестве вектора использовать конструкции, способные нести крупные фрагменты ДНК (космиды, ДНК фага λ).
Методы слепого многоступенчатого отбора случайных мутаций чрезвычайно длительны и могут занимать целые годы. Для возникновения мутаций интересующий ген должен удвоиться 106 – 108 раз. Несмотря на трудоемкость методов селекции, они не потеряли своего значения для создания высокоэффективных микроорганизмов – продуцентов.Многолетняя селекция штаммов-продуцентов пенициллина позволила увеличить удельную активность антибиотика в культуральной среде в 400 раз, а штаммов бактерий, синтезирующих кобаламин, – в 10 раз.
Более эффективен метод индуцированного мутагенеза (искусственного повреждения генома), основанный на использовании мутагенного действия ряда химических соединений (гидроксиламин, нитрозамины, азотистая кислота, бромурацил, алкилирующие агенты и др.), рентгеновских и ультрафиолетовых лучей. Мутагены вызывают замены и делеции оснований в составе ДНК, а также индуцируют мутации, приводящие к сдвигу рамки считывания информации.









