Кафедра ветеринарной санитарии
Туякова Р.К.
Ермагамбетова А.Т.
МИКРОБИОЛОГИЯ И ВИРУСОЛОГИЯ
Учебно-методическое пособие
Для выполнения лабораторных занятий по частной
Микробиологии и вирусологии
Костанай, 2011г
ББК 48.4
Т 92
Авторы:
Туякова Рауза Какеновна, кандидат ветеринарных наук, доцент
Ермагамбетова Анара Тулегеновна, магистр ветеринарных наук, преподаватель
Рецензенты:
Коканов Сабит Кабдешевич, кандидат ветеринарных наук, директор ИНОЦ КГУ им. Ахмета Байтурсынова;
Чужебаева Гульжан Джамбуловна, кандидат ветеринарных наук, старший научный сотрудник ИНОЦ КГУ им. Ахмета Байтурсынова;
Казкенов Калкаман Кайрошевич, кандидат ветеринарных наук, зав. отделом КОФ ГУ «Республиканская ветеринарная лаборатория».
Туякова Р.К., Ермагамбетова А.Т.
Т 92 Микробиология и вирусология. Методическое пособие - Костанай: КГУ им. А.Байтурсынова, 2011 г. – 100 с.
В методическом пособии дано описание возбудителей инфекционных болезней сельскохозяйственных животных. Здесь представлена лабораторная диагностика и методы идентификации микробов. Методические указания включают в себя следующий набор разделов: название темы, цель занятия, материалы и оборудование, содержание, задания и вопросы для самопроверки.
Методическое пособие предназначено для студентов специальностей 5В120200 - Ветеринарная санитария, 5В120100 - Ветеринарная медицина, 050701 - Биотехнология.
Утверждено Учебно-методическим советом Костанайского государственного университета им. А.Байтурсынова, протокол от _____ _____________ 20____г. № ____.
© Костнайский государственный
университет им. А.Байтурсынова, 2011
Содержание
Введение...............................................................................................................4
Раздел 1 Частная микробиология...................................................................5
1.1 Патогенные стафилококки……………………..…......................................5
1.2 Патогенные стрептококки - возбудители мастита коров, мыта и
пневмонии (септицемии) молодняка....………….......................................9
1.3 Возбудитель рожи свиней……………………………...................…........13
1.4 Возбудитель листериоза..............................................................................17
1.5 Возбудитсль эшерихиозов. Колибактериоз................................................21
1.6 Возбудители пастереллеза и туляремии.....................................................25
1.7 Возбудитель бруцеллеза...............................................................................28
1.8 Возбудитель сибирской язвы..………….....................................................32
1.9 Патогенные анаэробы - возбудители злокачественного отека,
эмфизематозного карбункула………...........................................................36
1.10 Патогенные анаэробы - возбудители столбняка, ботулизма,
фузариобактериоза……...............................................................................41
1.11 Возбудители туберкулеза и паратуберкулеза............................................44
1.12 Возбудитель актиномикоза..........................................................................50
1.13 Возбудитель кампилобактериоза................................................................52
1.14 Возбудители лептоспироза..........................................................................55
1.15 Возбудители микозов...................................................................................58
1.16 Возбудители микотоксикозов.....................................................................62
Раздел 2 Частная вирусология.........................................................................66
2.1 Лабораторная диагностика оспенных инфекций........................................67
2.2 Лабораторная диагностика бешенства.........................................................68
2.3 Лабораторная диагностика ящура................................................................70
2.4 Лабораторная диагностика парагриппа-3 крупного рогатого скота......79
2.5 Дифференциальная диагностика вирусов болезни Ньюкасла и гриппа птиц (классической чумы птиц)....................................................................82
Раздел 3 Современные методы диагностики инфекционных болезней...85
3.1 Иммуноферментный анализ (ИФА).............................................................85
3.2 Полимеразная цепная реакция (ПЦР)..........................................................90
Список рекомендуемой литературы..….........................................................96
Приложение..........................................................................................................97
Введение
Последние годы характеризуются ускоренным развитием многих направлений общей и клинической микробиологии, что обусловлено, вероятно, как более адекватным пониманием нами роли микроорганизмов в развитии заболеваний, так и необходимостью ветеринарных врачей постоянно пользоваться информацией об этиологии заболеваний, свойствах возбудителей с целью успешного ведения и получения удовлетворительных конечных результатов химиотерапии или химиопрофилактики. Методическое пособие «Микробиология и вирусология» охватывает основные разделы данной проблемы - определение и классификацию, характеристику микроорганизмов, направления и методы лабораторной диагностики и идентификации микробов.
Цель преподавания дисциплины - дать студентам знания и практические навыки по частной микробиологии и вирусологии. Задачи дисциплины заключаются в изучении болезнетворных микробов - возбудителей инфекционных заболеваний животных и птиц (зоонозов) общих для человека и животных (зооантропонозов), методов лабораторной диагностики инфекционных болезней, изыскание биопрепаратов для специфической профилактики и лечения инфекционных заболеваний животных и птиц.
Приобретение знаний по частной микробиологии и вирусологии необходимо для того, чтобы диагностировать и профилактировать конкретные инфекционные болезни животных. Использовать знания в хирургической, акушерско-гинекологической практике, при организации ветеринарно-санитарной службы на мясокомбинатах, бойнях, в работе на предприятиях микробиологической промышленности, в лабораториях ветеринарно-санитарной экспертизы на рынках.
В последние десятилетия в фундаментальной и прикладной микробиологии накоплены новые научные факты, разработаны новые методы исследований. В связи с этим весьма важно, чтобы в обучении студентов ветеринарной микробиологии были даны достаточно полные знания как о биологии микроорганизмов, так и о методах их выделения из разнообразных материалов, идентификации, методах диагностики инфекционных заболеваний, а также интерпретации полученных данных.
Материал пособия дополняет и уточняет отдельные разделы учебников с учетом учебной программы.
Рис.1 Электронная микроскопия стафилококка
Стафилококки – широко распространенные в природе микроорганизмы шаровидной формы, большинство из них сапрофиты. По современной классификации известно уже 27 видов, при этом 14 видов обнаружены на коже и слизистых оболочках человека и животных. Большинство стафилококков абсолютно безвредны. Практический интерес представляют патогенные (гемолитические) кокки, и их дифференциация от
непатогенных видов стафилококков.
Стафилококкозы у животных (и человека) характеризуются многообразием клинических проявлений - абсцессы, флегмоны, фурункулы, маститы коров, эндометриты, пневмонии, менингиты, в ряде случаев пиемия и сепсис со смертельным исходом. Патогенные штаммы стафилококков могут быть причиной пищевых токсикоинфекций у людей. Они обитают на коже и слизистых оболочках дыхательных, пищеварительных и мочевыводящих путей. Сапрофитные стафилококки, обладающие гнилостными свойствами, вызывают порчу сырья и пищевых продуктов.
Инфекционные процессы, обусловленные стафилококками и стрептококками, как правило, сопровождаются образованием гноя, поэтому патогенные кокки иногда называют гноеродными.
К стафилококкам чувствительны лошади, крупный и мелкий рогатый скот, свиньи, утки, гуси, индейки, куры.
Материал для бак. исследования: Для правильного отбора патологического материала, направляемого в лабораторию с диагностической целью, всегда учитывают характер течения инфекционного процесса. Патологическим материалом при стафилококкозах является раневой экссудат, гной, содержимое язв, карбункулов, при мастите - пробы молока от коров. При открытых раневых поверхностях или обширных флегмонах раневой экссудат (отделение) берут стерильным ватным тампоном, свернутым на одном конце тонкой выструганной палочки. Другой конец палочки вмонтирован в ватную пробку и вставлен в пробирку. Пробирки с такими тампонами завертывают в бумагу по 10-15 штук и стерилизуют. При взятии пробы материала пробирку открывают, тампон вынимают (за палочку); пропитывают гноем и вновь вставляют в пробирку и упаковывают для отправки в лабораторию. Жидкий экссудат можно отсосать стерильной пипеткой или иглой со шприцом и слить в стерильную пробирку. Если абсцесс не вскрыт, скопившийся в нем экссудат (гной) берут асептически: поверхность абсцесса дезинфицируют, затем делают прокол с стерильной иглой на стерилизованном шприце и содержимое выливают в стерильную пробирку, закрывают пробкой, помещают в железный или деревянный футляр (пенал) для отправки в лабораторию. Материал, поступивший в лабораторию подвергают нескольким исследованиям.
СХЕМА ИССЛЕДОВАНИЯ включает: микроскопию препаратов-мазков, посев на питательные среды и выделение чистой культуры стафилококка, определение ее патогенности, антибиотикорезистентности и биопроба.
 Микроскопия. Предварительно делают посевы патологического материала на питательные среды, затем готовят мазки: на предметное стекло наносят каплю физиологического раствора и в нее вносят (растирают) бактериологической петлей каплю гноя. Мазки после высушивания на воздухе фиксируют, окрашивают по Граму, микроскопируют. Характерным для стафилококков является шаровидная форма клеток (диаметр 0,7—1,0 мкм), располагающихся обычно различными скоплениями. Но иногда в гное наряду со скоплениями кокков (в виде гроздьев) обнаруживают отдельные или парные клетки или короткие цепочки кокков по 2—4 клетки. Размеры кокков колеблются (сапрофиты значительно крупнее—2— 4 мкм). Стафилококки окрашиваются грамположительно, споры и капсулы не образуют, неподвижные. При микроскопии можно обнаружить как большие шаровидные L-формы, так и очень мелкие G-формы. Наблюдают их в мазках из культур стафилококков, подвергавшихся воздействию различных факторов (физических, химических, биологических). Если материал поступил от животных, больных ботриомикозом (обычно лошадей, редко крупного рогатого скота, свиней), то в слизисто-гнойном содержимом очагов обнаруживают зооглеи — зооглейные скопления кокков, окруженных общей гомогенной капсулой.
Микроскопия. Предварительно делают посевы патологического материала на питательные среды, затем готовят мазки: на предметное стекло наносят каплю физиологического раствора и в нее вносят (растирают) бактериологической петлей каплю гноя. Мазки после высушивания на воздухе фиксируют, окрашивают по Граму, микроскопируют. Характерным для стафилококков является шаровидная форма клеток (диаметр 0,7—1,0 мкм), располагающихся обычно различными скоплениями. Но иногда в гное наряду со скоплениями кокков (в виде гроздьев) обнаруживают отдельные или парные клетки или короткие цепочки кокков по 2—4 клетки. Размеры кокков колеблются (сапрофиты значительно крупнее—2— 4 мкм). Стафилококки окрашиваются грамположительно, споры и капсулы не образуют, неподвижные. При микроскопии можно обнаружить как большие шаровидные L-формы, так и очень мелкие G-формы. Наблюдают их в мазках из культур стафилококков, подвергавшихся воздействию различных факторов (физических, химических, биологических). Если материал поступил от животных, больных ботриомикозом (обычно лошадей, редко крупного рогатого скота, свиней), то в слизисто-гнойном содержимом очагов обнаруживают зооглеи — зооглейные скопления кокков, окруженных общей гомогенной капсулой.
Культивирование и культуральные свойства. Для выделения стафилококков из исследуемого материала пастеровской пипеткой насасывают небольшое количество гноя и по 1—2 капли наносят на питательные среды. Если гной густой, его разводят стерильным физ.раствором, затем засевают. Стафилококки к питательным средам неприхотливы, хорошо растут на общеупотребительных средах — МПБ, МПА, МПЖ, рН 7,2—7,4. Оптимальная температура роста 35-37°С, но могут расти в пределах 10-45°С. Аэробы, факультативные анаэробы. При исследовании патологического материала для посева необходимо пользоваться селективной средой — солевой кровяной МПА (МПА с 8—10 % NaCl и 5 % дефибринированной крови). Применение этой среды основано на способности стафилококка выдерживать высокие концентрации NaCl (до 16 %). Другие виды микроорганизмов в этих условиях не растут. Помимо селективной среды, используют МПА с кровью (в чашках Петри), молочно-солевой агар, МПА с добавлением 40% желчи. Чистую культуру стафилококка можно получить после посева исследуемого материала на 5%-ный кровяной агар.
Культуральные свойства характеризуются обильным помутнением МПБ и осадком. Возможно появление серовато-белого пристеночного кольца или пленки. На плотных средах (МПА) через 12—24 ч инкубирования в термостате вырастают круглые сочные непрозрачные колонии в диаметре 2—4 мм. Цвет их зависит от вида стафилококка и вырабатываемого им пигмента (буровато-белый, золотистый или кремовый, лимонно-желтый). На кровяном агаре большинство патогенных видов стафилококков образуют зону гемолиза вокруг колонии. Изолированную колонию с солевого или кровяного МПА пересевают в пробирки со скошенным МПА или в МПБ; выросшую чистую культуру идентифицируют. В МПЖ через 24-26 ч отмечается обильный рост по уколу и разжижение среды, которое затем увеличивается.
Ферментативные (биохимические) свойства стафилококков — их определение имеет особое диагностическое значение. Чистую культуру засевают в молоко, среды с углеводами, МПЖ (или свернутую лошадиную сыворотку). Стафилококки обладают протеолитическими свойствами: МПЖ (в пробирке столбиком) разжижается к пятому дню, также медленно разжижается свернутая кровяная сыворотка; молоко свертывается, затем образовавшийся сгусток казеина пептонизируется. Индол не образует. Восстанавливают нитраты в нитриты, продуцируют каталазу, уреазу. Из углеводов ферментируют (расщепляют) лактозу, глюкозу, глицерин, сахарозу, мальтозу, маннит. Ферментация маннита рассматривается как свойство патогенных видов стафилококков.
При определении патогенных стафилококков учитывают следующие биохимических свойств:
- определяют ДНК-азную активность (выявление фермента ДНК-азы);
- реакция плазмокоагуляции (обнаружение фермента коагулазы);
- продуцирование сероводорода - H2S;
- продуцирование аммиака;
- ферментация маннита;
- обладать потенциальной гемолитической активностью.
Определение продуцирования стафилококками фермента ДНК-азы. С этой целью применяют следующие компоненты: щелочной МПА (рН 8,4—8,6), раствор натриевой соли ДНК (в стерильной дистиллированной воде — 20 мг/1 мл воды) с добавлением нескольких капель 2 %-ного NaOH, хлористый кальций, 1 н. раствор соляной кислоты. Методика определения ДНК-азной активности следующая: к расплавленному охлажденному агару добавляют раствор натриевой соли ДНК (1—1,5 мг/мл), стерилизуют в водяной бане кипячением 30—40 минут. После охлаждения среды до 60°С к ней асептично добавляют хлористый кальций (0,8 мг/мл), разливают в чашки Петри по 10—15 мл. Когда агар застынет (уплотнится), его подсушивают в термостате, затем засевают на поверхность МПА легким прикосновением петли испытуемую культуру стафилококка, помещают в термостат на 18—20 часа (+37 °С). Получив рост колоний, в чашку вносят 4—5 мл соляной кислоты, которую сливают через 2—3 минут. Чашки просматривают, учитывают результат: просветленная зона вокруг колонии на мутном фоне среды свидетельствует о продуцировании ДНК-азы. Суть реакции в том, что ДНК под действием НСl выпадает в осадок. Продуцируемый патогенными стафилококками фермент ДНК-аза деполимеризует ДНК, и образование осадка не происходит.
Для обнаружения коагулазы (плазмокоагулазы) берут 8 мл крови из сердца кролика иглой, надетой на шприц, промытый 5 %-ным раствором лимоннокислого натрия. Содержимое шприца сливают в пробирку с 2 мл 5 %-ного раствора лимоннокислого натрия, осторожно перемешивают. Кролику подкожно вводят 8 мл стерильного физраствора. Пробирки с кровью выдерживают при 4°С для отстоя эритроцитов или цитратную кровь центрифугируют при 1500— 2000 об/мин. Надосадочная жидкость — плазма (срок годности при хранении в холодильнике 4—5 дней). Плазму разводят физраствором 1:5, разливают в пробирки по 0,5 мл, добавляют по 0,5 мл бульонной культуры стафилококка, встряхивают. Если культура выращена на плотных средах, плазму следует развести 1:10, разлить по пробиркам по 1 мл и в нее внести 1 каплю агаровой культуры. Пробирки встряхивают, ставят в термостат при +37 °С. Учитывают через 1, 2, 3 и 24 часа. Положительным результатом будет считаться образование желеобразного или плотного сгустка, что свидетельствует о продуцировании патогенным стафилококком фермента плазмокоагулазы, фактор патогенности у стафилококков.
Для дифференциации патогенных и непатогенных стафилококков используют специальную селективную среду. Тест основан на бактериостатическом действии кристаллвиолета: к 1 л 3,5 %-ного МПА добавляют 3,3 мл 0,1 %-ного кристаллвиолета и сразу разливают асептично в чашки Петри или в пробирки (скошенный агар). Растет патогенный стафилококк, колонии его фиолетового или оранжевого цвета. Непатогенные стафилококки не растут.
Скрытую (потенциальную) гемолитическую способность стафилококков выявляют на 5%-ном кровяном МПА. Для этого бактериологической петлей по диаметру чашки делают прямой полоской посев бета-гемолитического штамма стафилококка. Затем перпендикулярно этой полоске с двух сторон засевают по 4-5 испытуемых штаммов стафилококков. После суточного инкубирования некоторые негемолитические штаммы в непосредственной близости к высеянному бета-гемолитическому штамму стафилококка образуют зону четко выраженного гемолиза.
Для полной характеристики патогенных штаммов также определяют у них способность выделять экзотоксины.
Биопроба: Для выявления патогенности стафилококков применяют и биологическую пробу на лабораторных животных (кролики, котята, белые мыши). Патогенность стафилококков обусловлена продуцируемыми экзотоксинами различной токсической функции: гемотоксины (стафилолизины) - лизируют эритроциты (гемолиз); лейкоцидин — разрушает лейкоциты; и энтеротоксины – вызывают пищевые токсикозы человека. В лабораторной практике чаще определяют летальный токсин и некротоксин. Летальный токсин выявляют внутривенным введением кролику 0,75 мл на 1 кг массы фильтрата бульонной культуры. Некротоксин, содержащийся в фильтрате бульонной культуры, определяют также биопробой: кролику выбривают участок кожи и дезинфицируют, внутрикожно вводят 0,2 мл культуры (2 млрд микробных тел в 1 мл). Через 24 часа проявляется некротическая реакция (зона некроза развивается в течение 1—2 дней) и образуется инфильтрат. В отдельных случаях (при отравлениях) проверяют наличие стафилококкового энтеротоксина. С этой целью биологическую пробу осуществляют на котятах пероральным введением (с молоком) исследуемой культуры стафилококка.
Таким образом заключительный бактериологический диагноз основывается на учете описанных характерных морфологических, тинкториальных, культуральнно-биохимических и патогенных свойств выделенной из исследуемого патологического материала культуры стафилококка.
Для патогенных стафилококков характерны:
1) гемолиз, 2) ферментация маннита, 3) ДНК-азная активность,
4) рост в среде с добавлением кристаллвиолета, 5) реакция плазмокоагуляции,
6) некротизирующая способность, 7) наличие летального токсина.
Контрольные вопросы:
1. Общая характеристика стафилококковых инфекций.
2. Патологический материал, направляемый в лабораторию и схема бактериологического
исследования.
3. Морфология стафилококков.
4. Культуральные и ферментативные свойства патогенных стафилококков.
5. Методы определения патогенности стафилококков.
6. Методы определения отдельных факторов патогенности стафилококков.
Рис. 2 Стрептококк. Электронная микроскопия.
Стрептококки — в природе существуют патогенные и непатогенные стрептококки.Патогенные гемолитические стрептококки, как правило, вызывают инфекционные процессы, сопровождающиеся образованием гноя, поэтому их нередко называют гноеродными. Род стрептококков включает более 20 видов. Из патогенных чаще встречаются Str. pyogenes, Str. agalactiae, Str. equi, Str. pneumoniae. К непатогенным стрептококкам относятся молочнокислые и некоторые другие (Str. lactis, Str. cremoris, Str. salivaris и др.). Разные виды патогенных стрептококков при их росте на кровяном агаре проявляют неодинаковый тип гемолиза: ά-гемолиз — колонии зеленовато-серые, вокруг непрозрачная зеленая зона вследствие того, что гемоглобин переходит в метагемоглобин; β-гемолиз —вокруг колонии образуется прозрачная зона гемолиза. Непатогенные стрептококки (Str. anhaemolyticus) гемолитическими свойствами не обладают.
Рис. 4 Поражения при роже свиней:
1 – труп свиньи, павшей при остром течении болезни;
2 – труп свиньи, павшей при подостром течении
(крапивнице);
3 – прямоугольные,
ромбовидные эритематозные пятна при крапивнице (а – в начальной стадии, б – в стадии развития);
4 – некроз кожи у подсвинка при хроническом течении болезни;
5 – фибринозные наложения на клапанах сердца (бородавчатый эндокардит).
Возбудитель рожи свиней — Erysipelothrix rhusiopathiae вызывает инфекционную болезнь (зооантропоноз), которая характеризуется при остром течении явлениями септицемии и воспалительной эритемой (появление красных разлитых пятен на коже), а при хроническом — эндокардитом и артритами. Из сельскохозяйственных животных наиболее восприимчивы свиньи в возрасте от трех месяцев до 1 года, ягнята – старше 3-4 недель и реже другие виды. К возбудителю рожи свиней чувствительны также многие виды млекопитающих и птиц.
Источником возбудителя инфекции бывают многие виды домашних и диких животных: свиньи (в первую очередь), овцы, крупный рогатый скот, олени, грызуны, птицы, рыбы, моллюски, ракообразные. Больные животные выделяют возбудителя с мочой и испражнениями, загрязняя растения, почву и воду, поэтому между ними преобладает пищевой (алиментарный) путь заражения. Кроме того, возможен и трансмиссивный путь передачи возбудителя инфекции через различных клещей и насекомых через поврежденные кожные покровы и слизистые оболочки
Патологический материал. Для бактериологического исследования направляют труп животного целиком или паренхиматозные органы (сердце, печень, селезенка, почка), трубчатую кость; при подозрении на хроническое течение — сердце. Свежий материал посылают в нативном виде или его консервируют 30 %-ным водным раствором химически чистого глицерина. Трубчатую кость очищают от мягких тканей, обертывают марлей, пропитанной 2—3 %-ным раствором фенола.
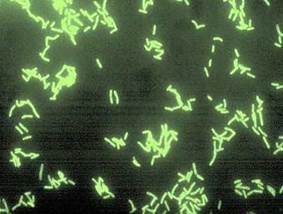

Рис. 5 Окраска люминесцентной сывороткой. Рис. 6 Окраска по Граму.
Микроскопия. Из патологического материала готовят мазки-отпечатки, окрашивают их по Граму и методом флуоресцирующих антител. В положительном случае в мазках, окрашенных по Граму, обнаруживают мелкие грамположительные палочковидные бактерии, располагающиеся одиночно, попарно или в виде скоплений, и длинные переплетающиеся нити в мазках из пораженных клапанов сердца. В препаратах, окрашенных флуоресцирующей сывороткой, положительным результатом считается обнаружение бактерий с типичной для возбудителя рожи свиней морфологией и специфическим (контурным) свечением с интенсивностью не ниже чем на три креста. При сомнительных или отрицательных результатах (слабое свечение, атипичная форма микроба, отсутствие свечения) проводят бактериологическое исследование, включающее выделение и идентификацию возбудителя, по общепринятой схеме. Возбудитель рожи свиней неподвижен, спор и капсулу не образует.
Культуральные свойства. Проводят посевы в МПБ или бульон Хоттингера, на МПА. Посевы инкубируют в термостате при +37 °С в течение 18— 24 часов, при отсутствии роста - еще 24 часа. Е. rhusiopathiae — аэроб, микроаэрофил (лучше растет при 5—10 % С02), температурный оптимум +37 °С, рН 7,2—7,6. На МПА возбудитель рожи образует мелкие прозрачный росинчатые колонии (S-формы), но встречаются и R-формы — крупные, с неровной волокнистой поверхностью, с отходящими от края корнеобразными отростками, обнаруживают их обычно при хроническом течении болезни. Посевы на МПА лучше просматривать под микроскопом или с помощью лупы. В мазках из колоний S-формы находят короткие прямые или слегка изогнутые стройные палочки, из колоний R-формы — цепочки или нити, часто грамотрицательные.
Чистую культуру пересевают на полужидкий 0,2%-ный агар (для определения подвижности макрометодом), мясопептонную желатину, пептонную воду с полоской реактивной бумаги (для изучения возможности возбудителя выделять сероводород), на среды Гисса с углеводами, на индикаторные среды, в две пробирки с мясопептонным бульоном для проб на образование каталазы
Биохимические свойства. Возбудитель рожи свиней выделяет сероводород, не образует каталазу, разлагает с образованием кислоты без газа глюкозу, лактозу, не разлагает сахарозу, маннит.
Серологическая идентификация. Применяют РА (пробирочный и микрометод). На предметное стекло наносят каплю иммунной противорожистой сыворотки в разведении 1:50, затем петлей в ней эмульгируют суточную агаровую культуру. Если выделенный микроб является возбудителем рожи свиней, происходит быстрая агглютинация с образованием плотных мелких комочков.
Обнаружение и идентификация возбудителя рожи свиней в чистых, смешанных культурах и патологическом материале определяют также с помощью люминесцирующей рожистой сыворотки, РНГА, РТГА..
Биопроба. Мышам массой 16—18 г подкожно вводят суспензию из паренхиматозных органов или смыв 1—2-суточной агаровой культуры в дозе 0,1—0,2 мл. Возбудитель рожи вызывает гибель животных через 2—4 суток. В более поздние сроки погибают животные, зараженные суспензией из материала от свиней-хроников или слабовирулентными культурами. Павших животных вскрывают и из их органов делают посевы в МПБ и на МПА с целью выделения чистой культуры.
Бактериологический диагноз на рожу свиней считают установленным в следующих случаях: 1) при обнаружении возбудителя рожи свиней МФА в исследуемом материале или в смешанной культуре без выделения чистой культуры; 2) при выделении из патологического материала культуры с характерными для возбудителя свойствами на питательных средах; 3) в случае гибели лабораторных животных и выделения из органов культуры возбудителя рожи, даже если в посевах из исходного материала возбудитель не выделен.
Общий диагноз ставится на основании:
- эпизоотологических данных (заболевание молодых свиней и поросят отъемного возраста, возникающее обычно в жаркое время года),
- клинических признаков (красные пятна на коже, имеющие форму различных геометрических фигур, высокая температура),
- данных вскрытия (катаральное и катарально-геморрагическое воспаление желудка и тонкого отдела кишечника, серозный перикардит, бородавчатый эндокардит, неравномерная окраска миокарда, венозный застой и кровоизлияния в почках)
Ø Лабораторных исследований:
- Бактериологическая диагностика
- Дифференциальная диагностика
- Серологическая диагностика
- Биопроба.
Срок лабораторного исследования, с целью постановки диагноза на рожу свиней, составляет 7 дней.
Рис.8 Жгутики у листерии. Рис.9 Окраска по Граму (эл. микроскопия).

Микроскопия. Мазки-отпечатки из органов, включая головной мозг, окрашивают по Граму и методом флуоресцирующих антител. В препаратах, окрашенных по Граму, листерии имеют вид грамположительных палочек, могут встречаться полиморфные клетки размером 0,5x2 мкм. Спор и капсул не образуют. Подвижны (6-12ч.культуры).
Обнаружение при люминесцентной микроскопии впатологическом материалеморфологически типичных для листерий бактерий, светящихся на 3—4 креста, позволяет поставить положительный люминесцентно-серологический диагноз.
Рис.10 Флюоресценция листерий в люминесцентном микроскопе.
При сомнительном или отрицательном результатах люминесцентной микроскопии проводят исследование материала с целью выделения культуры возбудителя.
Культивирование и культуральные свойства. L. monocytogenes — аэроб (факультативный анаэроб). Температурный оптимум +37 °С. Наиболее интенсивно бактерии развиваются при температуре 25-37ºС, но способны размножаться и при низких температурах: от 2°С до 4°С в почве, воде, на растениях, в органах трупов. В различных пищевых продуктах (молоко, мясо и др.) размножаются при температуре бытового холодильника. При этих условиях культивирования листерий дают хороший рост, хотя и замедленный в сравнении с выращиванием при 37°С. Верхняя температурная граница роста – 42-44°С.
При температуре 70°С погибают через 20-30 минут, при 100°С - через 3-5 минут; инактивируются растворами формалина (0,5%-1%), фенола (5%), хлорной извести (100 мг активного хлора в 1 л).
Listeria monocytogenes растет на многих питательных средах, основу которых составляет мясо-пептонный бульон, бульон Хоттингера, мясо-пептонный агар, картофельный агар, мозговой агар с добавлением глюкозы (0,5-1%), глицерина (2-3%), дрожжевого экстракта (10%), сыворотки крови (10%), сердечно-мозговой бульон, МПА с теллуритом калия и сывороткой крови, а также на некоторых синтетических средах. В настоящее время широко применяют новые среды для селективного обогащения и выделения листерий – Fraser бульон, Half - Fraser бульон, Oxford -, Palcam - агар и др.
 Из патологического материала делают обильные посевы на перечисленные среды. При исследовании абортированных плодов посевы производят из содержимого желудка и внутренних органов. Истечения из половых органов и молоко засевают на печеночный агар с добавлением 1 % глюкозы и 2—3 % глицерина из МПБ с 10 % NaCl.
Из патологического материала делают обильные посевы на перечисленные среды. При исследовании абортированных плодов посевы производят из содержимого желудка и внутренних органов. Истечения из половых органов и молоко засевают на печеночный агар с добавлением 1 % глюкозы и 2—3 % глицерина из МПБ с 10 % NaCl.
Рис.11 Рост листерий на Palcam – агаре
В последнем случае после появления роста из МПБ делают высев на плотные питательные среды. Наблюдение за посевами продолжают в течение 2 недель. Параллельно часть исследуемого материала рекомендуется выдерживать в холодильнике (+ 4°С) до 30 дней, поскольку при этой температуре происходят размножение и накопление листерий. При отрицательном результате первичного посева из сохраняемого материала каждые 10 дней производят повторные высевы на питательные среды. Данный методический прием позволяет увеличить количество положительных бактериологических находок, но исследование занимает длительный срок. Возбудитель листериоза в МПБ вызывает легкое помутнение бульона и формирует мелкие росинчатые колонии на МПА. На кровяном агаре растет, образуя зону α-гемолиза. Просмотр посевов на твердых средах лучше проводить в проходящем свете с осветителем ОИ-19 с голубым светофильтром. При этом колонии листерий, в отличие от колоний других микроорганизмов, имеют голубую окраску с зеленоватым оттенком и мелкозернистую структуру. На средах типа PALCAM-агара через 24ч. инкубирования листерии формируют мелкие, серовато-зеленые или оливково-зеленые колонии с черным ореолом, диаметром 0,5-1,0 мм, иногда с черным центром. Через 48ч. колонии диаметром 1,0-2,0 мм приобретают зеленую окраску с углубленными центрами, окруженными черным ореолом. Кокковая микрофлора (бактерии родов Staphylococcus, Enterococcus) образуют желтые колонии за счет ферментации маннита.
Из культур готовят мазки, окрашивают по Граму или флуоресцирующими сыворотками в прямом и непрямом вариантах. В мазках, окрашенных по Граму, и положительных случаях обнаруживают небольшие грамположительные палочковидные бактерии (0,5x1—2 мкм) с закругленными концами, располагающиеся одиночно, в виде римской пятерки, коротких цепочек или параллельно. Возбудитель спор и капсул не образует, подвижен. Подвижностью обладают листерий в молодой (6-12-ч.) бульонной культуре, выращенной при пониженной температуре (+20-22 °С).
Ферментативные свойства изучают у культур, имеющих типичную для листерий морфологию. Листерии относятся к группе сравнительно малоактивных в ферментативном отношении бактерий. Не образуют индол, аммиак, сероводород, не гидролизуют мочевину. Способны разлагать с образованием кислоты без газа глюкозу, салицин, рамнозу, мальтозу, при отсутствии разложения дульцита, инозита, инулина и арабинозы. Каталазную активность определяют добавлением свежеприготовленной 5 %-ной перекиси водорода к суточной бульонной культуре в равном объеме или нескольких капель в агаровую культуру. Образование пузырьков газа («пены») свидетельствует о наличии у культуры фермента каталазы, что характерно для листерий. Все виды Listeria обладают гемолитической и лецитиназной активностью. Для культур L. monocytogenes характерна вокруг места укола узкая зона гемолиза. Для окончательной идентификации патогенных листерий рекомендуется использовать КАМП-тест (метод Christie – Atkins – Munch – Peterson), ферментацию углеводов и определение активности на средах с углем и без него.
С целью дифференциации возбудителя листериоза от возбудителя рожи свиней используют также индикаторные среды с красителями. Метод основан на редукции и оксидации красок в средах под влиянием листерий, растущих на данных средах. Листерий обесцвечивают среду с лакмусом, нейтральротом в смеси с метиленовой синькой через 3—6 часов. Возбудитель рожи свиней не обесцвечивает сред с красителями.
Серологическую идентификацию проводят в пластинчатой РА на стекле. Для этой цели первоначально используют поливалентную листериозную сыворотку, агглютинирующую все сероварианты листерий. После идентификации на уровне вида ставят РА с серогрупповыми сыворотками, позволяющими отнести выделенную культуру листерий к определенному серотипу (серогруппе). В качестве антигена для пластинчатой РА с поливалентной сывороткой используют 24—30-часовую агаровую культуру, выращенную при +18—26 °С. При определении серотипа применяют в качестве антигена +18—24-часовую агаровую культуру, выращенную при +37 °С. Пластинчатую РА ставят по общепринятой методике, учет результатов осуществляют в течение 3 минут. Появление хлопьев в капле смеси антиген — сыворотка и отсутствие их в контроле (физраствор с антигеном) оценивают как положительный результат РА.
Биопроба. Суспензией из органов и тканей заражают подкожно или внутрибрюшинно в дозе 0,3—0,5 мл белых мышей массой 18 г или особо чувствительных 5—6-дневных мышат. Мышата погибают в положительных случаях через 18— 36 часов. За животными массой 16—18 г наблюдают в течение 14 суток. Из внутренних органов павших животных делают посевы на питательные среды и мазки-отпечатки.
Для дифференциации возбудителя листериоза от возбудителя рожи свиней прибегают к специальным тестам определения патогенности исследуемой культуры в виде конъюнктивальной и кожной пробы. Конъюнктивальную пробу ставят путем нанесения исследуемой суточной культуры на конъюнктиву глаза морской свинки. Листерии через 2—4 дня вызывают развитие гнойного конъюнктивита (и кератоконъюнктивита). Кожную пробу ставят введением 0,3— 0,5 мл суточной бульонной культуры внутрикожнно в область бока кролику или морской свинке. Листерии через 1—2 суток вызывают некроз кожи.
Серологическая диагностика. Используют РА и РСК. Результат РА признается положительным, если реакция оценивается не менее чем на два креста в разведении сыворотки: для овец, коз и свиней — 1:200, для лошадей и крупного рогатого скота — 1:400, для кроликов — 1: 50. Сомнительный результат — РА не менее чем два креста в разведении сыворотки овец, коз, свиней — 1:100, лошадей и крупного рогатого скота — 1: 200, В РСК сыворотки исследуют в разведении 1:10. Положительный результат — при оценке реакции в четыре креста и три креста (+++), сомнительный — при оценке ++ и +. От животных, давших сомнительный результат РСК, полагается повторно исследовать пробы крови через 2—3 недели. Серологическая диагностика является вспомогательной. Основное значение имеют данные ба





 Микроскопия. Предварительно делают посевы патологического материала на питательные среды, затем готовят мазки: на предметное стекло наносят каплю физиологического раствора и в нее вносят (растирают) бактериологической петлей каплю гноя. Мазки после высушивания на воздухе фиксируют, окрашивают по Граму, микроскопируют. Характерным для стафилококков является шаровидная форма клеток (диаметр 0,7—1,0 мкм), располагающихся обычно различными скоплениями. Но иногда в гное наряду со скоплениями кокков (в виде гроздьев) обнаруживают отдельные или парные клетки или короткие цепочки кокков по 2—4 клетки. Размеры кокков колеблются (сапрофиты значительно крупнее—2— 4 мкм). Стафилококки окрашиваются грамположительно, споры и капсулы не образуют, неподвижные. При микроскопии можно обнаружить как большие шаровидные L-формы, так и очень мелкие G-формы. Наблюдают их в мазках из культур стафилококков, подвергавшихся воздействию различных факторов (физических, химических, биологических). Если материал поступил от животных, больных ботриомикозом (обычно лошадей, редко крупного рогатого скота, свиней), то в слизисто-гнойном содержимом очагов обнаруживают зооглеи — зооглейные скопления кокков, окруженных общей гомогенной капсулой.
Микроскопия. Предварительно делают посевы патологического материала на питательные среды, затем готовят мазки: на предметное стекло наносят каплю физиологического раствора и в нее вносят (растирают) бактериологической петлей каплю гноя. Мазки после высушивания на воздухе фиксируют, окрашивают по Граму, микроскопируют. Характерным для стафилококков является шаровидная форма клеток (диаметр 0,7—1,0 мкм), располагающихся обычно различными скоплениями. Но иногда в гное наряду со скоплениями кокков (в виде гроздьев) обнаруживают отдельные или парные клетки или короткие цепочки кокков по 2—4 клетки. Размеры кокков колеблются (сапрофиты значительно крупнее—2— 4 мкм). Стафилококки окрашиваются грамположительно, споры и капсулы не образуют, неподвижные. При микроскопии можно обнаружить как большие шаровидные L-формы, так и очень мелкие G-формы. Наблюдают их в мазках из культур стафилококков, подвергавшихся воздействию различных факторов (физических, химических, биологических). Если материал поступил от животных, больных ботриомикозом (обычно лошадей, редко крупного рогатого скота, свиней), то в слизисто-гнойном содержимом очагов обнаруживают зооглеи — зооглейные скопления кокков, окруженных общей гомогенной капсулой.


 Из патологического материала делают обильные посевы на перечисленные среды. При исследовании абортированных плодов посевы производят из содержимого желудка и внутренних органов. Истечения из половых органов и молоко засевают на печеночный агар с добавлением 1 % глюкозы и 2—3 % глицерина из МПБ с 10 % NaCl.
Из патологического материала делают обильные посевы на перечисленные среды. При исследовании абортированных плодов посевы производят из содержимого желудка и внутренних органов. Истечения из половых органов и молоко засевают на печеночный агар с добавлением 1 % глюкозы и 2—3 % глицерина из МПБ с 10 % NaCl.


