Движение бактериальных жгутиков не зависит от АТФ, а осуществляется благодаря трансмембранному градиенту ионов водорода на поверхности плазматической мембраны. При этом происходит вращение М-диска.
В окружении М-диска Mot-белки способны к переносу ионов водорода из периплазматического пространства в цитоплазму (за один оборот переносится до 1000 ионов водорода). При этом происходит вращение жгутика с огромной скоростью, от 5-100 об/сек., что дает возможность бактериальной клетке перемещаться на 25-100 мкм в секунду.
http://www.studfiles.ru/preview/1823367/page:27/
Другая форма движения - скольжение по субстрату [цианобактерии, нек. Гр+ бактерии]. У этих организмов не найдено никаких спец. органелл движения.
АПОПТОЗ
Дословно - "опадение листьев"
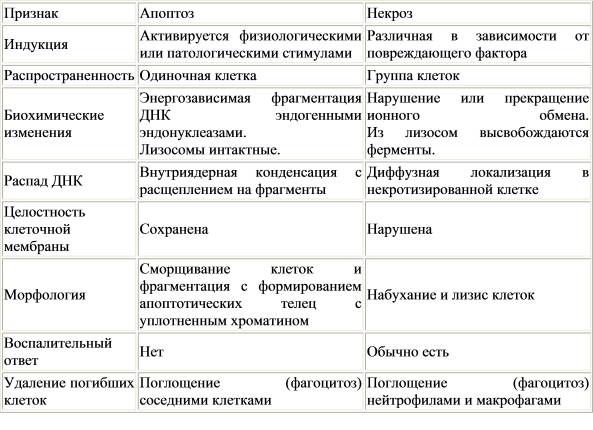
В организме выбраковываются клетки, дальнейшее существование которых было бы нежелательным, - программированная клеточная гибель (как правило, по механизму апоптоза). К примеру, в процессе развития конечностей у позвоночных в рез-те избирательной гибели клеток удаляются межпальцевые перегородки. Программированная гибель и апоптоз не тождественные понятия. Программированная гибель происходит в определённый момент развития, а апоптоз определяется особенностями морфологии клетки. При апоптозе клетка уплотняется, происходит вакуолизация ("пузырение") плазмалеммы - блэббинг????, ядро и сама клетка выглядят фрагментированными, хроматин конденсируется. Апоптоз может быть вызван различными стимулами: недостаток ростового фактора, действие глюкокортикоидов, повреждения ДНК под влиянием гамма-излучения или химиотерапевтических агентов, воздействие хим. соединений на цитоскелет и ЭПР, тепловой или холодовый шок и др. Абберантные (отклоняющиеся от нормы) клетки также элиминируются по принципу апоптоза. Аноиксис ("беспризорность") - смерть по принципу апоптоза клеток, открепившихся от субстрата. Апоптоз нужен для удаления опухолевых клеток. Активация апоптоза в неподходящий момент может привести к разрушению тканей и, как следствие, ишемическим повреждениям головного мозга, сердца и др. Цитотоксические лимфоциты иммунной системы атакуют клетки-мишени и запускают в них апоптоз.
Клетки могут погибать и путём некроза ("немой" гибели). В отличие от апоптических клеток, некротические набухают, не приводят к конденсации хроматина, развивается воспалительная реакция.
Каспазы - цистеин содержащие протеазы, регулирующие апоптоз путём разрушения специфических субстратов.
(Протеазы/протеиназы/протеолитические ферменты - гидролазы, расщепляющие пептидную связи между а/к в белках). В большинстве клеток млекопитающих каспазы находятся в виде неактивных зимогенов). Эффекторные каспазы - расщепление белков для осуществления апоптоза; активируются при расщеплении.
Инициаторные каспазы - активация эффекторных каспаз; активируются при димеризации.
Существуют также каспазы, участвующие в воспалении.
IAPs (Inhibitors of apoptosis proteins) блокируют действие каспаз.
Виды апоптоза:
· Некроптоз - программируемый некроз
· Клеточный каннибализм (энтоз и эмпериополез)
· Онкоз
· Аноиксис
· Митотическая катастрофа (чтобы не дали опухоль)
· Параптоз (гибель, сопровождающаяся активной вакуолизацией)
· Аутофагия, или аутофагическая гибель
· Пироптоз (с активным воспалением)
· Метуоз
Этапы апоптотической гибели:
· Индукция, или запуск программы апотоза;
· Активация проапоптотических белков;
· Каскад каспаз (цистеиновых протеаз), расщепляющих в конечном итоге белки-мишени;
· Разрушение внутриклеточных органелл или их перестройка;
· Фрагментация клетки на апототические тельца;
· Подготовка клетки и её фрагментов к фагоцитозу макрофагами или соседними клетками.
В запуске апоптоза участвуют различные органеллы: ПМ, мтх, ЭПР, АГ, лизосомы, ядро, центросомы, центриоли.
Каспазы - цистеин содержащие протеазы, регулирующие апоптоз путём разрушения специфических субстратов.
В настоящее время у человека известно 11 каспаз (каспазы -1-10 и каспаза-14), разделённых на группы на основании их а/к последовательностей. В целом каспазы можно разделить на воспалительные (каспазы-1, -4, -5)и апоптотические. Апоптотические каспазы подразделяют на эффекторные (каспазы-2, -8, -9, -10) и инициаторные (каспазы-3, -6, -7).
Эффекторные каспазы - расщепление белков для осуществления апоптоза; активируются при расщеплении.
Инициаторные каспазы - активация эффекторных каспаз; активируются при димеризации. В продомене инициаторных каспаз содержится последовательность CARD (caspase recruitment domain - inflammatory and initiator caspases) или DED (death effector domain - initiator caspases).
МЕХАНИЗМЫ АПОПТОЗА
· Рецепторный
Лиганды, запускающие апоптоз, относятся к цитокинам суперсемейства TNF (tumor necrosis factor) и взаимодействуют с рецепторами смерти TNF-R. Цитокины TNF (TNF-α, Fas-L, TRAIL, TWEAK, RANKL, APRIL, Lymphotoxin-a) являются мембранными и секретируемыми белками, могут специфически взаимодействовать с одним или несколькими рецепторами. Лиганды семейства TNF тримеризуются и связываются с тримером рецептора. При активации рецептора его внутриклеточный домен рекрутирует адапторные белки (в случае цитокина Fas - адапторные белки FADD/MORTI - Fas Associated Death Domain), которые взаимодействуют с иницаторными прокаспазами-8 или -10. Эти прокаспазы при олигомеризации созревают в активные каспазы, которые активируют эффекторные каспазы. Эффекторные каспазы разрушают белки-мишени.
· Митохондриальный
Ключевое событие - выход цитохрома с и ряда других белков в цитозоль в рез-те нарушения проницаемости митохондриальных мембран. Наряду с цитохромом c из межмбранного пространства митохондрий высвобождаются также вспомогательные белки Smac/DIABLO и сериновая протеиназа. Они связывают и инактивируют белки-ингибиторы апоптоза (IAPs - inhibitors of apoptosis proteins) и способствуют активации каспаз. Активность этих белков и различных активированных каспаз также приводит к протеолитическому расщеплению целого ряда белковых субстратов. Участие митохондрий в регуляции апоптотического каскада осуществляется с помощью белков семейства Bcl-2.
· Ядерный
Два пути:
- Активация транскрипционного фактора p53, который участвует в экспрессии апоптотических белков, таких, как Bax, Puma, Noxa. Эти белки включают митохондриальный механизм апоптоза и соответствующий ему каскад каспаз. Активацию фактора p53 могут вызывать различные виды радиаций (УФ, ионизирующая), температурный шок, гипоксия (пониженное содержание кислорода в организме или в отдельных органах и тканях).
- Активация каспазы-2 - наиболее эволюционно консервативной среди всех каспаз. По субстратной специфичности каспаза-2 сходна с эффекторными каспазами, но по ряду признаков является инициаторной, к примеру, активируется при димеризации.
Известно три подсемейства Bcl -2 белков, включающие антиапоптотические белки, проапоптотические "мультидоменные" белки (которые также обозначаются BH 1, -2, -3 белки, посколько содержат BH 1, -2, -3 домены) и проапототические BH 3 белки (содержащие только BH 3 домен). Антиапототические Bcl -2 белки содержат домен BH 4 и предотвращают повышение MOMP (MOMP — major outer membrane protein), в то время как проапоптотические Bcl -2 белки не содержат этот домен и повышают MOMP . Однако ингибирование повышения MOMP не связано просто с функционированием BH 4 домена.


http://www.rosoncoweb.ru/library/congress/ru/09/20.php
Аутофагическая гибель. В качестве второго типа программированной гибели клеток в настоящее время выделяют гибель клеток, при которой в клетки запускается программа аутофагии. Аутофагия – это деградация органелл и цитоплазматического материала, которая происходит при участии внутриклеточных мембранных структур. При аутофагии de novo формируются специализированные структуры – аутофагосомы. Это двухмембранные образования, внутри которых помещается клеточный материал (органелла или часть цитозоля), подлежащий разрушению. При слиянии аутофагосом с лизосомами образуются аутофаголизосомы, где и происходит расщепление подлежащих уничтожению компонентов клетки. Стимулами к запуску процессов аутофагии в клетках многоклеточных животных являются: 1) отсутствие факторов роста или нехватка питательных веществ; 2) наличие в цитоплазме поврежденных органелл, например, митохондрий, пероксисом и т.д.; 3) в клеточных культурах возникновение монослоя и существование контактного торможения. При нехватке питательных соединений клетка начинает утилизировать часть своих цитозольных белков и органелл с помощью аутофагии. В результате при расщеплении этих компонентов в лизосомах или вакуолях в клетке поддерживается необходимый уровень тех соединений, которые нужны ей для жизнедеятельности.
Аутофагический тип гибели называют также лизосомной клеточной смертью. Аутофагическая гибель отличается следующими признаками: 1) частичная конденсация хроматина; 2) иногда пикноз ядра; 3) отсутствие фрагментации ядра и клетки на поздних стадиях гибели; 4) отсутствие деградации ДНК до нуклеосомного уровня; 5) увеличение числа аутофагосом и аутофаголизосом; 6) увеличение лизосомной активности; 7) увеличение протяженности аппарата Гольджи и иногда расширение цистерн эндоплазматического ретикулума; 8) длительная сохранность микротрубочек и промежуточных филаментов; 9) иногда возрастание проницаемости митохондрий; 10) отсутствие активации каспаз. В конечном итоге остается клеточный дебрис – остаток клетки, окруженный плазматической мембраной, который фагоцитируется макрофагами.
Митотическая катастрофа. Понятие «митотической катастрофа» было введено для обозначения гибели клеток, в которых проявлялись признаки патологии митоза. В последние годы дискутируется вопрос о том, что следует называть митотической катастрофой. Согласно одним представлениям, митотическая катастрофа - это реализация апоптотической программы собственно в процессе митоза (Castedo et al., 2004). При этом сегрегация хромосом отсутствует, и клетка блокируется в одной из фаз митоза. Как правило, блок происходит в так называемом К-митозе (колхицино-подобном митозе), когда в митотической клетке нарушены организация веретена и выстраивание хромосом в виде метафазной пластинки. Далее происходит активация каспаз и последующие деструктивные события по типу апоптотических. Митохондриальный путь активации программы апоптоза считают преобладающим при гибели клеток собственно в митозе. Завершается апоптоз образованием апоптотических телец и их фагоцитозом. Вторым подтипом митотической катастрофы является гибель клеток, перешедших после аномального митоза в следующую G1-фазу без нормальной сегрегации хромосом и образования дочерних клеток (Roninson et al., 2001), т.е. постмитотическая гибель полиплоидных клеток. При общей эуплоидности полиплоидной клетки ее отдельные ядра являются в основном анеуплоидными. Данный подтип митотической катастрофы может быть назван апоптозом клетки, прошедшей полиплоидизирующий митоз.
Причиной митотической катастрофы считают нарушение процессов контроля в клетках, в которых могли произойти повреждения ДНК или нарушения сборки веретена (Castedo et al., 2004). Ключевым моментом в блокировании клеточного цикла и в индукции в этих клетках апоптоза является экспрессия р53, который служит фактором транскрипции для р21 – ингибитора G1–фазы клеточного цикла и для ряда проапоптотических белков.
Митотическая катастрофа принципиально отличается от апоптоза одноядерных клеток и аутофагической гибели тем, что нарушение ее программы может существенно повлиять на хромосомный состав клеток. Если в тетраплоидной клетке, возникшей в результате нарушения сегрегации хромосом, неактивны механизмы, ведущие к апоптозу или действующие в пункте проверки G1–фазы, то такая клетка может пройти очередной клеточный цикл и митоз. Как известно, деление полиплоидных клеток часто сопровождается многополюсностью веретена, в результате чего после сегрегации хромосом могут возникать анеуплоидные клетки. Анеуплоидия может вести в свою очередь к отсутствию пунктов контроля пролиферации и нарушению механизмов гибели клеток. Клоны потомков таких клеток могут служить основой для трансформации клеток и роста опухолей (Castedo et al., 2004). Недавно появились данные о том, что изменение хромосомного состава диплоидных клеток действительно может влиять на их способность вступать в апоптоз. Обнаружено, что если сестринские клетки, образовавшиеся в результате многополюсного митоза и являющиеся анеуплоидными, подвергнуть апоптотическому воздействию, погибает лишь часть таких клеток. Другие же сестринские клетки остаются жизнеспособными (Александрова, Онищенко, 2004). Пока остается неясным, как долго эти клетки продолжают жить. Но такие жизнеспособные анеуплоидные клетки можно, безусловно, рассматривать в качестве одного из этапов озлокачествления опухолей. Таким образом, преодоление именно митотического пункта проверки без нормализации состояния клетки (например, формирование многополюсного, а не биполярного веретена, образование микроядер) может быть источником клонов клеток, генетический состав которых, а значит, и их свойства, резко отличаются от исходных родительских клеток.
Длительное время некроз рассматривали лишь как вариант неспецифической гибели клетки. Фактической причиной гибели при некрозе считают резкое падение содержания АТФ в клетках до такого уровня, который не совместим с жизнью (Fiers et al., 1999; Edinger, Thompson, 2004). «Энергетическая катастрофа» может быть вызвана, например, токсинами или физическими повреждениями. Морфологическими признаками некроза является набухание клеток и их мембранных органелл, неспецифическая компактизация хроматина, вакуолизация цитоплазмы, нарушение целостности плазматической мембраны и выход содержимого клеток во внеклеточное пространство. В итоге в многоклеточном организме в области некроза развивается воспалительная реакция.
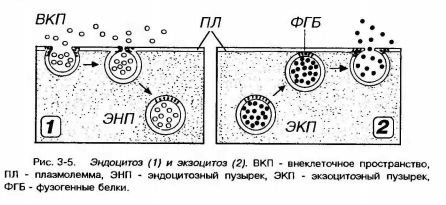
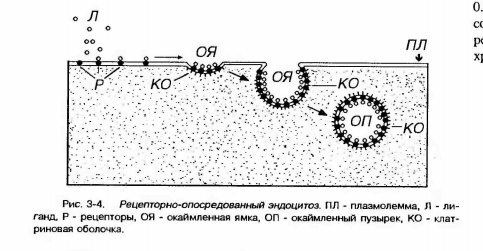
ТРАНСЦИТОЗ





РЕПЛИКАЦИЯ ДНК
В основе репликации и репарации ДНК лежит принцип комплементарности оснований.
Первый фермент, полимеризующий нуклеотиды, - ДНК-полимераза. Свободные нуклеотиды, служащие субстратом для ДНК-полимеразы - дезоксирибонуклеозидтрифосфаты + необходима одноцепочная матрица ДНК.
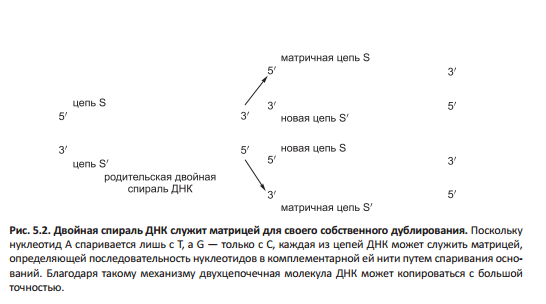
ДНК реплицируется ДНК-полимеразой полуконсервативно.
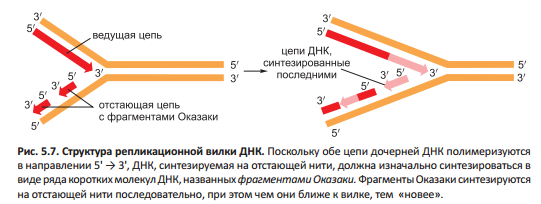
Ограниченная зона репликации имеет Y-образную форму и называется репликационной (репликативной) вилкой. ДНК-полимеразы могут осуществлять синтез в направлении 5'-->3', иначе, в силу антипараллельной ориентации двух цепей ДНК потребовалось бы два разных типа ДНК-полимеразы. Однако цепь ДНК наращивается в направлении 3'-->5'. Фрагменты Оказаки полимеризуются только в направлении цепи 5' → 3'и присоединяются друг к другу после их синтеза с образованием длинных цепей ДНК.
Репликационная вилка асимметрична: ведущая (лидирующая, опережающая) цепь дочерней ДНК синтезируется непрерывно, опережает синтез отстающей (запаздывающей) цепи, синтезируемой с перерывами. В отстающей нити полимеризация нуклеотидов идет в направлении, встречном общему наращиванию цепи ДНК. Синтез этой нити прерывистым механизмом «обратных стежков» означает, что для репликации ДНК необходима лишь ДНК-полимераза типа 5'-->3'.
Точность копирования ДНК в ходе репликации такова, что на каждые 109 скопированных нуклео- тидов возникает не более 1 ошибки. Комплементарные пары оснований не единственно возможные. К примеру, между G и T в ДНК могут образовываться две водородные связи, немного изменяя геометрию спирали. Кроме того, кратковременно возникают таутомерные формы, ошибочно образующие пару, не нарушая при этом геометрию спирали (к примеру, таутомерная С спаривается не с G, а с А).
ДНК-полимераза препятствует возникновению мутаций. Нужный нуклеотид имеет большее сродство к электрону, чем ошибочный (это благоприятней в энергетическом отношении). К тому же, перед присоединением нуклеотида к наращиваемой цепи полимераза осуществляет "двойную проверку" точной геометрии пар оснований ("пальцами", сжимаемыми вокруг активного участка).
Если неверный нуклеотид всё же присоединился к растущей цепи, действует экзонуклеолитическая коррекция. Молекулы ДНК, несущие на своём 3'OH-конце затравочной цепи (праймера) некомплементарные нуклеотиды, неэффективны в качестве матрицы, т.к. их не может продолжить полимераза. Корректирующая экзонуклеаза 3'-->5' удаляет с конца затравки неспаренные нуклеотиды. Таким образом, ДНК-полимераза как бы устраняет свои собственные ошибки. А ферменты РНК-полимеразы не нуждаются в экзонуклеотической коррекции, т.к. их ошибки не передаются следующему поколению. К тому же, РНК-полимеразы работают без затравки.
Фермент ДНК-праймаза использует дезоксирибонуклеозидтрифосфаты для синтеза коротких РНК-затравок на отстающей нити. Синтез каждого фрагмента Оказаки заканчивается, когда ДНК-полимераза натыкается на РНК-затравку на 5'-конце предудыщего фрагмента. Как на отстающей нити собрать из фрагментов непрерывную цепь ДНК? Для этого приходит специальная система репарации ДНК, которые вычищает РНК-заправку, заменяя её на фрагменты ДНК. Затем фермент ДНК-лигаза сводит воедино 3'-концы фрагментов ДНК с предыдущими 5'-концами. Так почему же РНК-затравки предпочтительнее ДНК-затравок, которые не пришлось бы удалять? Чтобы происходило меньше ошибок, которые бы привели к мутациям. А вот рибонуклеотиды в затравке автоматически помечаются как "подозрительные копии", чтобы их эффективно удалить и заменить.
Двойная спираль ДНК очень устойчива в физиологических условиях. Чтобы разделить две комплементарные цепи ДНК in vitro, нужны температуры, близкие к температуре кипения воды. Поэтому, чтобы спираль раскрылась в естественных условиях, нужны особе белки: ДНК-хеликазы и белки, связывающие одноцепочечную ДНК.
ДНК-хеликазы гидролизуют ATP при связывании с одноцепочечными ДНК. Гидролиз ATP циклически изменяет форму молекулы белка. ДНК-хеликазы двигаются по одинарной цепи ДНК и, сталкиваясь с двойной спиралью, продолжают своё движения по одинарной цепи, расклинивая спираль со скоростью до 1000 пар нуклеотидов в секунду.
Белки, связывающие одноцепочечную ДНК, или дестабилизирующие спираль белки - SSB -белки ( single - strand DNA - binding proteins ). Содествуют ДНК-хеликазам, стабилизируя конформацию одинарной цепи ДНК, распрямляют её, препятствуя образованию коротких двуспиральных шпилек, которые бы помешали синтезу ДНК.
ТРАНСЦИТОЗ







РЕПЛИКАЦИЯ ДНК
В основе репликации и репарации ДНК лежит принцип комплементарности оснований.
Первый фермент, полимеризующий нуклеотиды, - ДНК-полимераза. Свободные нуклеотиды, служащие субстратом для ДНК-полимеразы - дезоксирибонуклеозидтрифосфаты + необходима одноцепочная матрица ДНК.

ДНК реплицируется ДНК-полимеразой полуконсервативно.
Ограниченная зона репликации имеет Y-образную форму и называется репликационной (репликативной) вилкой. ДНК-полимеразы могут осуществлять синтез в направлении 5'-->3', иначе, в силу антипараллельной ориентации двух цепей ДНК потребовалось бы два разных типа ДНК-полимеразы. Однако цепь ДНК наращивается в направлении 3'-->5'. Фрагменты Оказаки полимеризуются только в направлении цепи 5' → 3'и присоединяются друг к другу после их синтеза с образованием длинных цепей ДНК.
Репликационная вилка асимметрична: ведущая (лидирующая, опережающая) цепь дочерней ДНК синтезируется непрерывно, опережает синтез отстающей (запаздывающей) цепи, синтезируемой с перерывами. В отстающей нити полимеризация нуклеотидов идет в направлении, встречном общему наращиванию цепи ДНК. Синтез этой нити прерывистым механизмом «обратных стежков» означает, что для репликации ДНК необходима лишь ДНК-полимераза типа 5'-->3'.

Точность копирования ДНК в ходе репликации такова, что на каждые 109 скопированных нуклео- тидов возникает не более 1 ошибки. Комплементарные пары оснований не единственно возможные. К примеру, между G и T в ДНК могут образовываться две водородные связи, немного изменяя геометрию спирали. Кроме того, кратковременно возникают таутомерные формы, ошибочно образующие пару, не нарушая при этом геометрию спирали (к примеру, таутомерная С спаривается не с G, а с А).
ДНК-полимераза препятствует возникновению мутаций. Нужный нуклеотид имеет большее сродство к электрону, чем ошибочный (это благоприятней в энергетическом отношении). К тому же, перед присоединением нуклеотида к наращиваемой цепи полимераза осуществляет "двойную проверку" точной геометрии пар оснований ("пальцами", сжимаемыми вокруг активного участка).
Если неверный нуклеотид всё же присоединился к растущей цепи, действует экзонуклеолитическая коррекция. Молекулы ДНК, несущие на своём 3'OH-конце затравочной цепи (праймера) некомплементарные нуклеотиды, неэффективны в качестве матрицы, т.к. их не может продолжить полимераза. Корректирующая экзонуклеаза 3'-->5' удаляет с конца затравки неспаренные нуклеотиды. Таким образом, ДНК-полимераза как бы устраняет свои собственные ошибки. А ферменты РНК-полимеразы не нуждаются в экзонуклеотической коррекции, т.к. их ошибки не передаются следующему поколению. К тому же, РНК-полимеразы работают без затравки.
Фермент ДНК-праймаза использует дезоксирибонуклеозидтрифосфаты для синтеза коротких РНК-затравок на отстающей нити. Синтез каждого фрагмента Оказаки заканчивается, когда ДНК-полимераза натыкается на РНК-затравку на 5'-конце предудыщего фрагмента. Как на отстающей нити собрать из фрагментов непрерывную цепь ДНК? Для этого приходит специальная система репарации ДНК, которые вычищает РНК-заправку, заменяя её на фрагменты ДНК. Затем фермент ДНК-лигаза сводит воедино 3'-концы фрагментов ДНК с предыдущими 5'-концами. Так почему же РНК-затравки предпочтительнее ДНК-затравок, которые не пришлось бы удалять? Чтобы происходило меньше ошибок, которые бы привели к мутациям. Рибонуклеотиды в затравке автоматически помечаются как "подозрительные копии", чтобы их эффективно удалить и заменить.
Двойная спираль ДНК очень устойчива в физиологических условиях. Чтобы разделить две комплементарные цепи ДНК in vitro, нужны температуры, близкие к температуре кипения воды. Поэтому, чтобы спираль раскрылась в естественных условиях, нужны особые белки: ДНК-хеликазы и белки, связывающие одноцепочечную ДНК.
ДНК-хеликазы гидролизуют ATP при связывании с одноцепочечными ДНК. Гидролиз ATP циклически изменяет форму молекулы белка. ДНК-хеликазы двигаются по одинарной цепи ДНК и, сталкиваясь с двойной спиралью, продолжают своё движение по одинарной цепи, расклинивая спираль со скоростью до 1000 пар нуклеотидов в секунду.
Белки, связывающие одноцепочечную ДНК, или дестабилизирующие спираль белки - SSB -белки ( single - strand DNA - binding proteins ). Содействуют ДНК-хеликазам, стабилизируя конформацию одинарной цепи ДНК, распрямляют её, препятствуя образованию коротких двуспиральных шпилек, которые бы помешали синтезу ДНК.
Спутывание ДНК во время репликации предотвращают ДНК-топоизомеразы. Они как нуклеазы соединяются с фосфатом основной цепи ДНК и таким образом разрывают фосфодиэфирную связь в нити ДНК. Топоизомераза I производит временный однонитевой разрез или надрез. Топоизомераза II производит временный двухцепочечный разрыв в спирали.
Заключение
Процесс репликации ДНК начинается специальными инициаторными белками ( initiator proteins ), которые связываются с двухцепочечной ДНК и расклинивают две нити, разывая между основаниями водородные связи.
Спираль ДНК изначально раскрывается в точках начала репликации ( replication origin ).

У БАКТЕРИЙ


ХЛОРОПЛАСТЫ И МИТОХОНДРИИ
Прокариоты используют для синтеза АТР (АТФ) свою плазматическую мембрану. Но плазматическая мембрана эукариотических клеток зарезервирована для транспортных процессов. Вместо этого, эукариоты используют для синтеза большей части АТР специализированные мембраны внутри энергопреобразующих органелл: митохондрий и пластид (в основном хлоропластов). Общим в их строении является то, что они отделены от гиалоплазмы двумя мембранами - внешней и внутренней. Поэтому у митохондрий и пластид различают две полости или пространства: одну между внешней и внутренней мембранами (межмембранные) и другую, основную (матрикс), ограниченную снаружи внутренней мембраной. Другой общей чертой является то, что внутренняя мембрана образует складки, мешки, гребни, глубокие впячивания, направленные внутрь матрикса. На таких мембранных гребнях и впячиваниях локализуются активные метаболические центры этих органелл - полиферментные комплексы, определяющие выполнение основных физиологических функций: окислительное фосфорилирование для митохондрий и фотофосфорилирование для хлоропластов. Общий процесс получения энергии для биологических нужд, используемый митохондриями, хлоропластами и прокариотами, называется хемиосмотическим сопряжением. Такое название отражает связь между химическими реакциями образования связей, в результате которых синтезируется АТР ("хеми"), и мембранотранспортными процессами ("осмо"). Процесс хемиосмотического сопряжения происходит в две связанные между собой стадии, в каждой из которых принимают участие встроенные в мембрану белковые комплексы:
Стадия 1. Высокоэнергические электроны (возникшие в результате окисления молекул пищи, действия солнечного света и т.д.) путешествуют по цепи электронных переносчиков, встроенных в мембрану. В результате переноса электронов высвобождается энергия, используемая для перекачки протонов (Н+, полученных из воды, содержащейся в клетках в избытке) через мембрану и создания электрохимического протонного градиента. Ионный градиент - одна из форм запасания энергии, которую можно использовать для совершения полезной работы при переносе ионов обратно через мембрану по электрохимическому градиенту.
Стадия 2. Н+ движутся по своему электрохимическому градиенту через интегральный белок внутренней мембраны - АТР-синтазу, катализирующую требущий затрат энергии синтез АТР из ADP и неорганического фосфата (Рi).
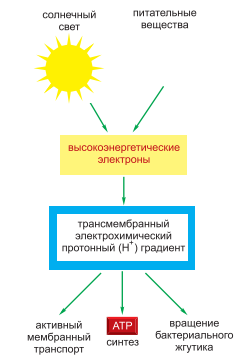
Весь набор белков мембраны и малых молекул, участвующих в переносе электронов, называется электрон-транспортной цепью.

Митохондрии
(((((((Деградация молекулы углевода до CO2 --> высвобождение электронов --> перенос электронов через мембрану путём электронных переносчиком, восстановление газообразного O2 до воды.

(Видимо, так: O2 (c.о. 0)+2H++2e=H2O) ))))))))))
Деградация молекулы углевода до CO2 --> высвобождение электронов --> перемещение электронов через мембрану посредством электронных переносчиков --> высобождение энергии --> работа трёх H+-насосов на внутренней мембране митохондрий --> третий насос катализирует перенос электронов к O2 --> восстановление газообразного O2 до воды.
Хлоропласты можно описать сходным образом, но их белки несколько отличаются от митохондриальных, а также присуствуют фотосисистемы, в которых зелёный пигмент хлорофилл использует энергию солнечного света для переноса электронов. Движущая электроны система как бы направлена в противоположную сторону по сравнению с митохондриями:
Захват электронов из воды --> выделение O2 --> электроны отдаются на CO2 посредством NADPH--> синтез углеводов.
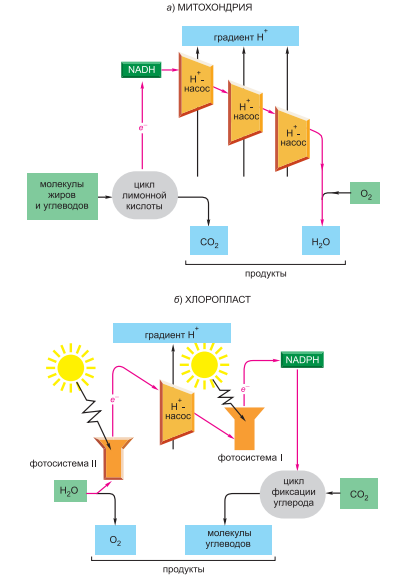
МИТОХОНДРИИ, №48, 49
Митохондрии как непосредственно органеллы синтеза АТР характерны почти для всех эукариотических клеток как аутотрофных (фотосинтезирующие растения), так и гетеротрофных (животные, грибы) организмов. Их основная функция связана с окислением органических соединений и использованием освобождающейся при распаде этих соединений энергии, при синтезе АТР. Поэтому митохондрии часто называют энергетическими станциями клетки.
Общая морфология. Митохондрии представляют собой гранулярные или нитевидные органоиды, присутствующие в цитоплазме простейших, растений и животных. Митохондрии можно наблюдать в живых клетках, т.к. они обладают достаточно высокой плотностью. В живых клетках митохондрии могут двигаться, перемещаться, сливаться друг с другом. Особенно хорошо митохондрии выявляются на препаратах, окрашенных различными способами осмиевой фиксации, которая хорошо стабилизирует липиды. Наиболее распространённый метод окраски - по Альтману, который описал в конце митохондрии в конце XIX века, назвав их "биобластами".
Размеры и форма митохондрий непостоянны, однако у большинства клеток толщина митохондрий относительно постоянна (около 0,5 мкм), а длина колеблется, достигая у нитчатых форм до 7-10 мкм. Измерить длину митохондрии непросто: в световом микроскопе на окрашенных препаратах не всегда можно проследить за реальными размерами митохондрий, а в электронном микроскопе на ультратонкий срез попадает лишь небольшой объём митохондрии. К тому же, выделенные митохондрии обычно повреждаются и фрагментируются. Подсчитанное число митохондрий нужно считать завышенным из-за сложности структуры разветвлённых митохондрий. Более того, появились представления о том, что, может быть, в любой клетке есть всего одна митохондрия, но сильно разветвлённая (как у трипанозом).
В последнее время стал широко применяться для изучения свойств митохондрий флуорохром родамин, обладающий способностью люминесцировать в фиолетовом свете, если он связывается с мембранами активных митохондрий. При этом в люминесцентном микроскопе видна единая митохондриальная система - митохондриальный ретикулум. Обычные же подсчёты показывают, что на печёночную клетку приходится около 1000 митохондрий, а больше всего митохондрий в ооцитах (300 тыс.) и у гигантской амёбы Chaos Chaos (до 500 тыс.).В клетках зелёных растений митохондрий меньше, чем в клетках животных, потому что часть их функций могут выполнять хлоропласты. Отсутствуют митохондрии у анаэробных кишечных энтамёб и у некоторых других паразитических простейших.
Локализация митохондрий обусловлена расположением цитоплазматических структур и включений. К примеру, в дифференцированных клетках растений митохондрии большей частью расположены в периферических участках цитоплазмы, отодвинутых к плазматической мембране центральной вакуолью. Обычно митохондрии скапливаются вблизи тех участков цитоплазмы, где возникает потребность в АТР. Так, в скелетных мышцах - вблизи миофибрилл, в сперматозоидах - вокруг оси жгутика, у ресничных - у основания ресничек, в аксонах нервных клетках - около синапсов.
Ультраструктура митохондрий
И ТД!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
ФУНКЦИИ МИТОХОНДРИЙ
























