9. Стандартные теплоты образования и сгорания химических соединений. Их использование для расчета тепловых эффектов химических процессов. Как на основании экспериментальной величины стандартной теплоты сгорания какого-либо вещества рассчитать стандартную теплоту его образования? Какие дополнительные сведения необходимы для этого?
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 76 кДж/моль.
В литературе часто встречается другое обозначение стандартной энтальпии — ΔH298,150, где 0 указывает на равенство давления одной атмосфере (или, несколько более точно, на стандартные условия), а 298,15 — температура. Иногда индекс 0 используют для величин, относящихся к чистому веществу, оговаривая, что обозначать им стандартные термодинамические величины можно только тогда, когда в качестве стандартного состояния выбрано именно чистое вещество. Стандартным также может быть принято, например, состояние вещества в предельно разбавленном растворе.
Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв)0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж)0 = 22 кДж/моль. Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса):
ΔHреакцииO = ΣΔHfO (продукты) — ΣΔHfO (реагенты)
Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиеcя выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален.
Стандартная энтальпия сгорания — ΔHгоро, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
Известны теплоты образования самых разнообразных веществ из составляющих их элементов. Например:
CO2(г): 393,5 кДж/моль (из C и O2, энергия выделяется);
SiO2(тв): 859 кДж/моль (из Si и O2, энергия выделяется);
NaCl (тв): 411 кДж/моль (из моля Na и 0,5 моль Cl2, энергия выделяется) и т.д.
Опубликованы обширные таблицы теплот образования веществ. В чем же полезность этих величин? Дело в том, что теплоты образования веществ из элементов чрезвычайно удобны для расчета тепловых эффектов любых реакций, в которых эти вещества могли бы участвовать. Теплота любой реакции (даже пока не осуществленной на практике) может быть вычислена как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции.
Однако здесь необходимо строго соблюдать "правила игры", принятые в термохимии. Например, мы пишем: "C(тв)", но "твердый" углерод может быть как графитом, так и алмазом! В термохимических измерениях стандартным состоянием углерода считается графит, а не алмаз. Во-вторых, нужно договориться о температуре и давлении, при которых находятся вещества, поскольку эти параметры могут заметно влиять на величину теплового эффекта. Принято использовать теплоты образования соединений из чистых элементов в стандартных условиях. Такие стандартные условия чаще называют стандартным состоянием веществ:
1. Для твердых, жидких и газообразных веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25 оС (298 К) и давлении 1 атмосфера (1 атм).
2. Теплота образования чистых элементов по определению равна нулю.
Тепловой эффект реакции не обязательно находить экспериментально, его можно рассчитать, используя стандартные теплоты образования и сгорания веществ, следуя закону Гесса.
Закон Г.И.Гесса (1840г.) заключается в следующем:
Тепловой эффект химической реакции не зависит от пути процесса, а только от вида (например, аллотропной модификации) и агрегатного состояния исходных веществ и конечных продуктов реакции.
^ Стандартная теплота сгорания показывает, сколько кДж энергии выделилось при сгорании 1 моль вещества до высших оксидов.
Теплоты сгорания негорючих веществ равна 0.
Стандартные теплоты сгорания и образования можно найти в справочных таблицах.
Расчёты теплового эффекта реакции проводятся согласно следствию из закона Гесса: тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ.
Q = ΣQ0обр (продуктов) – ΣQ0обр (исходных веществ)
Если даны стандартные теплоты сгорания, то можно использовать следующую формулу для вычисления теплового эффекта реакции:
Q = ΣQ0сгор (исходных веществ) – ΣQ0сгор (продуктов).
10. Тепловой эффект химической реакции как функция температуры, уравнение Кирхгофа. Характер кривых 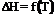 в зависимости от вида кривых
в зависимости от вида кривых 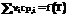 для исходных и конечных веществ.
для исходных и конечных веществ.

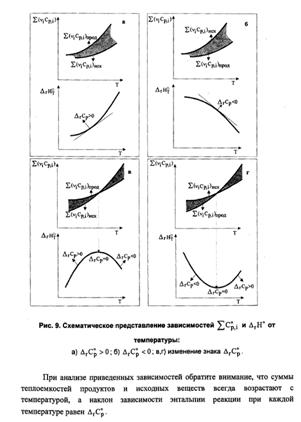

11. Вывод и анализ уравнения Кирхгофа. Использование интегральных форм уравнения для вычисления тепловых эффектов химических процессов при заданной температуре (в том числе стандартной теплоты образования при 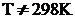 )
)
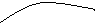
r Ср = 0 r Н T 1 = r Н T 2 . Теплота реакции не зависит от температуры
Ср>0, T r Н Для эндотермической реакции r Н2 > r Н1.
Для экзотермической реакции r Н2 < r Н1.
Ср < 0, T r Н Для эндотермической реакции r Н2 < r Н1.
Для экзотермической реакции r Н2 > r Н1.
| | |
Ср r Н
реагенты
продукты
| |
| 
|


Т Т
а) б)
Рис. 4.3. Зависимость теплоемкости (а) и теплоты реакции (б) от температуры



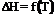 в зависимости от вида кривых
в зависимости от вида кривых 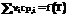 для исходных и конечных веществ.
для исходных и конечных веществ. 


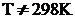 )
)