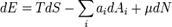Изохорная и изобарная молярные теплоемкости. Связь между ними для идеального газа. Зависимость изобарной теплоемкости от температуры для веществ в кристаллическом, жидком и газообразном состоянии.
При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе(p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры.
Для процесса при постоянном давлении первый закон термодинамики дает:
| Qp = ΔU + p (V2 – V1) = CV ΔT + pΔV,
| |
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
где R – универсальная газовая постоянная. При p = const
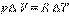 или или 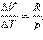
|
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
| При фазовых переходах (из одной кристаллической модификации в другую, из твердого состояния в жидкое и т.п.) теплоемкость меняется скачкообразно, при этом для большинства веществ CV жидкого вещества при температуре плавления несколько больше CVкристаллического (рис. 1.7).
| |
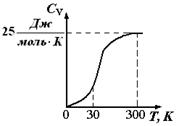 Рис. 1.6. Зависимость теплоемкости кристаллических веществ от температуры Рис. 1.6. Зависимость теплоемкости кристаллических веществ от температуры
|
| |
| |
| |
|
| |
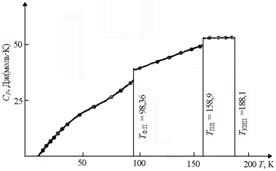
| Рис. 1.7. Зависимость теплоемкости HCl от температуры TTФ.П. – температура фазового перехода; TПЛ. – температура плавления; TКИП. – температура кипения
| | |
| 3. Теплоемкость газообразных и жидких веществ обычно растет с повышением температуры (рис. 1.8).
| | |
 Рис. 1.8. Зависимость теплоемкости газов от температуры: а) если кривая при невысоких ^ T имеет большую кривизну, чем при высоких, ее предпочтительнее описывать эмпирическим степенным рядом вида: CP = a + в×T + c’/T2; б) кривую б степенным рядом вида: CP = a + в×T + c×T2 Рис. 1.8. Зависимость теплоемкости газов от температуры: а) если кривая при невысоких ^ T имеет большую кривизну, чем при высоких, ее предпочтительнее описывать эмпирическим степенным рядом вида: CP = a + в×T + c’/T2; б) кривую б степенным рядом вида: CP = a + в×T + c×T2
| | |
| Зависимость теплоемкости веществ от температуры в интервале от 298 до T принято описывать
| | |
| для неорганических веществ эмпирическим уравнением: CP = a + в × T + c’/T2 (1.21)
| для органических веществ эмпирическим уравнением:
CP = a + в × T + c × T 2 (1.22)
| | |
Следствия из закона Гесса
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса:
1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье – Лапласа).
2. Для двух реакций, имеющих одинаковые исходные, но разные конечные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного конечного состояния в другое.
С + О2 ––> СО + 1/2 О2 ΔН1
С + О2 ––> СО2 ΔН2
СО + 1/2 О2 ––> СО2 ΔН3
3. Для двух реакций, имеющих одинаковые конечные, но разные исходные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного исходного состояния в другое.
С(алмаз) + О2 ––> СО2 ΔН1
С(графит) + О2 ––> СО2 ΔН2
С(алмаз) ––> С(графит) ΔН3
4. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
5. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты.
(I.21) При условии протекания в системе химических или фазовых превращений энтальпию также следует рассматривать как функцию 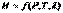 . Тогда:
. Тогда:
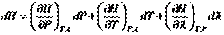 (I,58)
(I,58)
Принимая во внимание определение энтальпии (I, 51) и (I, 31), после дифференцирования можем записать:
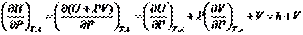 (I, 58а)
(I, 58а)
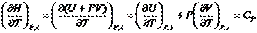 (I, 58б)
(I, 58б)
Если Р = const и = const , то 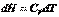 . Итак, окончательно получим:
. Итак, окончательно получим:
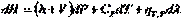 (I,59)
(I,59)
где 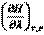 =
= 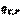 - это тепловой эффект химической реакции, протекающей до конца (
- это тепловой эффект химической реакции, протекающей до конца ( 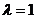 ), при
), при 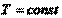 и
и 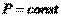 . Он равен изменению энтальпии системы.Принимая во внимание определение энтальпии (I, 51), также можно записать:
. Он равен изменению энтальпии системы.Принимая во внимание определение энтальпии (I, 51), также можно записать: 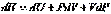
Первые два слагаемых в правой части уравнения по первому закону термодинамики (смотри (I, 7а)) равны  , тогда :
, тогда : 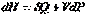 (I, 59а)
(I, 59а)
Следовательно, 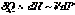 и с учётом (I,59) для элементарной теплоты получаем:
и с учётом (I,59) для элементарной теплоты получаем: 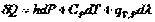
Тепловой эффект химической реакции – это количество теплоты, выделившейся или поглощённой при протекании реакции до конца ( 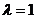 ) и постоянных значениях параметров системы.
) и постоянных значениях параметров системы.
Это понятие следует отличать от понятия теплоты реакции, которое не имеет такого строгого термодинамического смысла как тепловой эффект. Теплота реакции – опытная величина, она может быть определена во всех случаях, когда реакция протекает не до конца или, например, температура исходных веществ и продуктов реакции отличаются и т.д. По этой причине теплота реакции не несёт какой-либо существенной информации об особенностях протекающих в системе химических превращений и имеет ограниченное применение.
8. Тепловой эффект химической реакции. Стандартные теплоты образования и сгорания. Закон Гесса, следствия из закона Гесса.
Тепловой эффект - количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции.
Тепловой эффект обозначается символом Q. Его величина соответствует разности между энергиями исходного и конечного состояний реакции.
В экзотермических реакциях Q > 0.
В эндотермических реакциях Q < 0.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования.
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 76 кДж/моль.
В литературе часто встречается другое обозначение стандартной энтальпии — ΔH298,150, где 0 указывает на равенство давления одной атмосфере (или, несколько более точно, на стандартные условия), а 298,15 — температура. Иногда индекс 0 используют для величин, относящихся к чистому веществу, оговаривая, что обозначать им стандартные термодинамические величины можно только тогда, когда в качестве стандартного состояния выбрано именно чистое вещество. Стандартным также может быть принято, например, состояние вещества в предельно разбавленном растворе.
Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв)0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж)0 = 22 кДж/моль. Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса):
ΔHреакцииO = ΣΔHfO (продукты) — ΣΔHfO (реагенты)
Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиеcя выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален.
Стандартная энтальпия сгорания — ΔHгоро, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
· Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).
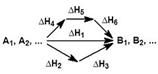
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Следствия из закона Гесса
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса:
1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье – Лапласа).
2. Для двух реакций, имеющих одинаковые исходные, но разные конечные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного конечного состояния в другое.
С + О2 ––> СО + 1/2 О2 ΔН1
С + О2 ––> СО2 ΔН2
СО + 1/2 О2 ––> СО2 ΔН3
3. Для двух реакций, имеющих одинаковые конечные, но разные исходные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного исходного состояния в другое.
С(алмаз) + О2 ––> СО2 ΔН1
С(графит) + О2 ––> СО2 ΔН2
С(алмаз) ––> С(графит) ΔН3
4. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
Самопроизвольные и несамопроизвольные процессы. Второе начало термодинамики. Математическое выражение 2-го закона термодинамики. Изменение энтропии в самопроизвольном процессе, протекающем в изолированной системе.
Второе начало термодинамики, которое, как и первое постулируется на основании многовекового человеческого опыта, дает возможность предсказать направление процессов. Именно второе начало позволяет разделить все процессы, которые возможны с точки зрения первого закона термодинамики, на две различные группы: самопроизвольные и несамопроизвольные.
Самопроизвольные процессы – это неравновесные процессы, которые протекают без воздействия внешней силы в направлении достижения равновесия. Для проведения самопроизвольных процессов не только не затрачивается работа, но при соответствующих условиях эта система сама может произвести работу в количестве, пропорциональном происходящему изменению. Примерами самопроизвольных процессов могут служить переход тепла от более нагретого тела к менее нагретому, смешение газов, расширение газов в вакуум, превращение кинетической энергии движущегося тела в тепло и т.д. Все перечисленные процессы протекают в направлении, приближающем систему к равновесию.
Обратные по направлению процессы: переход тепла от холодного тела к горячему, разделение газовой смеси, сжатие газа и т.д. удаляют соответствующие системы от равновесия и без внешнего воздействия происходить не могут, т.е. для проведения таких процессов необходимо затратить работу в количестве, пропорциональном происходящим изменениям. Такие процессы называются несамопроизвольные.
Рассмотренные ранее равновесные процессы, при которых системы, бесконечно медленно изменяясь, проходят непрерывный ряд равновесных состояний, можно рассматривать в качестве промежуточных между процессами самопроизвольными и несамопроизвольными.
Самопроизвольные процессы
Равновесные процессы
Несамопроизвольные процессы
Для получения математического выражения второго начала термодинамики рассмотрим работу идеальной тепловой машины (машины, обратимо работающей без трения и потерь тепла; рабочее тело – идеальный газ). Работа машины основана на принципе обратимого циклического процесса – термодинамического цикла Карно (рис. 1.2).
Формулировки второго закона термодинамики. Закон прошел длительный путь эволюции и сначала был сформулирован как основной закон действия тепловых машин
5.2.1. Теорема Карно (1824) “Размышление о движущей силе огня” – коэффициент полезного действия обратимого цикла, состоящего из 2 изотерм и 2 адиабат, зависит только от разности температур тепловых резервуаров и не зависит от природы рабочего тела
= ( Q 1 – Q 2 )/ Q 1 = ( T 1 – T 2 )/ T 1 = 1 – Т2/Т1 . (5.1)
5.2.2. Томсон (лорд Кельвин) (1848) ввел понятие абсолютной температуры и (1851) сформулировал 2 закон ТД – невозможно построить периодически действующую тепловую машину, которая только бы черпала тепло из одного резервуара и производила механическую работу, т.е. невозможен вечный двигатель 2-го рода
5.2.3. Клаузиус (1850) дал первую формулировку 2 закона ТД – невозможен самопроизвольный переход теплоты от тела менее нагретого к телу более нагретому.Обе формулировки эквивалентны, одна невозможна без другой. (1854) Ввел понятие энтропии.
Второе начало термодинамики, математическое выражение для обратимых и необратимых (самопроизвольных) процессов. Энтропия как критерий равновесия и направления самопроизвольного протекания процесса в изолированной системе.
| | | |
| |
| | Мы приведем математическую формулировку второго закона термодинамики в форме, удобной для исследования химических и физических превращений в системе.
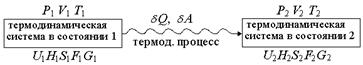
Рис. 1.15. Схема термодинамического превращения
Если термодинамическая система переходит из состояния 1, характеризующегося параметрами P1, V1, T1 и функциями состояния U1,H1, S1, F1, G1 в состояние 2, характеризующееся параметрами P2, V2, T2 и функциями состояния U2, H2, S2, F2, G2,
самопроизвольно
| равновесным путем, то 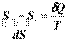 , (1.27) , (1.27)
| неравновесным путем, то  , (1.28) , (1.28)
| | где d Q – теплота процесса, протекающего в системе.
| |
| |
| Второй закон термодинамики является постулатом, сформулированным на основе накопленного человечеством опыта; доказательством его справедливости служит то, что все выводы, вытекающие из него, находят экспериментальное подтверждение, и до сих пор не произошло ничего, что «запрещает» второй закон термодинамики.
Из второго закона термодинамики путем несложных математических преобразований можно получить ряд следствий, которыми удобно пользоваться для определения направления процесса и условий, при которых в системе наступает равновесие.
|
| |
|
| Термодинамическая система называется изолированной, если ее объем постоянен и она не обменивается с окружающей средой энергией и веществом. Если обратиться к схеме, приведенной на рис. 1.15 (см. стр. 30), то для изолированной системы: V1 = V2 = V = const U1 = U2 = U = const Критерием самопроизвольного протекания процесса в изолированной системе является энтропия. ^ В изолированной системе могут самопроизвольно протекать только те процессы, которые приводят к возрастанию энтропии в системе. Когда энтропия достигнет максимального при данных U и V значения, все процессы прекратятся, и система достигнет равновесного состояния.
| | Итак,
| | если U = const и V = const, то при самопроизвольном процессе, протекающем неравновесным путем S2 – S1 > 0 dS > D 0 S > 0
|
| если U = const и V = const, то при равновесии S2 – S1 = 0 dS D = 0 S = 0
| | | |
| | | | | | |
Зависимость энтропии индивидуального вещества от температуры при постоянном давлении. Приведите соответствующее дифференциальное уравнение. Схематически изобразите график этой зависимости в широком температурном интервале, включающем температуры плавления и кипения вещества.
Зная функциональную зависимость теплоемкости от температуры, можно рассчитать значения других термодинамических функций или, по крайней мере, их изменение с температурой. Например, согласно теореме Нернста, гласящей, что энтропия при абсолютном нуле равна нулю, для значения энтропии любого вещества при произвольной температуре получаем формулу:
|
|
|
| 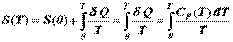
| .
|
|
|
| (4.2.1)
|
Т.е., зная температурную зависимость теплоемкости, можно рассчитать абсолютное значение энтропии. Поскольку теплоемкость есть положительная величина, то энтропия естьмонотонно возрастающая функция температуры. Пример реальной температурной зависимости энтропии конкретного вещества показан на рис. 4.2.1.
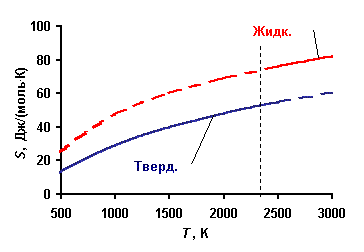
Рис. 4.2.1. Зависимость молярной энтропии твердого и жидкого бора от температуры
Системы переменного состава. Химический потенциал компонента системы. Зависимость химического потенциала от давления и температуры. Условия равновесия и самопроизвольного протекания химического процесса в системах переменного состава.
Раствором называется гомогенная, молекулярно-дисперсная система, состав которой можно изменять непрерывно в некотором конечном или бесконечном интервале.
По агрегатному состоянию растворы разделяются на твердые, жидкие и газообразные. Если растворитель и растворенное вещество имеют разные агрегатные состояния, то растворителем рассматривают обычно то вещество, агрегатное состояние которого совпадает с агрегатным состоянием раствора. Если же компоненты раствора и раствор имеют одинаковое агрегатное состояние, то за растворитель считают то вещество, которого больше, хотя для термодинамики это безразлично.
Состав раствора измеряется его концентрацией. Существуют следующие основные определения концентрации:
мольная доля (х) – число молей вещества в 1 моле раствора;
моляльность (m) – число молей растворенного вещества в 1000 г растворителя;
молярность (с) – число молей растворенного вещества в 1 л раствора;
массовое содержание (р) – число грамм растворенного вещества в 100 г раствора.
Характеристические функции многокомпонентных систем.
Первый и второй законы термодинамики, из которых следуют фундаментальные уравнения, были получены для закрытых систем, т.е. систем, процессы в которых не приводят к изменению количества компонентов. Реально же чаще встречаются системы, в которых при различных процессах изменяются количества компонентов. Это может происходить, скажем, при фазовых превращениях или вследствие протекания химической реакции. При этом может изменяться состав, как отдельных частей, так и системы в целом.
Поэтому внутренняя энергия (и другие функции состояния) открытых систем будут изменяться не только за счет сообщения системе теплоты и произведенной системой работы, но и за счет изменения состава системы. Следовательно для открытых систем характеристические функции будут функциями не только их двух естественных переменных, но и функциями числа молей всех веществ , составляющих систему:
U = U ( S, v, n1……………….nk ),
H = H ( S, p, n1 ………….. nk ),
F = F ( T, v, n1…………… nk ),
G = G ( T, p, n1……………nk ).
Хими́ческий потенциа́л 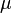 — термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. Определяет изменение термодинамических потенциалов (энергии Гиббса, внутренней энергии, энтальпии и т. д.) при изменении числа частиц в системе. Представляет собой энергиюдобавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде:
— термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. Определяет изменение термодинамических потенциалов (энергии Гиббса, внутренней энергии, энтальпии и т. д.) при изменении числа частиц в системе. Представляет собой энергиюдобавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде:
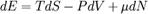 где Е — энергия системы, S — её энтропия, N — количество частиц в системе.
где Е — энергия системы, S — её энтропия, N — количество частиц в системе.
Эта формула определяет, кроме химического потенциала 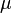 , также давление P и температуру T.
, также давление P и температуру T.
Для систем, состоящих из одного компонента, можно доказать, что химический потенциал задаётся формулой
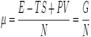 ,где
,где 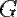 -потенциал Гиббса
-потенциал Гиббса
Если энергия системы зависит не от объёма, а от других термодинамических параметров 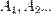 , исходная формула принимает вид
, исходная формула принимает вид 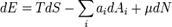
Если в системе имеется несколько разных типов частиц, есть столько же разных химических потенциалов. Связь химического потенциала со свободной энергией называется Большим термодинамическим потенциалом.
Условия равновесия в многокомпонентных гетерогенных системах.
Пусть р, Т = Const, тогда . Если в системе имеются фазы (') и (''), то при переходе dni молей i –ого компонента из фазы (') в фазу ('') изменение энергии Гиббса системы dG будет складываться из изменении энергий Гиббса обеих фаз dG 'и dG '': .
Если система закрытая, то , а если она к тому же и равновесна, то dG = 0 и, следовательно, , т.е. химические потенциалы данного компонента во всех фазах системы, находящейся в равновесии, равны между собой.
Самопроизвольный неравновесный процесс может идти только в сторону уменьшения энергии Гиббса системы dG < 0 (p,T = const).
Предположим, что , т.е. фаза (') теряет i –ый компонент, но , значит .
Если же , тогда . Таким образом, компонент самопроизвольно переходит из фазы, в которой его химический потенциал больше, в фазу, в которой его химический потенциал меньше.
Эти условия равновесия и самопроизвольности процессов переноса вещества в многокомпонентных системах являются обобщением таковых для однокомпонентных систем (см. гл. 6). Кроме того, легко заметить, что химический потенциал чистого вещества равен его мольной энергии Гиббса.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Изохорная и изобарная молярные теплоемкости. Связь между ними для идеального газа. Зависимость изобарной теплоемкости от температуры для веществ в кристаллическом, жидком и газообразном состоянии.
При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе(p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры.
Для процесса при постоянном давлении первый закон термодинамики дает:
| Qp = ΔU + p (V2 – V1) = CV ΔT + pΔV,
| |
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
где R – универсальная газовая постоянная. При p = const
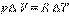 или или 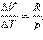
|
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
| При фазовых переходах (из одной кристаллической модификации в другую, из твердого состояния в жидкое и т.п.) теплоемкость меняется скачкообразно, при этом для большинства веществ CV жидкого вещества при температуре плавления несколько больше CVкристаллического (рис. 1.7).
| |
 Рис. 1.6. Зависимость теплоемкости кристаллических веществ от температуры Рис. 1.6. Зависимость теплоемкости кристаллических веществ от температуры
|
| |
| |
| |

|
| |
| Рис. 1.7. Зависимость теплоемкости HCl от температуры TTФ.П. – температура фазового перехода; TПЛ. – температура плавления; TКИП. – температура кипения
| | |
| 3. Теплоемкость газообразных и жидких веществ обычно растет с повышением температуры (рис. 1.8).
| | |
 Рис. 1.8. Зависимость теплоемкости газов от температуры: а) если кривая при невысоких ^ T имеет большую кривизну, чем при высоких, ее предпочтительнее описывать эмпирическим степенным рядом вида: CP = a + в×T + c’/T2; б) кривую б степенным рядом вида: CP = a + в×T + c×T2 Рис. 1.8. Зависимость теплоемкости газов от температуры: а) если кривая при невысоких ^ T имеет большую кривизну, чем при высоких, ее предпочтительнее описывать эмпирическим степенным рядом вида: CP = a + в×T + c’/T2; б) кривую б степенным рядом вида: CP = a + в×T + c×T2
| | |
| Зависимость теплоемкости веществ от температуры в интервале от 298 до T принято описывать
| | |
| для неорганических веществ эмпирическим уравнением: CP = a + в × T + c’/T2 (1.21)
| для органических веществ эмпирическим уравнением:
CP = a + в × T + c × T 2 (1.22)
| | |



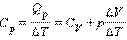
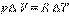 или
или 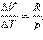
 Рис. 1.6. Зависимость теплоемкости кристаллических веществ от температуры
Рис. 1.6. Зависимость теплоемкости кристаллических веществ от температуры

 Рис. 1.8. Зависимость теплоемкости газов от температуры: а) если кривая при невысоких ^ T имеет большую кривизну, чем при высоких, ее предпочтительнее описывать эмпирическим степенным рядом вида: CP = a + в×T + c’/T2; б) кривую б степенным рядом вида: CP = a + в×T + c×T2
Рис. 1.8. Зависимость теплоемкости газов от температуры: а) если кривая при невысоких ^ T имеет большую кривизну, чем при высоких, ее предпочтительнее описывать эмпирическим степенным рядом вида: CP = a + в×T + c’/T2; б) кривую б степенным рядом вида: CP = a + в×T + c×T2
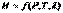 . Тогда:
. Тогда: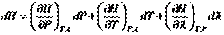 (I,58)
(I,58)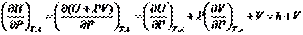 (I, 58а)
(I, 58а)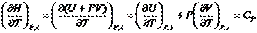 (I, 58б)
(I, 58б)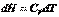 . Итак, окончательно получим:
. Итак, окончательно получим: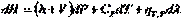 (I,59)
(I,59)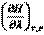 =
= 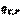 - это тепловой эффект химической реакции, протекающей до конца (
- это тепловой эффект химической реакции, протекающей до конца (  ), при
), при 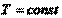 и
и 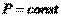 . Он равен изменению энтальпии системы.Принимая во внимание определение энтальпии (I, 51), также можно записать:
. Он равен изменению энтальпии системы.Принимая во внимание определение энтальпии (I, 51), также можно записать: 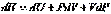
 , тогда :
, тогда : 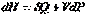 (I, 59а)
(I, 59а)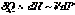 и с учётом (I,59) для элементарной теплоты получаем:
и с учётом (I,59) для элементарной теплоты получаем: 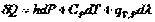

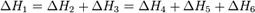
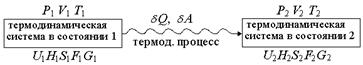
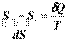 , (1.27)
, (1.27)
 , (1.28)
, (1.28)
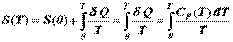

 — термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. Определяет изменение термодинамических потенциалов (энергии Гиббса, внутренней энергии, энтальпии и т. д.) при изменении числа частиц в системе. Представляет собой энергиюдобавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде:
— термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. Определяет изменение термодинамических потенциалов (энергии Гиббса, внутренней энергии, энтальпии и т. д.) при изменении числа частиц в системе. Представляет собой энергиюдобавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде: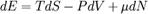 где Е — энергия системы, S — её энтропия, N — количество частиц в системе.
где Е — энергия системы, S — её энтропия, N — количество частиц в системе.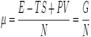 ,где
,где 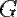 -потенциал Гиббса
-потенциал Гиббса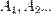 , исходная формула принимает вид
, исходная формула принимает вид