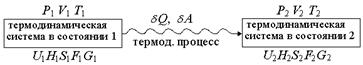Существуют несколько эквивалентных формулировок второго начала термодинамики:
1.Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
2.Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
3.Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Самопроизвольные процессы – это неравновесные процессы, которые протекают без воздействия внешней силы в направлении достижения равновесия. Для проведения самопроизвольных процессов не только не затрачивается работа, но при соответствующих условиях эта система сама может произвести работу в количестве, пропорциональном происходящему изменению. Примерами самопроизвольных процессов могут служить переход тепла от более нагретого тела к менее нагретому, смешение газов, расширение газов в вакуум, превращение кинетической энергии движущегося тела в тепло и т.д. Все перечисленные процессы протекают в направлении, приближающем систему к равновесию.
Обратные по направлению процессы: переход тепла от холодного тела к горячему, разделение газовой смеси, сжатие газа и т.д. удаляют соответствующие системы от равновесия и без внешнего воздействия происходить не могут, т.е. для проведения таких процессов необходимо затратить работу в количестве, пропорциональном происходящим изменениям. Такие процессы называются несамопроизвольные.
Рассмотренные ранее равновесные процессы, при которых системы, бесконечно медленно изменяясь, проходят непрерывный ряд равновесных состояний, можно рассматривать в качестве промежуточных между процессами самопроизвольными и несамопроизвольными.
| Термодинамическая система называется изолированной, если ее объем постоянен и она не обменивается с окружающей средой энергией и веществом. Если обратиться к схеме, приведенной на рис. 1.15 (см. стр. 30), то для изолированной системы: V1 = V2 = V = const U1 = U2 = U = const Критерием самопроизвольного протекания процесса в изолированной системе является энтропия. ^ В изолированной системе могут самопроизвольно протекать только те процессы, которые приводят к возрастанию энтропии в системе. Когда энтропия достигнет максимального при данных U и V значения, все процессы прекратятся, и система достигнет равновесного состояния.
|
| Итак,
| | если U = const и V = const, то при самопроизвольном процессе, протекающем неравновесным путем S2 – S1 > 0 dS > D 0 S > 0
|
| если U = const и V = const, то при равновесии S2 – S1 = 0 dS D = 0 S = 0
| |
| В системе, не совершающей никакой работы, кроме работы расширения, и находящейся при постоянных температуре и давлении (Р = const, Т = const), самопроизвольно могут протекать только те процессы, которые приводят к уменьшению изобарно-изотермического потенциала системы (G). Когда G достигнет минимального значения при данных Р и Т, система приходит в равновесие и процесс прекращается.
| Обозначим величины так, как на рис. 1.15 (см. стр. 30), тогда
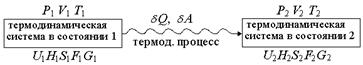
| | если 1) A d = P × dV; 2) Р = const, Т = const, то при самопроизвольном процессе, протекающем неравновесным путем G2 – G1 < 0 dG < D 0 G < 0
|
| если 1) A d = P × dV; 2) Р = const, Т = const, то при равновесии G2 – G1 = 0 dG = D 0 G =0 
| | Многие физические и химические процессы протекают при постоянном давлении и температуре, если они проводятся в открытых термостатированных реакторах. О направлении процессов и равновесии в таких системах судят по изменению изобарно-изотермического потенциала (свободной энергии) системы (G).
|