Для пересчета теплоты реакции с одной температуры на другую нужно использовать определенный интеграл
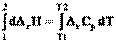 (4.14)
(4.14)
НТ = Н298 +  = Н298 + r Ср (T-298)
= Н298 + r Ср (T-298)
В небольшом интервале температур r Ср= const . В противном случае нужно представить r Ср в виде температурного ряда и только после этого интегрировать уравнение (4.17)
 =
= 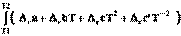 dT
dT
r Н2 = r Н1 + r a ( T 2 - T 1 ) + r b /2 ( T 2 2 – T 1 2 ) + r c /3( T 2 3 - T 1 3 ) - r c '(1/ T 2 –1/ T 1 ).
(4.15)
4.8.6.2. Для вывода общего уравнения зависимости Н = f ( T ), нужно брать неопределенный интеграл
r Н = r Н0 + r aT + r b /2 T 2 + r c /3 T 3 - r c '1/ T . (4.16)
Постоянная интегрирования r Н0 имеет смысл теплоты реакции при температуре 0 К и может быть найдена по известному значению теплоты реакции при определенной температуре, например, при 298 К
r Н0 = Н298 –( r a ∙298 + r b/2∙ 2982 + r c/3 ∙2983 - r c'∙1/298). (4.17)
Температурные ряды теплоемкостей могут быть оборваны на любом члене в зависимости от выбранного интервала температур: чем больше разность температур, темболшее число членов температурных полиномов следует учитывать.
12. Зависимость теплового эффекта химической реакции от температуры проходит через максимум (вариант: «минимум») при Т=….К. Представьте график температурной зависимости этой функции и график зависимостей сумм теплоемкостей продуктов и исходных веществ (∑ν i cP , i ) от температуры. Дайте необходимые пояснения.
| |
| Из дифференциальной формы уравнения Кирхгоффа (1.23) видно что,
влияние температуры на тепловой эффект обусловлено знаком величины ΔСP:
1) если ΔСP 0, то первая производная< 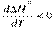 , следовательно, функция ∆H =° f(T) – убывающая (рис. 1.9); , следовательно, функция ∆H =° f(T) – убывающая (рис. 1.9);
| |
|
|
2) если ΔСP > 0, то первая производная 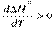 , следовательно, функция ∆H =° f(T) – возрастающая (рис. 1.10). , следовательно, функция ∆H =° f(T) – возрастающая (рис. 1.10).
|
|
Рис. 1.9. Зависимость ∆H от° T,
если ΔСP <0:
а) тепловой эффект эндотермической реакции убывает с ростом T (при высоких T поглощается меньше тепла);
б) тепловой эффект экзотермической реакции с ростом ^ T становится более отрицательным (при высоких Tвыделяется больше тепла) 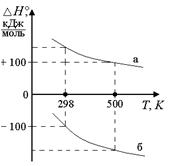
| 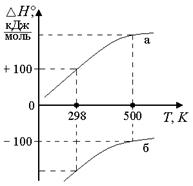 Рис. 1.10. Зависимость ∆H от° T, если ΔСP > 0: а) тепловой эффект эндотермической реакции растет с ростом T (при высоких Tпоглощается больше тепла); б) тепловой эффект экзотермической реакции с ростом ^ T становится менее отрицательным (при высоких Tвыделяется меньше тепла) Рис. 1.10. Зависимость ∆H от° T, если ΔСP > 0: а) тепловой эффект эндотермической реакции растет с ростом T (при высоких Tпоглощается больше тепла); б) тепловой эффект экзотермической реакции с ростом ^ T становится менее отрицательным (при высоких Tвыделяется меньше тепла)
|
|
|
3) если ΔСP = 0, то и тепловой эффект не зависит от температуры (рис. 1.11);
Рис. 1.11. Зависимость ∆H от°T, если
ΔСP =0

| 4) если величина ΔСP при высоких и низких температурах имеет разный знак, то зависимость ∆^ H от температуры имеет более сложную зависимость: кривая ∆H = f(T) проходит через максимум или минимум (рис. 1.12).
 Рис. 1.12. Зависимость теплового эффекта от температуры: 1) 3/2H2 + N2 ® NH3; 2) C + 1/2O2 ® CO Рис. 1.12. Зависимость теплового эффекта от температуры: 1) 3/2H2 + N2 ® NH3; 2) C + 1/2O2 ® CO
|
|
| | | | | |
Для расчета тепловых эффектов реакций при температурах отличных от стандартной, пользуются интегральной формой уравнений Кирхгоффа (1.25) и (1.26).
В нешироком температурном интервале (десятки градусов) можно пренебречь зависимостью теплоемкостей реагентов от температуры и считать ΔСP постоянной величиной, не зависящей от T, тогда для теплового эффекта при температуре T получаем:
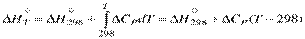
где ^ T – не слишком отлична от 298 К.
При интегрировании уравнения Кирхгоффа в широком интервале температур (298 – T) пользуются температурной зависимостью теплоемкости веществ в виде степенных рядов (1.21) и (1.22), справедливых в данном температурном интервале.
В общем случае, если в реакции участвуют и органические и неорганические вещества для разности теплоемкостей конечных и начальных веществ получится выражение вида:
ΔCP = Δa + ΔвT + ΔcT2 + Δc’/T2
Тогда для теплового эффекта при высокой температуре T имеем: 
13. Для некоторой реакции сумма теплоемкостей исходных веществ меньше суммы теплоемкостей продуктов. Причем при повышении температуры Δ r Ср увеличивается. Изобразите схематически графики зависимости 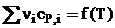 для исходных веществ и продуктов реакции и теплового эффекта реакции от температуры. Приведите краткое теоретическое обоснование ответа и соответствующие математические выражения.
для исходных веществ и продуктов реакции и теплового эффекта реакции от температуры. Приведите краткое теоретическое обоснование ответа и соответствующие математические выражения.
14. Второе начало термодинамики. Энтропия, изменение энтропии в термодинамических процессах с участием идеального газа при  и
и 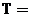
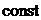 .
.
Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса).
Постулат Томсона: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины забрав тепло у нагревателя, отдав холодильнику и совершив при этом работу . После этого воспользуемся процессом Клаузиуса и вернем тепло от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны. 




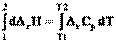 (4.14)
(4.14) = Н298 + r Ср (T-298)
= Н298 + r Ср (T-298)  =
= 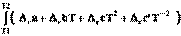 dT
dT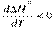 , следовательно, функция ∆H =° f(T) – убывающая (рис. 1.9);
, следовательно, функция ∆H =° f(T) – убывающая (рис. 1.9);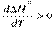 , следовательно, функция ∆H =° f(T) – возрастающая (рис. 1.10).
, следовательно, функция ∆H =° f(T) – возрастающая (рис. 1.10).
 Рис. 1.10. Зависимость ∆H от° T, если ΔСP > 0: а) тепловой эффект эндотермической реакции растет с ростом T (при высоких Tпоглощается больше тепла); б) тепловой эффект экзотермической реакции с ростом ^ T становится менее отрицательным (при высоких Tвыделяется меньше тепла)
Рис. 1.10. Зависимость ∆H от° T, если ΔСP > 0: а) тепловой эффект эндотермической реакции растет с ростом T (при высоких Tпоглощается больше тепла); б) тепловой эффект экзотермической реакции с ростом ^ T становится менее отрицательным (при высоких Tвыделяется меньше тепла)

 Рис. 1.12. Зависимость теплового эффекта от температуры: 1) 3/2H2 + N2 ® NH3; 2) C + 1/2O2 ® CO
Рис. 1.12. Зависимость теплового эффекта от температуры: 1) 3/2H2 + N2 ® NH3; 2) C + 1/2O2 ® CO
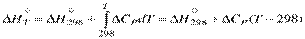

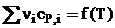 для исходных веществ и продуктов реакции и теплового эффекта реакции от температуры. Приведите краткое теоретическое обоснование ответа и соответствующие математические выражения.
для исходных веществ и продуктов реакции и теплового эффекта реакции от температуры. Приведите краткое теоретическое обоснование ответа и соответствующие математические выражения. и
и 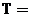
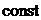 .
. 




