| Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса).
Постулат Томсона: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины забрав тепло у нагревателя, отдав холодильнику и совершив при этом работу . После этого воспользуемся процессом Клаузиуса и вернем тепло от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны
Энтропия системы является функцией ее состояния, определенная с точностью до произвольной постоянной.
Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии
|
| 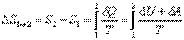 . .
|
| (6.2.1)
| Таким образом, по формуле (6.2.1) можно определить энтропию лишь с точностью до аддитивной постоянной, т.е. начало энтропии произвольно. Физический смысл имеет лишь разность энтропий.
|


Самопроизвольные и несамопроизвольные процессы. Второе начало термодинамики. Математическое выражение 2-го закона термодинамики. Изменение энтропии в самопроизвольном процессе, протекающем в изолированной системе.
Второе начало термодинамики, которое, как и первое постулируется на основании многовекового человеческого опыта, дает возможность предсказать направление процессов. Именно второе начало позволяет разделить все процессы, которые возможны с точки зрения первого закона термодинамики, на две различные группы: самопроизвольные и несамопроизвольные.
Самопроизвольные процессы – это неравновесные процессы, которые протекают без воздействия внешней силы в направлении достижения равновесия. Для проведения самопроизвольных процессов не только не затрачивается работа, но при соответствующих условиях эта система сама может произвести работу в количестве, пропорциональном происходящему изменению. Примерами самопроизвольных процессов могут служить переход тепла от более нагретого тела к менее нагретому, смешение газов, расширение газов в вакуум, превращение кинетической энергии движущегося тела в тепло и т.д. Все перечисленные процессы протекают в направлении, приближающем систему к равновесию.
Обратные по направлению процессы: переход тепла от холодного тела к горячему, разделение газовой смеси, сжатие газа и т.д. удаляют соответствующие системы от равновесия и без внешнего воздействия происходить не могут, т.е. для проведения таких процессов необходимо затратить работу в количестве, пропорциональном происходящим изменениям. Такие процессы называются несамопроизвольные.
Рассмотренные ранее равновесные процессы, при которых системы, бесконечно медленно изменяясь, проходят непрерывный ряд равновесных состояний, можно рассматривать в качестве промежуточных между процессами самопроизвольными и несамопроизвольными.
Самопроизвольные процессы
Равновесные процессы
Несамопроизвольные процессы
Для получения математического выражения второго начала термодинамики рассмотрим работу идеальной тепловой машины (машины, обратимо работающей без трения и потерь тепла; рабочее тело – идеальный газ). Работа машины основана на принципе обратимого циклического процесса – термодинамического цикла Карно (рис. 1.2).
Формулировки второго закона термодинамики. Закон прошел длительный путь эволюции и сначала был сформулирован как основной закон действия тепловых машин
5.2.1. Теорема Карно (1824) “Размышление о движущей силе огня” – коэффициент полезного действия обратимого цикла, состоящего из 2 изотерм и 2 адиабат, зависит только от разности температур тепловых резервуаров и не зависит от природы рабочего тела
= ( Q 1 – Q 2 )/ Q 1 = ( T 1 – T 2 )/ T 1 = 1 – Т2/Т1 . (5.1)
5.2.2. Томсон (лорд Кельвин) (1848) ввел понятие абсолютной температуры и (1851) сформулировал 2 закон ТД – невозможно построить периодически действующую тепловую машину, которая только бы черпала тепло из одного резервуара и производила механическую работу, т.е. невозможен вечный двигатель 2-го рода
5.2.3. Клаузиус (1850) дал первую формулировку 2 закона ТД – невозможен самопроизвольный переход теплоты от тела менее нагретого к телу более нагретому.Обе формулировки эквивалентны, одна невозможна без другой. (1854) Ввел понятие энтропии.



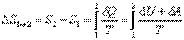 .
.





