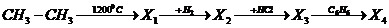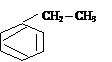8.5 Способы получения гомологов бензола. Основными природными источниками ароматических углеводородов являются каменный уголь и нефть. При сухой перегонке каменного угля (1000-12000С) образуется коксовый газ, кокс и каменноугольная смола. Арены выделяют из коксового газа и при фракционной перегонке каменноугольной смолы. Из нефти арены выделяют перегонкой или химическими методами.
Получение аренов из неароматических соединений.
а) Каталитическое дегидрирование циклогексана и его производных (Зелинский Н.Д. 1911 г.)


¾®¾ + 3Н
2
б) Каталитическая дегидроциклизация алканов (отщепляется Н2 и атомы углерода замыкаются в цикл)

С
6Н
14 ¾¾® + 4Н
2
С
7Н
16 ¾¾® + 4Н
2
Эти два способа получения лежат в основе ароматизации нефти и имеют большое практическое значение.
в) Полимеризация ацетилена и его гомологов.
3СН º СН ¾¾®
Получение аренов из ароматических соединений
 а) Реакция алкилирования – введение в бензольное ядро алкила (R) действием на арены алкенами или галогенопроизводными (реакция Фриделя-Крафтса).
а) Реакция алкилирования – введение в бензольное ядро алкила (R) действием на арены алкенами или галогенопроизводными (реакция Фриделя-Крафтса).
+ СН2 = СН2 ¾®
этилбензол
 + СН2 СН – СН3 ¾®
+ СН2 СН – СН3 ¾®


+ СН
3 – СН
2 Cl ¾® + НCl
этилбензол
б) Синтез Вюрца-Фиттинга – действие металлического Nа на смесь арилгалогенида (ArX) и алкилгалогенида (RX), где X – Cl; Br; J:


+ 2Na +СН3Br® + 2NaBr
в) Восстановление ароматических кетонов:


+ 2Н
2 ¾®¾ + Н
2О
г) Сплавление солей ароматических кислот со щелочью:



+ NaOH ® + +Na2CO3
д)Декарбоксилирование ненасыщенных ароматических кислот:



→ + СО2
стирол
 Стирол получают из этилбензола
Стирол получают из этилбензола
600-630̊С + H2
ZnO
8.6 Обучающее задание №1.
 Получите кумол по реакции Фриделя-Крафтса. Назовите его по М.н. и Р.н.
Получите кумол по реакции Фриделя-Крафтса. Назовите его по М.н. и Р.н.
Решение: Формула кумола
По М.н. – изопропилциклогексатриен –1,3,5
По Р.н. – изопропилбензол.
Получить кумол можно по реакции Фриделя-Крафтса действием на бензол хлористым изопропилом или пропиленом.



+ СН
3 – СНCl ¾® + НCl
СН3
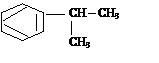

+ СН
2 = СН – СН
3 ¾®
Обучающее задание №2.
 Осуществите превращения, используя неорганические реагенты, карбид кальция ¾® этилбензол
Осуществите превращения, используя неорганические реагенты, карбид кальция ¾® этилбензол
Решение: СаС2 ¾®
Для получения этилбензола необходимо получить бензол, а потом ввести в бензольное ядро R – этил. СаС2 – неорганическое соединение и используется для получения ацетилена, из которого тримеризацией получается бензол:
СаС2 + 2Н2О ® СН º СН + Са(ОН)2
3СН º СН ¾¾®¾
Из ацетилена получаем этилен, которым проведем алкилирование бензола:
СН º СН + Н2 ¾® СН2 = СН2


+ СН
2 = СН
2 ¾®
Обучающее задание №3.
 Осуществите превращения; используя неорганические реагенты: СН4 ¾® толуол.
Осуществите превращения; используя неорганические реагенты: СН4 ¾® толуол.
Решение: СН4 ¾®
Вначале необходимо получить бензол и ввести в него R(СН3).
Для этого:
2СН
4 ¾® СН º СН + 3Н
2
3СН º CH ¾¾®
СН4 + Cl2 ¾® СН3Cl + НCl

Проводим алкилирование хлористым метилом.
+ СН
3Cl ¾® + НCl
Обучающее задание №4.
Осуществите превращения:
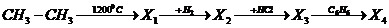
Решение:
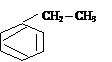

+ СН
3 – СН
2Cl ¾® +HCl
8.7 Физические свойства. Арены – бесцветные жидкости с характерным запахом, высшие гомологи – твердые вещества. Температура кипения и плавления зависят от размера, расположения боковых цепей. Изомеры с несколькими радикалами кипят при более высокой температуре, чем изомеры с одним, но большим R. При сближении радикалов температура кипения возрастает, так орто-изомеры кипят при более высокой температуре, чем n-изомеры, а температура плавления выше у
n-изомеров. Изомеры с разветвленным заместителем кипят при более высокой температуре, чем заместители нормального строения. Плотность аренов меньше единицы. Арены нерастворимы в воде и сами являются хорошими растворителями. Они легко воспламеняются и горят ярким коптящим пламенем. Пары и жидкости токсичны. Перед изучением химических свойств аренов необходимо, чтобы студенты повторили химические свойства алкенов (механизм реакций электрофильного присоединения).






 ¾®¾ + 3Н2
¾®¾ + 3Н2



 а) Реакция алкилирования – введение в бензольное ядро алкила (R) действием на арены алкенами или галогенопроизводными (реакция Фриделя-Крафтса).
а) Реакция алкилирования – введение в бензольное ядро алкила (R) действием на арены алкенами или галогенопроизводными (реакция Фриделя-Крафтса).


 + СН2 СН – СН3 ¾®
+ СН2 СН – СН3 ¾®




 + 2Н2 ¾®¾ + Н2О
+ 2Н2 ¾®¾ + Н2О






 Стирол получают из этилбензола
Стирол получают из этилбензола Получите кумол по реакции Фриделя-Крафтса. Назовите его по М.н. и Р.н.
Получите кумол по реакции Фриделя-Крафтса. Назовите его по М.н. и Р.н.

 + СН3 – СНCl ¾® + НCl
+ СН3 – СНCl ¾® + НCl
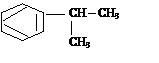

 Осуществите превращения, используя неорганические реагенты, карбид кальция ¾® этилбензол
Осуществите превращения, используя неорганические реагенты, карбид кальция ¾® этилбензол

 + СН2 = СН2 ¾®
+ СН2 = СН2 ¾®
 Осуществите превращения; используя неорганические реагенты: СН4 ¾® толуол.
Осуществите превращения; используя неорганические реагенты: СН4 ¾® толуол.
 Проводим алкилирование хлористым метилом.
Проводим алкилирование хлористым метилом.