Глава 21. Органические соединения серы. Амины.
 Сера и кислород расположены в шестой группе Периодической системы элементов Д.И. Менделеева и проявляют сходство в образовании кислород – серосодержащих соединений. Однако атом кислорода имеет электронную формулу 1s22s22р4 и проявляет в органических соединениях валентность равную 2, а атом серы – 1s22s22p63s23p4 имеет переменную 2,4,6.
Сера и кислород расположены в шестой группе Периодической системы элементов Д.И. Менделеева и проявляют сходство в образовании кислород – серосодержащих соединений. Однако атом кислорода имеет электронную формулу 1s22s22р4 и проявляет в органических соединениях валентность равную 2, а атом серы – 1s22s22p63s23p4 имеет переменную 2,4,6.
Из серосодержащих соединений рассмотрим сульфокислоты.
Сульфокислоты.
Сульфокислотами называют органические соединения, содержащие сульфогруппу (SО3Н), связанную с радикалом. Их можно представить в виде общей формулы R – SО3Н. Например:
 Получают сульфокислоты в промышленности сульфохлорированием алканов, прямым действием серной кислоты на арены:
Получают сульфокислоты в промышленности сульфохлорированием алканов, прямым действием серной кислоты на арены:
При действии щелочей на сульфохлориды или сульфокислоты
образуются соли алкилсульфонаты – хорошие моющие средства:
Ароматические сульфокислоты – кристаллические вещества, хорошо растворимы в воде. Сульфокислоты – сильные кислоты. Они легко гидролизуются, выделяя серную кислоту:
При действии щелочей образуют соли:
| |
| | | С6Н5SО3Н + NаОН ¾® С6Н5SО3Nа + Н2О
| |

При сплавлении солей со щелочами образуются фенолы:
При действии на соли хлорида фосфора (V) образуются сульфохлориды:
 При взаимодействии сульфохлоридов с аммиаком образуются сульфамиды:
При взаимодействии сульфохлоридов с аммиаком образуются сульфамиды:
Сульфонамиды и их производные используются в производстве лекарственных препаратов, сульфокислоты в производстве красителей, в различных синтезах.
Нитросоединения.
Нитросоединения - производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на нитрогруппы (-NО2).
Общая формула R – NО2 или Аr-NО2.
Классификация.
В зависимости от природы радикала нитросоединения делятся на:
- алифатические (предельные и непредельные);
- алициклические;
- ароматические;
- гетероциклические.
В зависимости от характера углеродного атома, с которым связана нитрогруппа они делятся на:
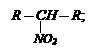 - первичные R – СН2NО2;
- первичные R – СН2NО2;
- вторичные

- третичные
По количеству нитрогрупп они делятся на моно – ди – полинитросоединения.
Строение нитрогруппы подтверждено рентгенографическими исследованиями и определено, что обе связи азота с кислородными атомами имеют одинаковую длину 0,129 нм и более точное строение нитрогруппы можно передать следующими формулами:



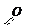





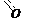
 Номенклатура. По систематической номенклатуре нитросоединения называют, прибавляя к названию углеводорода приставку нитро-, цифрой указывается местонахождение нитрогруппы.
Номенклатура. По систематической номенклатуре нитросоединения называют, прибавляя к названию углеводорода приставку нитро-, цифрой указывается местонахождение нитрогруппы.

Способы получения:
 Нитрование – замена атома водорода в углеводородах на группу NО2:
Нитрование – замена атома водорода в углеводородах на группу NО2:
Нитрованию подвергаются алканы, циклоалканы, арены, гетероциклы и др. Нитрование алканов, циклоалканов и аренов рассмотрено в соответствующих темах. В бензольное ядро можно ввести не более трех нитрогрупп:
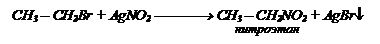 Взаимодействие галогенопроизводных с нитритом серебра AgNО2:
Взаимодействие галогенопроизводных с нитритом серебра AgNО2:
Физико-химические свойства. Большая часть нитросоединений – жидкости, имеющие высокую температуру кипения. Ди- и полинитросоединения – твердые вещества. С ростом углеводородного радикала уменьшается растворимость в воде, хорошо растворимы в органических растворителях и сами являются хорошими растворителями.
Химические свойства.
 Восстановление нитросоединений, при этом получаются амины:
Восстановление нитросоединений, при этом получаются амины:
Действие щелочей. Нитрогруппа – сильный акцептор, оттягивая на себя электронную плотность, увеличивает подвижность атомов водорода при a-углеродном атоме:
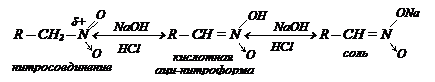 При действии щелочей первичные и вторичные нитросоединения образуют новую форму нитросоединения - кислую, которая затем переходит в соль, в которой органический остаток играет роль аниона. При осторожном действии кислоты на эту соль вновь получается через некоторое время исходный продукт:
При действии щелочей первичные и вторичные нитросоединения образуют новую форму нитросоединения - кислую, которая затем переходит в соль, в которой органический остаток играет роль аниона. При осторожном действии кислоты на эту соль вновь получается через некоторое время исходный продукт:
Взаимное превращение двух форм нитросоединений (нитроформы и аци-нитроформы) является примером таутомерии.
Влияние нитрогруппы на ароматическое ядро. Являясь заместителем второго рода группа NО2 уменьшает активность бензольного ядра, направляя новый заместитель в м-положение (I). В о- и n-положениях электронная плотность сильно уменьшается и они приобретают d+, а следовательно способность вступать в реакции нуклеофильного замещения, например (II, III):
 Нитрогруппа резко повышает кислотность стоящих в о-,n-положениях групп ОН. Соединение (III) называется пикриновой кислотой, она сильнее угольной кислоты (Н2СО3), образует соли – пикраты:
Нитрогруппа резко повышает кислотность стоящих в о-,n-положениях групп ОН. Соединение (III) называется пикриновой кислотой, она сильнее угольной кислоты (Н2СО3), образует соли – пикраты:
Отдельные представители.
Нитрометан СН3NО2 – бесцветная жидкость, tк = 101,2 0С, хороший растворитель синтетических смол, каучуков. Из него получают ССl3NО2 хлорпикрин, который используется в качестве инсектицида.
Тетранитрометан С(NО2)4 – жидкость, tк = 126 0С, используется как окислитель для ракетного топлива. Его получают из ацетилена и уксусного ангидрида.
Нитробензол С6Н5NО2 – бесцветная жидкость, tк = 211 0С,
r = 1,203. Применяется для производства анилина.
Тринитротолуол (тротил, тол) С6Н2(NО2)3СН3 – твердое вещество, tпл = 80 0С, взрывается под действием детонаторов. Применяется при взрывных работах.
Амины.
Амины – производные аммиака, в молекуле которого атомы водорода замещены на углеводородные радикалы.
Классификация.
В зависимости от числа атомов водорода аммиака, замещенных на радикалы, амины делятся на:
- первичные R – NН2
 - вторичные
- вторичные
- третичные
В зависимости от природы радикала они могут быть предельные, непредельные, ациклические, ароматические, гетероциклические.
Номенклатура, изомерия.
По рациональной номенклатуре – к названию радикалов прибавляется слово амин. По систематической номенклатуре добавляют слово амин к названию углеводорода:
 Производные толуола называются толуидинами:
Производные толуола называются толуидинами:
Изомерия аминов предельного ряда – обусловлена строением углеродной цепи и положением аминогруппы:
Способы получения:
Восстановление нитросоединений в присутствии катализаторов Pt; Pd; Ni:
Большое промышленное значение имеет реакции восстановления ароматических нитросоединений. При восстановлении нитробензола Н.Н. Зининым (1842 г.) был получен анилин – основной продукт анилинокрасочной промышленности:

Хорошо известно высказывание А. Гофмана о значении этого окрытия: «За одно это открытие имя Зинина заслуживает быть записанным золотыми буквами в истории химии».
Алкилирование аммиака (реакция А. Гофмана) для получения аминов жирного и жирноароматического ряда, при этом получается смесь первичных, вторичных и третичных аминов:

Пропусканием паров спирта при 300 0С над катализатором:
Физические свойства. Низшие амины – газы, хорошо растворимые в воде, имеют неприятный запах, высшие – твердые вещества, нерастворимые в воде, без запаха.



 Сера и кислород расположены в шестой группе Периодической системы элементов Д.И. Менделеева и проявляют сходство в образовании кислород – серосодержащих соединений. Однако атом кислорода имеет электронную формулу 1s22s22р4 и проявляет в органических соединениях валентность равную 2, а атом серы – 1s22s22p63s23p4 имеет переменную 2,4,6.
Сера и кислород расположены в шестой группе Периодической системы элементов Д.И. Менделеева и проявляют сходство в образовании кислород – серосодержащих соединений. Однако атом кислорода имеет электронную формулу 1s22s22р4 и проявляет в органических соединениях валентность равную 2, а атом серы – 1s22s22p63s23p4 имеет переменную 2,4,6.
 Получают сульфокислоты в промышленности сульфохлорированием алканов, прямым действием серной кислоты на арены:
Получают сульфокислоты в промышленности сульфохлорированием алканов, прямым действием серной кислоты на арены:


 При сплавлении солей со щелочами образуются фенолы:
При сплавлении солей со щелочами образуются фенолы:


 При взаимодействии сульфохлоридов с аммиаком образуются сульфамиды:
При взаимодействии сульфохлоридов с аммиаком образуются сульфамиды: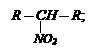 - первичные R – СН2NО2;
- первичные R – СН2NО2;






 Номенклатура. По систематической номенклатуре нитросоединения называют, прибавляя к названию углеводорода приставку нитро-, цифрой указывается местонахождение нитрогруппы.
Номенклатура. По систематической номенклатуре нитросоединения называют, прибавляя к названию углеводорода приставку нитро-, цифрой указывается местонахождение нитрогруппы.
 Нитрование – замена атома водорода в углеводородах на группу NО2:
Нитрование – замена атома водорода в углеводородах на группу NО2:
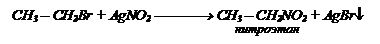 Взаимодействие галогенопроизводных с нитритом серебра AgNО2:
Взаимодействие галогенопроизводных с нитритом серебра AgNО2: Восстановление нитросоединений, при этом получаются амины:
Восстановление нитросоединений, при этом получаются амины:
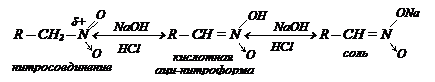 При действии щелочей первичные и вторичные нитросоединения образуют новую форму нитросоединения - кислую, которая затем переходит в соль, в которой органический остаток играет роль аниона. При осторожном действии кислоты на эту соль вновь получается через некоторое время исходный продукт:
При действии щелочей первичные и вторичные нитросоединения образуют новую форму нитросоединения - кислую, которая затем переходит в соль, в которой органический остаток играет роль аниона. При осторожном действии кислоты на эту соль вновь получается через некоторое время исходный продукт:
 Нитрогруппа резко повышает кислотность стоящих в о-,n-положениях групп ОН. Соединение (III) называется пикриновой кислотой, она сильнее угольной кислоты (Н2СО3), образует соли – пикраты:
Нитрогруппа резко повышает кислотность стоящих в о-,n-положениях групп ОН. Соединение (III) называется пикриновой кислотой, она сильнее угольной кислоты (Н2СО3), образует соли – пикраты: - вторичные
- вторичные

 Производные толуола называются толуидинами:
Производные толуола называются толуидинами:








