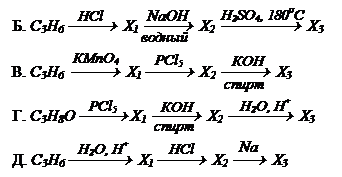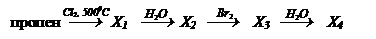 ® метиловый спирт. М.н. – метанол.
® метиловый спирт. М.н. – метанол.
 ® этиловый спирт, этанол.
® этиловый спирт, этанол.
 ®пропиловый спирт. М.н.пропанол –1.
®пропиловый спирт. М.н.пропанол –1.
 ®изопропиловый спирт. М.н.пропанол–2.
®изопропиловый спирт. М.н.пропанол–2.
Рациональная номенклатура. К названию радикала прибавляется слово спирт. Спирты более сложного строения рассматриваются как производные метилового спирта. Называются радикалы и прибавляются слово метанол. Например:
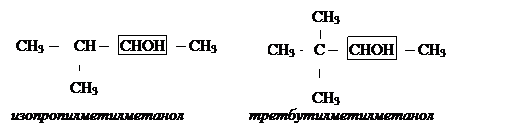
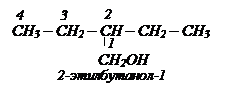
 Международная (систематическая) номенклатура. В основе названия лежит самая длинная цепь углеродных атомов, в которой находится группа ОН. К названию алкана этой цепи прибавляется окончание ОЛ. Нумеруется длинная цепь с того конца, к которому ближе расположена группа ОН. В конце пишется номер углеродного атома, при котором находится группа ОН.
Международная (систематическая) номенклатура. В основе названия лежит самая длинная цепь углеродных атомов, в которой находится группа ОН. К названию алкана этой цепи прибавляется окончание ОЛ. Нумеруется длинная цепь с того конца, к которому ближе расположена группа ОН. В конце пишется номер углеродного атома, при котором находится группа ОН.
В названии непредельных спиртов вначале называются радикалы, затем пишется название непредельного углеводорода (окончание ен или ин), в конце пишется окончание ОЛ с наименьшим номером.
Изомерия. Изомерия спиртов обусловлена строением углеродного скелета и положением группы ОН. Например, написать формулы изомеров спиртов состава спиртов С4Н9ОН. Вначале необходимо написать формулу спиртов с неразветвленной цепью, располагая у разных углеродных атомов группу ОН.
СН3 – СН2 – СН2 – СН2ОН – первичный бутиловый спирт
Р.н. пропилметанол; М.н. бутанол-1
СН3 – СН2 – СНОН – СН3 – вторичный бутиловый спирт
Р.н. метилэтилэтанол; М.н. бутанол-2
 Затем сокращаем цепочку на один С атом, изменяя положение группы ОН.
Затем сокращаем цепочку на один С атом, изменяя положение группы ОН.

Закрепление. Назовите по двум номенклатурам следующие спирты

Напишите структурные формулы спиртов и назовите:

а) 2-метилпентанол-3;
б) 3,5-диметилгексанол-3;

в) бутилметилметанол;
г) вторбутилдиметилметанол.
11.2 Способы получения спиртов.
Гидратация (т.е. присоединение Н2О) алкенов. Присоединение Н2О идет по правилу Марковникова:
СН2 = СН2 + НОН ¾® СН3 – СН2ОН
СН3 – СН = СН2 + НОН ¾® СН3 – СНОН – СН3
По этой реакции получается только один первичный спирт этиловый из этилена, а из остальных алкенов получаются вторичные и третичные спирты.
Гидролиз галогенопроизводных.
RX + HOH ↔ ROH + HX
СН3 – СНCl – CH3+ HOH ↔ CН3 – СНОН – СН3 + HCl.
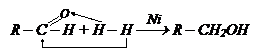 Восстановление альдегидов и кетонов.
Восстановление альдегидов и кетонов.
Вывод: при восстановлении альдегидов получаются первичные спирты, а кетонов – вторичные.
11.3 Физические свойства спиртов. Ассоциация спиртов. Водородная связь. Спирты состава C1 – С11 – жидкости, начиная с С12 – твердые вещества. Спирты С1 – С3 имеют алкогольный запах. Спирты с С4 имеют неприятный запах. Высшие спирты не имеют запаха. Спирты С1 – С3 – смешиваются с Н2О в любых соотношениях. Высшие спирты – нерастворимы в Н2О.
Молекулы спиртов, как и молекулы Н2О, ассоциированы (объединены друг с другом) за счет водородных связей. Водородная связь обозначается тремя точками между атомами:
Водородная связь возникает за счет атома Н от одной молекулы и электроотрицательных атомов (О, N, F и др.) другой молекулы. Происходит электростатическое притяжение частиц, имеющих частично d+ и d- зарядов. Энергия этой связи не превышает 20-30 кДж/моль и меньше примерно в 20 раз обычной ковалентной связи и уже при испарении спиртов легко разрывается. При растворении спиртов в воде, возникают водородные связи с молекулами Н2О. Чем меньше разветвлена углеродная цепь спирта, тем легче осуществляется ассоциация, тем выше температура кипения. Например: C4Н9ОН.

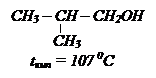
Чем меньше радикалов связано с С атомом, при котором находится группа ОН, тем легче эти спирты ассоциируются
Поэтому спирты нормального строения кипят при более высокой температуре, чем изостроения.
11.4 Химические свойства спиртов. Спирты – активные химические соединения. Объясняется это наличием группы ОН, т.к. связи С – О и О – Н поляризованы и разрываются
Сδ+ † О δ- † Н δ+
Кислотные свойства спиртов. Образование алкоголятов. Спирты – нейтральные вещества, не изменяют окраски индикаторов, как и Н2О, не вступают в реакции с растворами щелочей, разбавленными растворами кислот. Однако спирты взаимодействуют с щелочными металлами (медленнее чем с Н2О), вытесняя Н2, образуя алкоголяты:
2Н – ОН + 2Na ® 2NaOH + H2 (бурно);
2R – OH + 2Na ® 2RONa + H2 (в общем виде);
2СН3 – СН2ОН + 2Na ® 2СН3 – СН2ОNa + Н2 (слабее)
этилат Na
Если к алкоголяту натрия прилить Н2О, то образуется сильно щелочная среда.
Следовательно, прошел процесс гидролиза. Гидролизу подверглась соль, значит, алкоголяты – это соли. А т.к. в процессе гидролиза образуется сильное основание NaОН, следовательно, спирт является кислотой, но кислотой слабой.
Вывод: Кислотные свойства спиртов обусловлены способностью отщеплять протон Н+ и чем легче отщепляется Н+, тем ярче выражены кислотные свойства. Кислотные свойства спиртов выражены слабее, чем у Н2О.
Сравним по кислотным свойствам спирты СН3ОН и (СН3)3ОН.
У третичного спирта (II) кислотные свойства выражены слабее, т.к. группа СН3 – электронодонорная (+Jэф) – поставщик электронов поставляет их атому Оd-, увеличивая на нем d-, снижая поляризацию связи О – Н затрудняя тем самым отщепление Н+, т.е. ē - донорные группы уменьшают кислотность. Для увеличения кислотности в радикал вводится акцепторные группы, атомы. Они на себя оттягивают электронную плотность, усиливая способность отщепления Н+, а следовательно и кислотные свойства. Например:
Этот спирт более сильная кислота, чем угольная (H2CO3), разлагает соли угольной кислоты. Итак, расположим спирты в ряд по уменьшению кислотности

Основные свойства проявляются при взаимодействии спиртов с сильными кислотами.
ROH + HBr ↔ RBr + Н2О
Следовательно, спирты - амфотерные соединения.
Образование простых эфиров – взаимодействием алкоголят с галогенопроизводными.
RONa + RX ® R – O – R + NaX
CH3 – CH2O Na + CH3 – СH2 Cl ® CH3 – CH2 – O – CH2 – CH3
-NaCl
Образование сложных эфиров (реакция этерификации)- реакция взаимодействия спиртов с кислотами (неорганическими и органическими).
СН3 – СН2О Н + НО SO3H ↔ CH3 – CH2OSO3H + H2O
 этилсерная кислота
этилсерная кислота
Дегидратация спиртов:
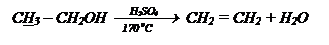 а) внутримолекулярная - образование алкена
а) внутримолекулярная - образование алкена
 б) межмолекулярная - образование простых эфиров
б) межмолекулярная - образование простых эфиров
Окисление спиртов(КМnО4 +H2SO4 или K2Cr2O7+ H2SO4

 а) первичные спирты окисляются до альдегидов
а) первичные спирты окисляются до альдегидов
 б) вторичные окисляются до кетонов
б) вторичные окисляются до кетонов
 Каталитическое дегидрирование спиртов (отнятие Н2).
Каталитическое дегидрирование спиртов (отнятие Н2).
Реакция Чугаева – Церевитинова. Этой реакцией можно определить число группы ОН в спирте путем взаимодействия спирта с магнийорганическим соединением.
R – OH + CH3 MgJ ® ROMgJ + CH4
Зная навеску исследуемого вещества и измерив объем выделившегося СН4, можно определить число группы ОН в спирте.
11.5 Метиловый спирт. Метанол. СН3ОН.
 Метиловый спирт – бесцветная жидкость со специфическим запахом, tкип=64,700 С, r=0,79 г/мл, хорошо растворяется в воде, является растворителем органических веществ, токсичен в любых дозах, в малых количествах вызывает слепоту, в больших – смерть. В промышленности метиловый спирт получают из синтез-газа:
Метиловый спирт – бесцветная жидкость со специфическим запахом, tкип=64,700 С, r=0,79 г/мл, хорошо растворяется в воде, является растворителем органических веществ, токсичен в любых дозах, в малых количествах вызывает слепоту, в больших – смерть. В промышленности метиловый спирт получают из синтез-газа:
Раньше получали его при сухой перегонке древесины или древесных отходов, поэтому он называется древесным спиртом. Метиловый спирт используется для получения формальдегида, полимерных материалов, как растворитель лаков, красителей, для получения высокоактанового топлива, как средство для введения в органические соединения алкильной группы СН3.
11.6 Этиловый спирт. Этанол (винный спирт). С2Н5ОН.
Бесцветная, легкоподвижная жидкость с характерным алкогольным запахом, жгучим вкусом, смешивается с водой в любых отношениях. Обычный спирт содержит 4,5% Н2О и является азеотропной смесью tк=78,150С, r=0,79 г/мл и называется ректификатом. Безводный спирт смешивается с бензином. Пары спирта при определенной концентрации образуют взрывоопасные смеси. Спирт является хорошим растворителем многих органических веществ, обладает антисептическими свойствами. В промышленности получается: спиртовым брожением сахаристых веществ (получаемых из крахмала, клетчатки):
или берут целлюлозу (С6Н10О5)n, но при этом получается гидролизный (технический) спирт.
 Прямая гидратация этилена:
Прямая гидратация этилена:
 Восстановлением уксусного альдегида, получаемого гидратацией ацетилена:
Восстановлением уксусного альдегида, получаемого гидратацией ацетилена:
Этиловый спирт используется в производстве взрывчатых веществ, синтетического каучука, для изготовления лаков и красок, в медицине, при изготовлении лекарственных препаратов, в парфюмерии, в пищевых продуктах, в качестве топлива для двигателей, для производства пластмасс. Этиловый спирт – сильный наркотик, попадая в организм вызывает нарушения нормального состояния человека, а постоянное употребление вызывает тяжелые заболевания нервной и сердечнососудистой систем. Острое отравление этанолом может вызвать смерть.
11.7 Аллиловый спирт. СН2 = СН – СООН – является непредельным одноатомным спиртом. Это бесцветная жидкость, с неприятным запахом, tкип=97,5 0С, растворим в воде. В промышленности получается:
- гидролизом аллилхлорида:
СН2 = СН – СН2Cl + НОН ¾® СН2 = СН – СН2ОН + НCl
 - окислением пропилена:
- окислением пропилена:
Непредельные спирты проявляют свойства одноатомных спиртов и непредельных углеводородов.

Аллиловый спирт применяется в парфюмерной промышленности.
11.8 Обучающее задание №1.
Гидратацией каких алкенов можно получить
2-метилпентанол-2?
 Решение: Вначале пишем формулу спирта:
Решение: Вначале пишем формулу спирта:
 Определяем месторасположения двойной связи, учитывая, что гидратация осуществляется по правилу Марковникова, сущность которого заключается в следующем: атом водорода присоединяется к углеродному атому по месту расположения двойной связи, у которого больше атомов водорода. Следовательно, (=) связь может быть расположена между первым и вторым углеродным атомом или между вторым и третьим:
Определяем месторасположения двойной связи, учитывая, что гидратация осуществляется по правилу Марковникова, сущность которого заключается в следующем: атом водорода присоединяется к углеродному атому по месту расположения двойной связи, у которого больше атомов водорода. Следовательно, (=) связь может быть расположена между первым и вторым углеродным атомом или между вторым и третьим:

Обучающее задание №2.
Напишите схему превращения:
 Решение:
Решение:
Обучающее задание №3.
| СН º СН ¾® СН3 – СН2 – СН2 – СН2ОН
| |
Предложите пути получения из ацетилена бутанол-1.
Решение: в ацетилене содержатся два углеродных атома, а в бутаноле-1 четыре. Следовательно, нужно удлинить цепь на два углеродных атома, а главное, группа ОН должна находиться у первичного С атома. Это можно осуществить через диеновые углеводороды. Вначале из ацитилена получаем этиловый спирт
 Из этилового спирта получаем бутадиен-1,3.
Из этилового спирта получаем бутадиен-1,3.
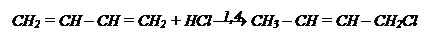 На бутадиен действуем НCl. Реакцию проводим по механизму присоединения 1,4.
На бутадиен действуем НCl. Реакцию проводим по механизму присоединения 1,4.
Освобождаемся от двойной связи действием Н2.
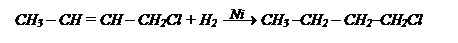
Проводим гидролиз галогенопроизводного

Обучающее задание №4.
Осуществите превращения:
Решение:
Обучающее задание №5.
Осуществите превращения этилового спирта в гексин-3, используя неорганические реагенты.
Решение:
| |
| | | СН3 – СН2ОН ¾® СН3 – СН2 – С º С – СН2 – СН3
| |
 Так как необходимо получить алкин и с большим количеством углеродных атомов, то это возможно осуществить через ацетилениды, следовательно, необходимо получить вначале ацетилен из этилового спирта.
Так как необходимо получить алкин и с большим количеством углеродных атомов, то это возможно осуществить через ацетилениды, следовательно, необходимо получить вначале ацетилен из этилового спирта.
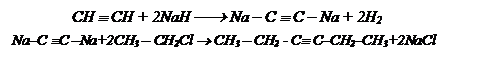
Обучающее задание №6.
При межмолекулярной дегидратации 30 г одноатомного спирта неизвестного состава выделилось 3,6 г воды, причем выход реакции составил 80% от теоретического. Каково строение исходного спирта, если известно, что в его молекуле имеются две метиленовые группы.
 Решение: Пишем уравнение реакции межмолекулярной дегидратации спирта
Решение: Пишем уравнение реакции межмолекулярной дегидратации спирта
 Определяем теоретический выход воды:
Определяем теоретический выход воды:

 mт=3,6/0,8 = 4,5 г n(Н2О) = 4,5/18 = 0,25 моль
mт=3,6/0,8 = 4,5 г n(Н2О) = 4,5/18 = 0,25 моль
Подставляем в уравнение реакции это количество над Н2О. Следовательно, n(СnН2n + 1ОН) = 0,5 моль
Определяем молярную массу спирта:
М(СnН2n + 1ОН) = m/n; М(СnН2n + 1ОН) = 30/0,5 = 60 г/моль. 14n + 1 + 17 = 60 n=3. Формула спирта – С3Н7ОН. Структурная формула:
СН3 – СН2 – СН2ОН. В ней две группы СН2 (метиленовые).
Обучающее задание №7.
Вычислите массу калия и количество вещества метанола, которое необходимо взять для приготовления 10 г 5%-го раствора метилата калия в метаноле.
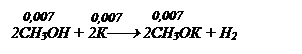 Решение:
Решение:
 Определяем количество вещества СН3ОК по формуле:
Определяем количество вещества СН3ОК по формуле:
Это количество подставляем в уравнение над СН3ОК, следовательно n(К) = n(СН3ОН) = 0,007 моль.
m(К) = n (К) * М(К) = 0,007 * 39 = 0,279 г m(СН3ОК)=10*0,05=
= 0,5г. Определяем массу метилового спирта, а так как раствор СН3ОК готовится в метаноле m(СН3ОН) = 10 – m (СН3ОК)=10– 0,5= = 9,5 г. n(СН3ОН) = 9,5/32 = 0,297 моль.
Находим общее количество СН3ОН:
n(СН3ОН) = 0,297 + 0,007 = 0,304 моль.
Ответ: 0,304 моль СН3ОН, 0,297 г К.
Обучающее задание №8.
При взаимодействии 9,2 мл этилового спирта с массовой долей 95% r=0,79 г/мл с 9,1 мл 63% раствора уксусной кислоты r=1,05 г/мл в присутствии катализатора серной кислоты получился эфир. Определите массу эфира, если его выход составил 80%.
Решение: пишем уравнение реакции:
Определяем количество исходных веществ по формуле: 


Подставляем данные количества веществ в уравнение реакции и определяем количество эфира по недостатку вещества, т.е. СН3СООН.
n(эф)=0,1 моль m(эф)=0,1*88=8,8 г
Это масса эфира теоретически полученная по уравнению реакции. Определяем практически полученную массу:
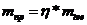 mпр=0,8*8,8=7,04 г. Ответ: 7,04 г.
mпр=0,8*8,8=7,04 г. Ответ: 7,04 г.
Обучающее задание №9.
На смесь этилового и пропилового спиртов массой 30,4 г подействовали избытком калия, при этом выделилось 6, 72 л водорода (н.у.). Определите массовую долю спиртов в исходной смеси.
 Решение:
Решение:
Определим n(Н2), выделившегося из 2-х реакций по формуле 

Обозначим: n(C2Н5ОН) = х моль, тогда n(Н2)=0,5х (I)
В уравнении (II) n(Н2)=(0,3 – 0,5х) моль, тогда n(С3Н7ОН) = =2(0,3-0,5х) = 0,6-х (моль) (II). Находим массу спиртов:
m(C2Н5ОН) = n(C2Н5ОН)*М(С2Н5ОН) = 46х (г)
m(С3Н7ОН) = n(С3Н7ОН)*М(С3Н7ОН) = (0,6 - х)*60 (г)
Составим уравнение:
46х + (0,6 - х)*60 = 30,4 (моль) х=0,4 (моль)
m(С2Н5ОН) = 46*0,4 = 18,4 (г) w(С2Н5ОН) = 
 т(С3Н7ОН) = (0,6 – 0,4)*60 = 12 (г)
т(С3Н7ОН) = (0,6 – 0,4)*60 = 12 (г)
Ответ: w(С2Н5ОН) = 60,5%; w(С3Н7ОН) = 39,5%.
Обучающее задание №10.
Порцию пропанол-1 дегидратировали в присутствии катализатора. Объем продуктов реакции после удаления паров воды составил 23,15 л (110 КП, 110 0С), а масса 45,6 г. Вычислите массу спирта, вступившего в реакцию (дегидратация прошла по внутримолекулярному и межмолекулярному типам).
Решение: напишем уравнения реакций дегидратаций:
Определим количество продуктов реакций (I,II) при н.у. по формуле: PV=nRT; 
Определяем молярную массу смеси:
Обозначим: n((C3Н7)2О) = х моль; n(С3Н6) = (0,8 - х) моль
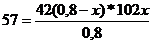 х = 0,2 моль
х = 0,2 моль
n((C3Н7)2О) = 0,2 моль n(С3Н6) = (0,8 – 0,2) = 0,6 моль
Подставим данные в уравнения (I,II). Тогда, в уравнении (I): n(С3Н7ОН) = 0,6 моль, в уравнении (II): n(С3Н7ОН) = 0,4 моль.
Общее количество С3Н7ОН будет равно:
n(С3Н7ОН) = 0,6 + 0,4 = 1 моль m(С3Н7ОН) = 1*60 = 60 г
Ответ:6 0г.
Вопросы для самоконтроля знаний.
1. Какие соединения называются спиртами? Их общая формула.
2. Чем обусловлена изомерия одноатомных предельных спиртов?
3. Название спиртов по рациональной и международной номенклатурам.
4. Способы получения спиртов.
5. Физические свойства спиртов. Ассоциации спиртов. Водородная связь.
6. Химические свойства спиртов.
7. Чем обусловлены кислотные свойства спиртов?
8. Почему спирты являются амфотерными соединениями? Напишите соответствующие уравнения реакций.
9. Как влияют на кислотные свойства спиртов донорные и акцепторные группы?
10. Расположите в ряд по уменьшению кислотных свойств следующие спирты:
а) СН3–СНОН–СН3; б) СН3–СН2ОН;
в) СН2ОН – СН2ОН; г) СН3ОН;
11. Метиловый спирт, получение, свойства, применение.
12. Этиловый спирт, получение, свойства, применение.
1З. Непредельные спирты. Аллиловый спирт.
14. Напишите уравнения реакций взаимодействия:
а) изопропилового спирта с Na;
б) этилата Na с хлористым изопропилом;
в) окислите 2–метилпропанол–1, пропанол–2;
г) пропилового спирта с уксусной кислотой;
д) дегидрирование изопропилметилметанола.
15. Осуществить превращения:
 а) СН4 ® СН3 – СН2ОН ® СН3 – СН2 – О – СН2 – СН3
а) СН4 ® СН3 – СН2ОН ® СН3 – СН2 – О – СН2 – СН3
16. Установите формулу предельного одноатомного спирта, если при действии избытком натрия на 18,5 г. спирта выделилось 2,8 л Н2 (н.у.)
17. Установите формулу предельного одноатомного спирта, если 43 г. этого спирта выделили при дегидратации 8,8 г. Н2О.
18. Определите объем раствора этилового спирта 95%-ного r( )=0,8 г/мл вступившего в реакцию с избытком Na, если при этом выделилось 6,72 л Н2 (н.у.)
)=0,8 г/мл вступившего в реакцию с избытком Na, если при этом выделилось 6,72 л Н2 (н.у.)
Ответ: 36,3 мл.
19. Сколько литров кислорода потребуется для полного сгорания 23 г этилового спирта? Сколько граммов едкого натрия может вступить в реакцию с выделившимся углекислым газом, если образуется при этом средняя соль?
Ответ: 33,6 О2; 800 г раствора NаОН.
20. При действии на смесь этилового и пропильного спиртов массой 30,4 г избытком Na выделилось 6,72 л водорода (н.у.). Определите массовую долю спиртов в исходной смеси?
Ответ: 60,5% С2Н5ОН; 39,5 С3Н7ОН.
21. Вычислите какой объем 3-метилбутанол-1 (ρ=0,812 г/мл) можно получить из 10 г соответствующего йодалкана, если выход продукта реакции составил 60%.
Ответ: 3,28 мл.
22. Определите массовые доли веществ в растворе, который получится при добавлении 1 г Н2О к 75 г 6% раствору этилата натрия в этаноле.
Ответ: 2,92% NаОН; 96,1% С2Н5ОН; 0,951% С2Н5ОNа.
11. 10 Контрольное задание №1.
Контрольное задание №2.
| Предложите схемы синтезов:
|
| А.ацетилен ¾® диэтиловый эфир
| 1)гидролиз, дегидратация, гидратация, межмолекулярная дегидратация
|
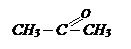 Б.пропанол-1 ¾®
Б.пропанол-1 ¾®
| 2)гидрирование, гидратация, межмолекулярная дегидратация
|
| В.пропанол-1 ¾® диизопропиловый эфир
| 3)электрокрекинг, гидрирование, гидратация
|
| Г.пропанол-1 ¾® 2,3-диметилбутан
| 4)гидратация, гидрирование, межмолекулярная дегидратация
|
| Д.метан ¾® этиловый спирт
| 5)дегидратация, гидрохлорирование, реакция Вюрца
|
| Е.1-хлорпропан ¾® пропилизопропиловый эфир
| 6)дегидратация, гидратация, окисление
|
| Ж.пропин ¾® диизопропиловый эфир
| 7)дегидратация, гидратация, межмолекулярная дегидратация
|
| Напишите все указанные уравнения реакций.
|
Контрольное задание №3.
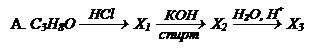 Расшифруйте схемы следующих превращений:
Расшифруйте схемы следующих превращений:
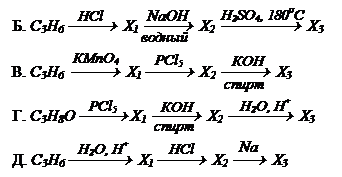
|
| Х1
| Х2
| Х3
|
|
| С3Н8О
| С3Н7Сl
| С6Н14
|
|
| С3Н7Сl
| С3Н6
| С3Н8О
|
|
| С3Н7Сl
| С3Н8О
| С3Н6
|
|
| С3Н8О
| С3Н7Сl
| С3Н6
|
|
| С3Н7Сl
| С3Н6
| С3Н8О
|
| Напишите все уравнения реакций. Определите структурные формулы веществ Х1, Х2, Х3
|
Контрольное задание №4.
1. Напишите структурные формулы изомеров спиртов состава С5Н11ОН.
2. Осуществите превращения
а) СН4 ¾® Х1 ¾® С2Н5 – О – С2Н5;
б) бутанол-1 ¾® бутанол-2;

в)
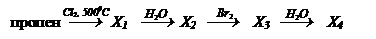
г)
3. Используя исходное вещество и неорганические реагенты получите из:
а) этана ¾® бутанол-2; б) метана ¾® изопропиловый спирт; в) ацетилена ¾® бутанол-1; г) метана ¾® бензиловый спирт; д) 1-хлорбутана ¾® бутанол-2.
4. Определите объем 95% этилового спирта (r=0,8 г/мл) вступившего в реакцию с избытком натрия, если при этом выделилось 6,72 л водорода (н.у.).
Ответ: 36,3 мл
5. Сколько литров кислорода потребуется для полного сгорания 23 г этилового спирта? Определите массу 10% раствора гидроксида натрия, которая может вступить в реакцию с выделившимся углекислым газом, если образуется средняя соль.
Ответ: 33,6 л О2 800 г раствора NaОН
6. При действии на смесь этилового и пропилового спиртов массой 60,8 г избытком натрия выделилось 13,44 л газа (н.у.). Определите массовую долю спиртов в исходной смеси.
Ответ: 60,5% С2Н5ОН, 39,5% С3Н7ОН
7. Вычислите какой объем 3-метил-бутанол-1
(r=0,812 г/мл) можно получить из 10 г соответствующего йодалкана, если выход продукта реакции составил 60%.
Ответ: 3,28 мл
8. Определите массовые доли веществ в растворе, который получится при добавлении 1 г воды к 75 г 6% раствору этилата натрия в этаноле.
Ответ: 2,92% NаОН; 96,1% С2Н5ОН;
0,951% С2Н5ОNа.
9. К 96% водному раствору этанола объемом 112,5 мл
(r=0,8 г/мл) добавили 5,6 г натрия. Рассчитайте массовые доли веществ в растворе после окончания реакции.
Ответ: 88,52% С2Н5ОН; 8,36% NаОН; 3,09% С2Н5ОNа.
10. Предельный одноатомный спирт массой 44,4 г обработали серной концентрированной кислотой при нагревании. Внутримолекулярная дегидратация прошла с выходом 75%. Выделившийся газ пропустили через избыток щелочного раствора перманганата калия, при этом выпал осадок массой 26,1 г. Установите строение спирта, если известно, что при его окислении образуется кетон.
Ответ: бутанол-2.
11. Сожгли 15,2 г смеси этилового и пропилового спиртов и выделившийся газ пропустили через раствор гидроксида кальция. При этом выпал осадок массой 70 г. Рассчитайте массовую долю спиртов в исходной смеси.
Ответ: 60,5% С2Н5ОН; 39,5% С3Н7ОН.
12. Вычислите количество этанола и массу натрия, которые необходимы взять для приготовления 20 г 5% раствора этилата натрия в этаноле.
Ответ: 0,425 моль С2Н5ОН; 0,345 г Na.



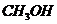 ® метиловый спирт. М.н. – метанол.
® метиловый спирт. М.н. – метанол. ® этиловый спирт, этанол.
® этиловый спирт, этанол. ®пропиловый спирт. М.н.пропанол –1.
®пропиловый спирт. М.н.пропанол –1. ®изопропиловый спирт. М.н.пропанол–2.
®изопропиловый спирт. М.н.пропанол–2.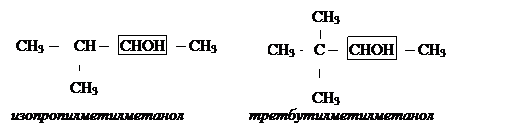
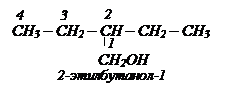
 Международная (систематическая) номенклатура. В основе названия лежит самая длинная цепь углеродных атомов, в которой находится группа ОН. К названию алкана этой цепи прибавляется окончание ОЛ. Нумеруется длинная цепь с того конца, к которому ближе расположена группа ОН. В конце пишется номер углеродного атома, при котором находится группа ОН.
Международная (систематическая) номенклатура. В основе названия лежит самая длинная цепь углеродных атомов, в которой находится группа ОН. К названию алкана этой цепи прибавляется окончание ОЛ. Нумеруется длинная цепь с того конца, к которому ближе расположена группа ОН. В конце пишется номер углеродного атома, при котором находится группа ОН.
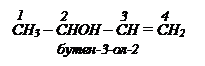
 Затем сокращаем цепочку на один С атом, изменяя положение группы ОН.
Затем сокращаем цепочку на один С атом, изменяя положение группы ОН.

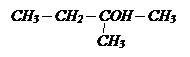

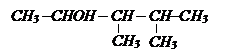
 а) 2-метилпентанол-3;
а) 2-метилпентанол-3;
 в) бутилметилметанол;
в) бутилметилметанол;
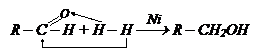 Восстановление альдегидов и кетонов.
Восстановление альдегидов и кетонов.


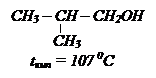


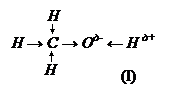



 этилсерная кислота
этилсерная кислота
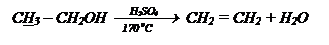 а) внутримолекулярная - образование алкена
а) внутримолекулярная - образование алкена б) межмолекулярная - образование простых эфиров
б) межмолекулярная - образование простых эфиров
 а) первичные спирты окисляются до альдегидов
а) первичные спирты окисляются до альдегидов б) вторичные окисляются до кетонов
б) вторичные окисляются до кетонов Каталитическое дегидрирование спиртов (отнятие Н2).
Каталитическое дегидрирование спиртов (отнятие Н2).
 Метиловый спирт – бесцветная жидкость со специфическим запахом, tкип=64,700 С, r=0,79 г/мл, хорошо растворяется в воде, является растворителем органических веществ, токсичен в любых дозах, в малых количествах вызывает слепоту, в больших – смерть. В промышленности метиловый спирт получают из синтез-газа:
Метиловый спирт – бесцветная жидкость со специфическим запахом, tкип=64,700 С, r=0,79 г/мл, хорошо растворяется в воде, является растворителем органических веществ, токсичен в любых дозах, в малых количествах вызывает слепоту, в больших – смерть. В промышленности метиловый спирт получают из синтез-газа: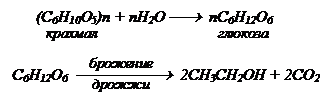
 Прямая гидратация этилена:
Прямая гидратация этилена: Восстановлением уксусного альдегида, получаемого гидратацией ацетилена:
Восстановлением уксусного альдегида, получаемого гидратацией ацетилена:
 - окислением пропилена:
- окислением пропилена:
 Решение: Вначале пишем формулу спирта:
Решение: Вначале пишем формулу спирта: Определяем месторасположения двойной связи, учитывая, что гидратация осуществляется по правилу Марковникова, сущность которого заключается в следующем: атом водорода присоединяется к углеродному атому по месту расположения двойной связи, у которого больше атомов водорода. Следовательно, (=) связь может быть расположена между первым и вторым углеродным атомом или между вторым и третьим:
Определяем месторасположения двойной связи, учитывая, что гидратация осуществляется по правилу Марковникова, сущность которого заключается в следующем: атом водорода присоединяется к углеродному атому по месту расположения двойной связи, у которого больше атомов водорода. Следовательно, (=) связь может быть расположена между первым и вторым углеродным атомом или между вторым и третьим:

 Решение:
Решение:
 Из этилового спирта получаем бутадиен-1,3.
Из этилового спирта получаем бутадиен-1,3.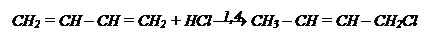 На бутадиен действуем НCl. Реакцию проводим по механизму присоединения 1,4.
На бутадиен действуем НCl. Реакцию проводим по механизму присоединения 1,4.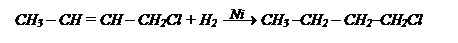

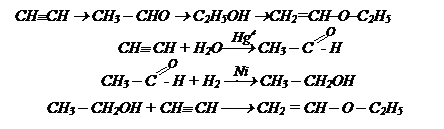
 Так как необходимо получить алкин и с большим количеством углеродных атомов, то это возможно осуществить через ацетилениды, следовательно, необходимо получить вначале ацетилен из этилового спирта.
Так как необходимо получить алкин и с большим количеством углеродных атомов, то это возможно осуществить через ацетилениды, следовательно, необходимо получить вначале ацетилен из этилового спирта.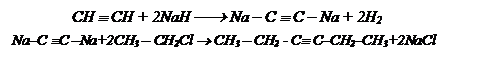
 Решение: Пишем уравнение реакции межмолекулярной дегидратации спирта
Решение: Пишем уравнение реакции межмолекулярной дегидратации спирта Определяем теоретический выход воды:
Определяем теоретический выход воды:
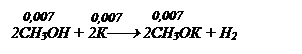 Решение:
Решение: Определяем количество вещества СН3ОК по формуле:
Определяем количество вещества СН3ОК по формуле:
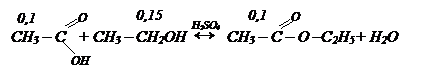



 mпр=0,8*8,8=7,04 г. Ответ: 7,04 г.
mпр=0,8*8,8=7,04 г. Ответ: 7,04 г. Решение:
Решение:


 т(С3Н7ОН) = (0,6 – 0,4)*60 = 12 (г)
т(С3Н7ОН) = (0,6 – 0,4)*60 = 12 (г)



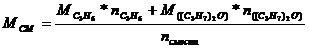
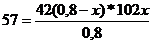 х = 0,2 моль
х = 0,2 моль а) СН4 ® СН3 – СН2ОН ® СН3 – СН2 – О – СН2 – СН3
а) СН4 ® СН3 – СН2ОН ® СН3 – СН2 – О – СН2 – СН3 )=0,8 г/мл вступившего в реакцию с избытком Na, если при этом выделилось 6,72 л Н2 (н.у.)
)=0,8 г/мл вступившего в реакцию с избытком Na, если при этом выделилось 6,72 л Н2 (н.у.) 1)
1)
 2)
2)
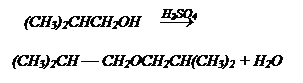 3)
3)
 4)
4)
 6)
6)
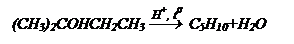 8)
8)
 9)
9)
 10)
10)
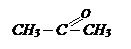 Б.пропанол-1 ¾®
Б.пропанол-1 ¾®
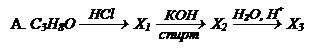 Расшифруйте схемы следующих превращений:
Расшифруйте схемы следующих превращений: