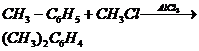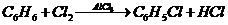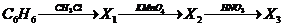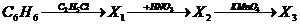Каталитическое гидрирование.


+ 3Н
2 ¾®¾
циклогексан
 Присоединение хлора при сильном освещении в отсутствии кислорода
Присоединение хлора при сильном освещении в отсутствии кислорода
Реакции окисления Бензол устойчив даже к таким сильным окислителям, как НNO3, хромовая смесь, раствор КMnO4, H2O2. При обычных условиях, они на него не действуют.
|
СН – СО
|| О
СН – СО
малеиновый ангидрид
| |
Но при действии О
2 воздуха при t
0=400
0С и в присутствии V
2O
5 он окисляется, образуя малеиновый ангидрид:

+ 4,5О
2 ¾® + 2СО
2 + 2Н
2О
При действии окислителей на гомологи бензола происходит окисление боковых цепей (алкильных радикалов). Какой бы сложной не была одна боковая цепь она окисляется до карбоксильной группы (- СOOH), образуя бензойную кислоту:




+ 3[О] ¾® + Н2О
+ 6[О] ¾® + СО
2 + 2Н
2О
+ 9[О] ¾® + 2СО2 + 3Н2О
бензойная кислота
Если гомолог бензола содержит две боковые цепи, то они окисляются до двухосновных ароматических кислот.




+ 6[О] ¾® + 2Н
2О
телефталевая кислота
8.9 Правила ориентации при электрофильном замещении в бензольном ядре. Если в бензольном ядре имеется заместитель, то при вступлении 2-го заместителя могут образоваться три изомера: -орто-, мета-, или пара-изомеры. Место вступления второго заместителя зависит от природы уже имеющегося в ядре заместителя. Все заместители по их ориентирующему действию делятся на 2 рода.
 Заместители I-го рода. К ним относятся группы:
Заместители I-го рода. К ним относятся группы:
OH > NH2 > OR > J > Br > Cl > F > R – орто-пара-ориентаторы, расположенные по силе их ориентирующего действия.Если в бензольном ядре стоит заместитель I-го рода, то любую другую группу он будет направлять в орто-пара-положения.
Например:
+ НОNО2 ¾® +
толуол о-нитротолуол n-нитротолуол
Заменители II рода. К ним относятся:

 О О
О О
С º N > C > C > NO2 > SO3H
ОН Н
мета-ориентаторы
Если в бензольном ядре находится заместитель 2-го рода, то любую группу будет направлять в м-положение.
Например:
+ СН3Cl ¾® + НCl
нитробензол м-нитротолуол
 Заместители I и II рода оказывают влияние на реакционную способность бензольного ядра. Заместители I рода (за исключением галогенов) активизируют бензольное ядро. Они являются электродонорными группами, отдающими электроны бензольному ядру, увеличивая электронную плотность в о- и n-положениях, поэтому в эти положения направляются вступающие группы.
Заместители I и II рода оказывают влияние на реакционную способность бензольного ядра. Заместители I рода (за исключением галогенов) активизируют бензольное ядро. Они являются электродонорными группами, отдающими электроны бензольному ядру, увеличивая электронную плотность в о- и n-положениях, поэтому в эти положения направляются вступающие группы.
Например:

 Толуол активнее, чем бензол >
Толуол активнее, чем бензол >
 Заместители II рода мета-ориентаторы являются электроноакцепторными группами, они оттягивают электроны из о- и n-положений, уменьшая тем самым активность бензольного ядра.
Заместители II рода мета-ориентаторы являются электроноакцепторными группами, они оттягивают электроны из о- и n-положений, уменьшая тем самым активность бензольного ядра.
 Новый заместитель вступает в м-положение, т.к. здесь электронная плотность несколько больше, чем в о- и n-положениях. Например: бензол активнее, чем нитробензол
Новый заместитель вступает в м-положение, т.к. здесь электронная плотность несколько больше, чем в о- и n-положениях. Например: бензол активнее, чем нитробензол
>
 8.10 Отдельные представители гомологов бензола. Толуол
8.10 Отдельные представители гомологов бензола. Толуол  - СH3 – бесцветная жидкость, легче воды. Больше половины производимого в промышленности толуола используют для получения бензола
- СH3 – бесцветная жидкость, легче воды. Больше половины производимого в промышленности толуола используют для получения бензола
+ H2 + СH4
Толуол применяется для производства красителей, лекарственных, взрывчатых веществ, синтетических моющих средств, капролактама. Он является растворителем для полимеров.
Этилбензол  -С2H5– бесцветная жидкость, применяется для производства стирола и как добавка к моторному топливу для повышения октанового числа.
-С2H5– бесцветная жидкость, применяется для производства стирола и как добавка к моторному топливу для повышения октанового числа.
Кумол (изопропилбензол)  - СH(СH3)2 – бесцветная жидкость, служит сырьем для получения фенола и ацетона.
- СH(СH3)2 – бесцветная жидкость, служит сырьем для получения фенола и ацетона.
Стирол  - СH=СH2 – бесцветная жидкость с приятным запахом, в воде нерастворима, легко полимеризуется. Может быть получен из этилбензола и окислительной конденсацией бензола и этилена в присутствии ацетата палладия:
- СH=СH2 – бесцветная жидкость с приятным запахом, в воде нерастворима, легко полимеризуется. Может быть получен из этилбензола и окислительной конденсацией бензола и этилена в присутствии ацетата палладия:
 + СH2= СH2
+ СH2= СH2
Химические свойства стирола определяются наличием бензольного ядра и двойной связи в боковой цепи. Применяется он для получения полимера полистирола, бутадиенстирольного каучука и АБС – пластиков.
8.11 Обучающее задание №5
Определите положение Br в бромтолуоле, зная, что при взаимодействии его с соответствующим алкилгалогенидом может быть получен о-ксилол. Напишите уравнение реакции.
 Решение: В исходном бромтолуоле бром должен находится в о-положении относительно СН3–, т.е.:
Решение: В исходном бромтолуоле бром должен находится в о-положении относительно СН3–, т.е.:
Далее получаем о-ксилол по реакции Вюрца-Фиттинга:
+ 2Na + Br – CH3 ¾® + 2NaBr
Обучающее задание №6
 Предложите схему синтеза n-нитротолуола и м-нитротолуола из метана.
Предложите схему синтеза n-нитротолуола и м-нитротолуола из метана.
Решение:
 СН4 ¾®; CH4 ¾®
СН4 ¾®; CH4 ¾®

Вначале необходимо получить бензол. Бензол можно получить тримеризацией ацетилена, который получаем электрокрекенгом метана:
2СН4 ¾® СН º СН +3Н2; 3СН º СН ¾¾®
Затем получаем СН
3Cl, хлорированием метана:
СН4 +Cl2 ¾® CH3Cl + HCl
 Так как два заместителя находятся в n-положении, то первым в бензольное ядро необходимо ввести группу СН3– (заместитель I рода), которая направит группу NO2 в n-положение:
Так как два заместителя находятся в n-положении, то первым в бензольное ядро необходимо ввести группу СН3– (заместитель I рода), которая направит группу NO2 в n-положение:
+ СН
3Cl ¾® + HCl
+ НО – NO2 ¾® + H2О
 Чтобы получить м-нитротолуол, необходимо первым в бензольное ядро ввести заместитель II рода, т.е. группу NO2, которая направит группу СН3 в м-положение.
Чтобы получить м-нитротолуол, необходимо первым в бензольное ядро ввести заместитель II рода, т.е. группу NO2, которая направит группу СН3 в м-положение.

 + НО – NO2 ¾® + H2O
+ НО – NO2 ¾® + H2O
+ CH
3Cl ¾® + H
2O
Обучающее задание №7
Осуществите превращения:


(n-положение)
Решение:
 + СН3 – СН2Cl ¾® + НCl
+ СН3 – СН2Cl ¾® + НCl
+ HO – NO2 ¾® + Н2О
+ [O] ¾® + CO2 + 2Н2О
В этом синтезе два заместителя II рода были введены в
n-положение.
Обучающее задание №8
При сжигании гомолога бензола массой 0.92 г в кислороде получили углекислый газ, который пропустили через раствор гидроксида кальция. При этом выпало 7 г осадка. Определите формулу арена?
Решение
: Пишем уравнение реакции в общем виде:

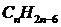 + (1,5n-1,5)O2 nCO2 + (n-3)H2O (1)
+ (1,5n-1,5)O2 nCO2 + (n-3)H2O (1)
Пропускаем выделившийся газ через Са(ОН)
2
 CO2 + Ca(OH)2 CaCO3 + H2O (2)
CO2 + Ca(OH)2 CaCO3 + H2O (2)
Определяем количество CaCO3 по формуле: 
 n(CaCO3) =
n(CaCO3) =  = 0,07(моль) – это значение подставляем в уравнение 2, а затем переносим в уравнение 1.
= 0,07(моль) – это значение подставляем в уравнение 2, а затем переносим в уравнение 1.
М( ) = 14n-6
) = 14n-6
Определяем количество арена:
n(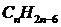 ) =
) = 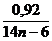 тогда
тогда  =
=  ; n=7
; n=7
Получаем формулу арена  ; или
; или  - толуол
- толуол
Обучающее задание №9
При окислении толуола горячим водным раствором перманганата калия (KMnO4) получили осадок массой 12,18г. Выход продукта окисления составил 70%. Определите массу толуола, взятого для окисления.
Решение: Пишем уравнение реакции:

 + 2KMnO4
+ 2KMnO4  + 2MnO2
+ 2MnO2  + 2KOH
+ 2KOH
Определяем количество MnO2 по формуле: 
n(MnO2) =  = 0,14 (моль) это практический выход. Определим теоретическое количество MnO2: n(MnO2) =
= 0,14 (моль) это практический выход. Определим теоретическое количество MnO2: n(MnO2) =  = 0,2 (моль) подставим в уравнение реакции над MnO2, тогда количество n (
= 0,2 (моль) подставим в уравнение реакции над MnO2, тогда количество n ( ) равно 0,1 моль. Находим массу толуола:
) равно 0,1 моль. Находим массу толуола:
m( ) =
) =  = 9,2 г Ответ: 9,2 г.
= 9,2 г Ответ: 9,2 г.
Обучающее задание №10
Углеводород А реагирует с азотной кислотой с образованием вещества  . При кипячении вещества А с раствором перманганата калия образуется соединение состава
. При кипячении вещества А с раствором перманганата калия образуется соединение состава  . Напишите уравнения реакций с использованием структурных формул, протекающих с веществом А и хлором на свету.
. Напишите уравнения реакций с использованием структурных формул, протекающих с веществом А и хлором на свету.
Решение: В веществе А после нитрования содержится три группы NO2, а при кипячении с KMnO4 образуется соль бензойной кислоты, следовательно это толуол. Подтвердим соответствующими уравнениями реакций:




+ 3HO – NO
2 O
2N NO
2
NO2
 + 2KMnO4
+ 2KMnO4  +2MnO2+KOH + H2O
+2MnO2+KOH + H2O
Действия хлора на свету:
 + Сl2 + HCl
+ Сl2 + HCl
хлористый бензил
Обучающее задание №11
Газ, выделившейся при бромировании бензола объемом
5 мл (плотностью 0,879 г/мл) был полностью поглощен избытком раствора нитрата серебра. При этом образовалось 6,58 г осадка. Вычислите выход (%) продукта реакции.
Решение: Пишем уравнение реакции бромирования бензола

 + Br2
+ Br2  + HBr (1).
+ HBr (1).
Определим количество бензола по формуле  ; n(
; n( )=
)=  =0,056(моль).n(C6H6)=n(HBr)=n(C6Н5Br)=
=0,056(моль).n(C6H6)=n(HBr)=n(C6Н5Br)=
=0,056(маль)-продуктов реакций(I) — теоретический выход.
Пишем уравнение реакции взаимодействия:
0,035 0,035
 HBr + AgNO3 HNO3 + AgBr (2).
HBr + AgNO3 HNO3 + AgBr (2).
Определим количество осадка AgBr
n(AgBr) = n(НВr) =  = 0,035 (моль).
= 0,035 (моль).
Следовательно по реакции (1) практически получилось n(HBr) = n( ) = 0,035 (моль) это практический выход. η(
) = 0,035 (моль) это практический выход. η( ) =
) =  ; η(
; η(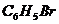 ) =
) =  = 62,5%
= 62,5%
Ответ: 62,5%
8.12 Вопросы для самоконтроля:
- Какие соединения называются аренами?
- Общая формула аренов.
- Формула Кекуле, ее недостатки.
- Природа ароматического состояния.
- Почему реакции замещения в аренах протекают легко, а присоединения трудно?
- Основные природные источники получения ароматических углеводородов.
- Назовите способы получения аренов из неароматических углеводородов, из ароматических.
- В чем заключается сущность реакции Фриделя-Крафтса?
- Физические свойства аренов.
- Типы реакций, характерные для аренов.
- Механизм реакций электрофильного замещения в аренах, в чем отличие его от механизма электрофильного присоединения к алкенам.
- Правило ориентации в бензольном ядре.
- Заместители I рода, их направляющее действие и влияние на бензольное ядро.
- Заместители II рода, их направляющее действие и влияние на бензольное ядро.
- Какое соединение активнее: а) бензол или этилбензол,
б) нитробензол или толуол, в) бензойная кислота или нитробензол, г) хлорбензол или толуол? - Какие вещества являются продуктами окисления:
а)бензола, б) гомологов бензола, имеющих в ядре один R. - Почему гомологи бензола окисляются легче, чем бензол?
- Расположите следующие соединения в ряд по уменьшению активности: бензол, толуол, бензойная кислота,
 , нитробензол, бензолсульфикислота.
, нитробензол, бензолсульфикислота. - Почему толуол легче вступает в реакции электрофильного замещения чем бензол?
- Напишите структурные формулы всех изомерных ароматических углеводородов состава
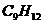
- Имеется смесь бензола и стирола (фенилэтилена). Как из этой смеси выделить бензол?
- Составьте уравнения реакций по схеме:







23. Осуществите превращения, используя неорганические реагенты:
 а) этилен м-хлорбензольную кислоту,
а) этилен м-хлорбензольную кислоту,
 б) углерод п-нитротолуол,
б) углерод п-нитротолуол,
в)  циклогексан бензолсульфокислоту
циклогексан бензолсульфокислоту
 г) метан м-нитроэтилбензол.
г) метан м-нитроэтилбензол.
24. Определить массу нитробензола, полученную из 15,6 г бензола и 14,5 г азотной кислоты, если выход нитробензола составил 80%. Ответ: 19,7 г
25. Установите формулу арена, если относительная плотность паров его по воздуху равна 4,14. Ответ: 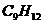
26. При действии брома на 15,6 г бензола было получено 30 г бромбензола. Определите выход бромбензола.
Ответ: 94,9%
27. Смесь бензола и циклогексена обесцвечивает 75 г 3,2% бромной воды. При сжигании такого же количества исходной смеси в избытке кислорода выделившийся углекислый газ пропустили через избыток раствора гидроксида кальция и получили 21 г осадка. Определите массовую долю компонентов в исходной смеси.
Ответ: 56%  ; 44%
; 44% 
28. При каталитическом дегидрировании смеси бензола, циклогексана и циклогексена получено 23,4 г бензола и выделилось 11,2 л водорода (н.у.). Известно, что исходная смесь в том же количестве может присоединить 16 г брома. Определите массовую долю каждого компонента в исходной смеси.
Ответ: 31,95%  ; 34,45%
; 34,45%  ; 33,6%
; 33,6% 
8.13 Контрольное задание №1
| Какие из указанных реакций являются реакцией:
|
| 1) нитрование толуола
2) электрофильного замещения
3) присоединения
4) галогенирования
5) сульфирования
6) Фриделя-Крафтса
7) получение толуола
8) получение ксилола
9) окисления
10) Вюрца-Фиттига
|  а) О а) О
СН3–С6Н4–С +NaОН ® С6Н5–СН3+
+Na2СО3 ОNa
б) 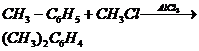
в) 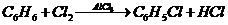
г) 
д) 
е) 
ж) 
з) 
и) 
|
Контрольнoе задание №2
| Укажите последовательность синтеза и необходимые реагенты для получения из бензола следующих соединений:
|
| А. n-бромбензойной кислоты
Б. м-бромнитробензола
В. о-хлорбензолсульфокислоты
Г. м-хлорбензойной кислоты
Д.
Е. n-нитробензойной кислоты
| 1) алкилирование СН3Cl, окисление КMnO4, хлорирование (Cl2).
2) хлорирование бензола (Cl2), действие Н2SO4
3) алкилирование (реакция Фриделя-Крафтса), нитрование (НNO3, H2SO4), окисление КMnO4
4) алкилирование СН3Cl, окисление KMnO4
5) бромирование (Br2), алкилирование (СН3Cl, AlCl3), окисление (KMnO4)
6) нитрование (НNO3, Н2SO4), бромирование (Br2)
|
Контрольное задание №3
| Расшифруйте следующие схемы превращений:
|
А.  Б.
Б.  В.
В. 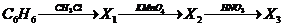 Г.
Г.  Д.
Д. 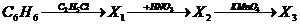
Е. 
Ж. 
| 1) ацетилен, бензол, нитробензол,
м-хлорнитробензол.
2) толуол, n-ксилол, фталевая кислота (2-х основная).
3) нитробензол,
м-этилнитробензол, м-нитробензойная кислота.
4) ацетилен, бензол, хлорбензол,
о-хлорнитробензол.
5) этилбензол,
о-нитроэтилбензол,
о-нитробензойная кислота.
6) ацетилен, бензол n-ксилол, фталевая кислота.
7) толуол, бензойная кислота, м-нитробензойная кислота.
|





 Присоединение хлора при сильном освещении в отсутствии кислорода
Присоединение хлора при сильном освещении в отсутствии кислорода

 + 4,5О2 ¾® + 2СО2 + 2Н2О
+ 4,5О2 ¾® + 2СО2 + 2Н2О












 Заместители I-го рода. К ним относятся группы:
Заместители I-го рода. К ним относятся группы:
 О О
О О

 Заместители I и II рода оказывают влияние на реакционную способность бензольного ядра. Заместители I рода (за исключением галогенов) активизируют бензольное ядро. Они являются электродонорными группами, отдающими электроны бензольному ядру, увеличивая электронную плотность в о- и n-положениях, поэтому в эти положения направляются вступающие группы.
Заместители I и II рода оказывают влияние на реакционную способность бензольного ядра. Заместители I рода (за исключением галогенов) активизируют бензольное ядро. Они являются электродонорными группами, отдающими электроны бензольному ядру, увеличивая электронную плотность в о- и n-положениях, поэтому в эти положения направляются вступающие группы. Толуол активнее, чем бензол >
Толуол активнее, чем бензол > Заместители II рода мета-ориентаторы являются электроноакцепторными группами, они оттягивают электроны из о- и n-положений, уменьшая тем самым активность бензольного ядра.
Заместители II рода мета-ориентаторы являются электроноакцепторными группами, они оттягивают электроны из о- и n-положений, уменьшая тем самым активность бензольного ядра. Новый заместитель вступает в м-положение, т.к. здесь электронная плотность несколько больше, чем в о- и n-положениях. Например: бензол активнее, чем нитробензол
Новый заместитель вступает в м-положение, т.к. здесь электронная плотность несколько больше, чем в о- и n-положениях. Например: бензол активнее, чем нитробензол
 8.10 Отдельные представители гомологов бензола. Толуол
8.10 Отдельные представители гомологов бензола. Толуол  - СH3 – бесцветная жидкость, легче воды. Больше половины производимого в промышленности толуола используют для получения бензола
- СH3 – бесцветная жидкость, легче воды. Больше половины производимого в промышленности толуола используют для получения бензола -С2H5– бесцветная жидкость, применяется для производства стирола и как добавка к моторному топливу для повышения октанового числа.
-С2H5– бесцветная жидкость, применяется для производства стирола и как добавка к моторному топливу для повышения октанового числа. - СH=СH2 – бесцветная жидкость с приятным запахом, в воде нерастворима, легко полимеризуется. Может быть получен из этилбензола и окислительной конденсацией бензола и этилена в присутствии ацетата палладия:
- СH=СH2 – бесцветная жидкость с приятным запахом, в воде нерастворима, легко полимеризуется. Может быть получен из этилбензола и окислительной конденсацией бензола и этилена в присутствии ацетата палладия:

 + СH2= СH2
+ СH2= СH2  Решение: В исходном бромтолуоле бром должен находится в о-положении относительно СН3–, т.е.:
Решение: В исходном бромтолуоле бром должен находится в о-положении относительно СН3–, т.е.:

 Предложите схему синтеза n-нитротолуола и м-нитротолуола из метана.
Предложите схему синтеза n-нитротолуола и м-нитротолуола из метана. СН4 ¾®; CH4 ¾®
СН4 ¾®; CH4 ¾®
 Так как два заместителя находятся в n-положении, то первым в бензольное ядро необходимо ввести группу СН3– (заместитель I рода), которая направит группу NO2 в n-положение:
Так как два заместителя находятся в n-положении, то первым в бензольное ядро необходимо ввести группу СН3– (заместитель I рода), которая направит группу NO2 в n-положение:


 Чтобы получить м-нитротолуол, необходимо первым в бензольное ядро ввести заместитель II рода, т.е. группу NO2, которая направит группу СН3 в м-положение.
Чтобы получить м-нитротолуол, необходимо первым в бензольное ядро ввести заместитель II рода, т.е. группу NO2, которая направит группу СН3 в м-положение.

 + НО – NO2 ¾® + H2O
+ НО – NO2 ¾® + H2O

 (n-положение)
(n-положение)

 + СН3 – СН2Cl ¾® + НCl
+ СН3 – СН2Cl ¾® + НCl
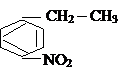




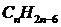 + (1,5n-1,5)O2 nCO2 + (n-3)H2O (1)
+ (1,5n-1,5)O2 nCO2 + (n-3)H2O (1) CO2 + Ca(OH)2 CaCO3 + H2O (2)
CO2 + Ca(OH)2 CaCO3 + H2O (2)
 n(CaCO3) =
n(CaCO3) =  = 0,07(моль) – это значение подставляем в уравнение 2, а затем переносим в уравнение 1.
= 0,07(моль) – это значение подставляем в уравнение 2, а затем переносим в уравнение 1. ) = 14n-6
) = 14n-6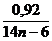 тогда
тогда  =
=  ; n=7
; n=7 ; или
; или  - толуол
- толуол
 + 2KMnO4
+ 2KMnO4  + 2MnO2
+ 2MnO2  + 2KOH
+ 2KOH
 = 0,14 (моль) это практический выход. Определим теоретическое количество MnO2: n(MnO2) =
= 0,14 (моль) это практический выход. Определим теоретическое количество MnO2: n(MnO2) =  = 0,2 (моль) подставим в уравнение реакции над MnO2, тогда количество n (
= 0,2 (моль) подставим в уравнение реакции над MnO2, тогда количество n ( ) равно 0,1 моль. Находим массу толуола:
) равно 0,1 моль. Находим массу толуола:  = 9,2 г Ответ: 9,2 г.
= 9,2 г Ответ: 9,2 г. . При кипячении вещества А с раствором перманганата калия образуется соединение состава
. При кипячении вещества А с раствором перманганата калия образуется соединение состава  . Напишите уравнения реакций с использованием структурных формул, протекающих с веществом А и хлором на свету.
. Напишите уравнения реакций с использованием структурных формул, протекающих с веществом А и хлором на свету.



 + 2KMnO4
+ 2KMnO4  +2MnO2+KOH + H2O
+2MnO2+KOH + H2O + Сl2 + HCl
+ Сl2 + HCl
 + Br2
+ Br2  + HBr (1).
+ HBr (1). ; n(
; n( )=
)=  =0,056(моль).n(C6H6)=n(HBr)=n(C6Н5Br)=
=0,056(моль).n(C6H6)=n(HBr)=n(C6Н5Br)= = 0,035 (моль).
= 0,035 (моль). ; η(
; η(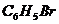 ) =
) =  = 62,5%
= 62,5% , нитробензол, бензолсульфикислота.
, нитробензол, бензолсульфикислота. 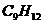





 а) этилен м-хлорбензольную кислоту,
а) этилен м-хлорбензольную кислоту, циклогексан бензолсульфокислоту
циклогексан бензолсульфокислоту г) метан м-нитроэтилбензол.
г) метан м-нитроэтилбензол. ; 44%
; 44% 
 ; 33,6%
; 33,6%  а) О
а) О