Формальдегид (муравьиный альдегид, метаналь) НСОН – это газ с резким, раздражающим запахом, токсичен. В промышленности получается:
 - при неполном окислении метана
- при неполном окислении метана
- каталитическим окислением метанола (или дегидрированием)
40% раствор его называется формалином. Метаналь отличается от других альдегидов отсутствием радикала, поэтому он отличается и по свойствам. Так при действии аммиака он образует циклическое соединение:
Для муравьиного альдегида характерна реакция Канницаро:
Под действием Са(ОН)2 муравьиный альдегид конденсируется в гликолевый альдегид:

и дальше конденсируется в моносахарид

Формальдегид применяется для производства полимерных материалов на основе фенолформальдегидной смолы, в кожевенной промышленности (дубление кож), в производстве взрывчатых веществ, лаков, в качестве дезинфицирующего средства в медицине.
Ацетальдегид (уксусный альдегид) СН3СОН – бесцветная жидкость, легко кипящая. В промышленности получается:
- гидратацией ацетилена (реакция Кучерова);
- окислением этанола;
 - прямым окислением этилена:
- прямым окислением этилена:
Применяется для получения уксусной кислоты, этилацетата, паральдегида, этилового спирта и др.
Бензальдегид С6Н5 – СOH - бесцветная маслянистая жидкость с запахом миндаля. В промышленности получается:
 - хлорированием толуола с последующим гидролизом
- хлорированием толуола с последующим гидролизом

- окислением толуола
| |
| | | С6Н5 – СН3 + О2 ¾® С6Н5 – С –H + Н2О
| |
 Используется бензальдегид для синтеза красителей, душистых веществ.
Используется бензальдегид для синтеза красителей, душистых веществ.
Ацетон - бесцветная жидкость с характерным запахом, смешивается с водой в любых соотношениях, хороший растворитель органических веществ. В промышленности получается:
 - дегидрированием изопропилового спирта:
- дегидрированием изопропилового спирта:
- прямым окислением пропилена:

- кумольный способ (см. стр. 219).
 Качественной реакцией на ацетон является образование иодоформа при действии на него раствора щелочи и йода:
Качественной реакцией на ацетон является образование иодоформа при действии на него раствора щелочи и йода:
Ацетон применяется как растворитель лаков, кинопленки, ацетатного волокна, в производстве бездымного пороха, для синтеза многих органических веществ.
Вопросы для самопроверки.
- Какие соединения называются альдегидами, кетонами? Их общая формула, функциональные группы.
- Чем отличаются по строению альдегиды от кетонов?
- Название альдегидов по Р.н. и М.н.
- Название кетонов по Р.н. и М.н.
- Способы получения альдегидов и кетонов.
- Физические свойства альдегидов и кетонов.
- Влияние функциональной группы на реакционные способности карбонильных соединений.
- Механизм реакции нуклеофильного присоединения.
- Влияние электронодонорных и акцепторных заместителей, размера радикала на активность и скорость протекания реакции.
- Реакции присоединения к карбонильной группе.
- Реакции замещения кислорода карбонильной группы, механизм протекания.
- Реакции полимеризации альдегидов.
- Реакции конденсации альдегидов и кетонов.
- Реакции окисления. Качественная реакция альдегидов.
- Реакция замещения a-водорода.
- Характеристика муравьиного, уксусного, бензойного альдегидов и ацетона.
15.7 Обучающее задание №1.
Охарактеризуйте и назовите следующие соединения:

 а) б)
а) б)
Решение:
а) альдегид, предельный, разветвленный. По травиальной номенклатуре называется изовалерьяновым альдегидом. По Р.н. – изопропилуксусный альдегид. По М.н. – 3-метилбутаналь.
б) кетон, предельный, разветвленный. По Р.н. номенклатуре – первичный изопентилэтилкетон.
По М.н. – 5,5-диметилгексанон-3.
Обучающее задание №2.
По реакции Фриделя – Крафтса получите метилфенилкетон, дифенилкетон.

 Решение:
Решение:
Обучающее задание №3.
Вещество состава С3Н4О обесцвечивает бромную воду, дает реакцию «серебряного зеркала». Установите структурную формулу этого вещества и напишите уравнение реакции его получения.
 Решение: данное вещество – альдегид, т.к. дает реакцию «серебряного зеркала», непредельное, т.к. обесцвечивает бромную воду, следовательно его формула:
Решение: данное вещество – альдегид, т.к. дает реакцию «серебряного зеркала», непредельное, т.к. обесцвечивает бромную воду, следовательно его формула:
Непредельные альдегиды получаются кротоновой конденсацией, а так как в нем три атома углерода, значит его можно получить кротоновой конденсацией муравьиного и уксусного альдегидов.
Обучающее задание №4.
Соединение С4Н8О взаимодействует с НСN, NaНSО3, с йодистым метилмагнием и водой с образованием третичного спирта. Напишите структурные формулы соединений и все указанные уравнения. Определите это вещество.
 Решение: данное соединение относится к кетонам, так как при действии МОС образуется третичный спирт. Его структурная формула:
Решение: данное соединение относится к кетонам, так как при действии МОС образуется третичный спирт. Его структурная формула:
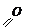 Уравнения реакций:
Уравнения реакций:
Обучающее задание №5.
 Осуществите превращения:
Осуществите превращения:
 Решение:
Решение:
Обучающее задание №6.
Осуществите превращения, используя неорганические реагенты: этиловый спирт ¾® бутанол-2.
 Решение:
Решение:
| |
| | | СН3 – СН2 – ОН ¾® СН3 – СН2 – С – СН3
| |
В конечном продукте в два раза больше углеродных атомов. Следовательно, надо удлинить углеродную цепь. При этом можно идти через магнийорганические соединения. Вначале из этилового спирта получим альдегид:
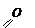
| |
| | | СН3 – СН2 – ОН ¾® СН3 – С – Н + Н2
| |
Затем из этилового спирта через галогенопроизводные получаем магнийорганическое соединение:
 На уксусный альдегид действуем хлористым этилмагнием:
На уксусный альдегид действуем хлористым этилмагнием:
Полученный бутанол-2 дегидрируем:
Обучающее задание №7.
Осуществите превращение бутаналь в бутанон-2, используя только неорганические реагенты.
 Решение:
Решение:
 I способ:
I способ:
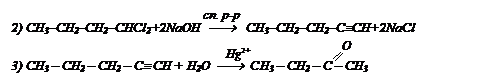
 II способ:
II способ:
| |
| | | ¾® СН3 –СН2–СН=СН2 ¾® СН3 –СН2 –СНОН –СН3 ¾® СН3 – СН2 – С–СН3
| |
Обучающее задание №8.
Исходя из пропилена и неорганических реагентов получите пентанон-3.
 Решение:
Решение:
Обучающее задание №9.
Установите формулу альдегида СnН2nО, если при взаимодействии избытка аммиачного раствора нитрата серебра с 21,5 г альдегида выделилось 54 г серебра.
Решение: Пишем уравнение реакции в общем виде
0,5 моль серебра выделяются 0,25 молями альдегида. Определяем молярную массу альдегида:
Устанавливаем формулу альдегида:
СnH2nO
12n + 2n + 16 = 86
n=5
Формула С5Н10О.
Обучающее задание №10.
7,25 г смеси альдегида и спирта содержат 80% альдегида и 20% спирта. Альдегид и спирт содержат одинаковое число углеродных атомов. К этой смеси добавили избыток аммиачного раствора нитрата серебра, выпало 21,6 г осадка. Установите структурные формулы альдегида и спирта.
Решение:
m(CnН2nO) = 7,25*0,8 = 5,8 (г)
m(СnH2n+1ОН) = 7,25*0,2 = 1,45 (г)
 С аммиачным раствором нитрата серебра взаимодействует альдегид. Пишем уравнение реакции в общем виде:
С аммиачным раствором нитрата серебра взаимодействует альдегид. Пишем уравнение реакции в общем виде:
Определяем количество серебра:


Подставляем это значение в уравнение. Следовательно количество альдегида будет равно 0,2: 2 = 0,1 моль. Зная массу альдегида и количество его определяем молярную массу:

Выводим формулу адьдегида: CnH2nO.
 12n + 2n + 16 = 58; n=3.
12n + 2n + 16 = 58; n=3.
Формула альдегида
| СН3 – СНОН – СН3 пропанол-2
| |
А так как спирт содержит такое же число углеродных атомов, следовательно его формулы могут быть:
| СН3 – СН2 –СН2ОН
пропанол-1
| |
Обучающее задание №11.
 Для восстановления 30,4 г смеси уксусного альдегида и
Для восстановления 30,4 г смеси уксусного альдегида и
предельного кетона с одной группой потребовалось 11,2 л Н2 (н.у.). Исходная смесь той же массы может вступить в реакцию с 12,4 г КМnО4 в Н+ растворе (без разрыва С – С связи). Установите строение кетона.
 Решение:
Решение:
 Определяем количество вступившего в реакцию Н2 пошедшего на два уравнения, и подставляем к фигурной скобке.
Определяем количество вступившего в реакцию Н2 пошедшего на два уравнения, и подставляем к фигурной скобке.
 С раствором КМnО4 будет вступать в реакцию только уксусной альдегид
С раствором КМnО4 будет вступать в реакцию только уксусной альдегид
Определяем количество КMnО4 и подставляем в уравнение (III).

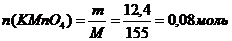 (в уравнение III)
(в уравнение III)
Следовательно уксусного альдегида вступило в реакцию с КМnО4: (0,08: 2)*5 = 0,2 (моль). Это значение подставляем в уравнение (I) над уксусным альдегидом. С этим количеством альдегида реагирует 0,2 моля Н2. Определяем n(Н2), вступившего с кетоном.


 Определяем массу альдегида: m() = n*M = 0,2*44 = 8,8 (г)
Определяем массу альдегида: m() = n*M = 0,2*44 = 8,8 (г)
 Определяем массу кетона и его молярную массу:
Определяем массу кетона и его молярную массу:
 m() = 30,4 – 8,8 = 21,6 (г)
m() = 30,4 – 8,8 = 21,6 (г)
 Общая формула кетона СnH2nO.
Общая формула кетона СnH2nO.
12n + 2n + 16 = 72; n=4.
Формула С4Н8О. Строение СH3-CH2-C-CH3
15. 8 Контрольное задание №1.
 Какие названия соответствуют следующим соединениям: Какие названия соответствуют следующим соединениям:
|
 | А. СН3 – СН – С – СН2 – СН3
| | 
| 1. изомасляный альдегид
|

| 2. фенилэтилкетон
|

| 3. метилпропилкетон
|

| 4. 2,2-диметилпропаналь
|

| 5. изопропилэтилкетон
|
|
| 6. 2-фенилэтаналь
|

| 7. пентен-4-он-2
|

| 8. 3,3-диметилбутаналь
|
Контрольное задание №2.
   Какие из указанных реакций являются реакцией: Какие из указанных реакций являются реакцией:
|
 1. Получение карбонильного соединения. 1. Получение карбонильного соединения.
|
|
| 2. Качественная реакция на альдегиды.
| 
|
  3. Гидрирование карбонильных соединений. 3. Гидрирование карбонильных соединений.
|
|
| 4. Замещение кислорода в карбонильной группе.
| 
|
 5. Окисление альдегида. 5. Окисление альдегида.
|
|
| 6. Альдольной конденсации.
| 
|
| Ж. СН3 – СН2 – СН2ОН ¾® СН3 – СН2 – С – Н
| | 7. Получение непредельного альдегида.
|
|
  8. Реакцией Каннициаро. 8. Реакцией Каннициаро.
|
|
| 9. Окисление кетона.
|
|
Контрольное задание №3.
Осуществите превращения:

|
| Х1
| Х2
| Х3
| Х4
|
| А
| С6Н5MgBr
| С6Н5СНMgBrС2Н5
| С6Н5СНОНС2Н5
| С6Н5СОС2Н5
|
| Б
| (СН3)2СНОН
| (СН3)2СО
| (СН3)С=СНСОН
| (СН3)2СНСН2СОН
|
| В
| С2Н4
| С3Н6О
| С3Н8О
| (С3Н7)2О
|
| Г
| НСОН
| СН3(СН2)3ОН
| СН3(СН2)2СОН
| СН3(СН2)3ОСN
|
| Д
| С7Н6О
| С6Н5СНОНСН3
| С6Н5СОСН3
| С6Н5ССl2СН3
|
Контрольное задание №4.
| С помощью каких реакций можно осуществить следующие превращения:
|
| А. этанол ¾® бутанол-2
| 1) гидрирование, действие щелочного металла.
|
| Б. ацетилен ¾® пропаналь
| 2) электрокрекинг (1200 0С), гидратация (р. Кучерова).
|
| В. этилен ¾® бутанон-2
| 3) окисление, действие гидроксида Са, прокаливание.
|
| Г. хлористый пропил ¾® ацетон
| 4) гидратация, конденсация.
|
| Д. этан ¾® этаналь
| 5) гидрирование, оксосинтез.
|
| Е. ацетилен ¾® кротоновый альдегид
| 6) действие спиртового раствора щелочи, окисление.
|
| Ж. уксусный альдегид ¾® ацетон
| 7) получение реактива Гриньяра (МОС), окисление, присоединение реактива Гриньяра.
|
| З. этаналь ¾® этилат натрия
| 8) действие НВr, Mg, окисление, присоединение реактива Гриньяра.
|
| Напишите уравнения реакций превращений.
|
Контрольное задание №5.
С помощью каких реакций можно осуществить следующие превращения? Напишите соответствующие уравнения реакций.
1) метан ¾® ацетон;
2) этилен ¾® пентанон-3;
3) карбид кальция ¾® кротоновый альдегид;
4) ацетилен ¾® бутанон-2;
5) этиловый спирт ¾® 3-метилбутанон-2;
6) этан ¾® бензойный альдегид;
7)
8) уксусный альдегид ¾® бутанол-1;
9)
10) пропаналь ¾® дизопропиловый эфир;
11) этаналь ¾® 1,4-дибромбутен-2;
12) Имеется смесь пропана, пропилового спирта и пропионового альдегида. С помощью каких реакций их можно разделить?
13) Смесь формальдегида и водорода с относительной плотностью по водороду. 4,5 пропустили над никелевым катализатором, после чего плотность по водороду, охлажденной до 0 0С, смеси стала равной 3. Рассчитайте выход продукта реакции.
Ответ: 60%.
14) При сжигании альдегида массой 0,975 г образовался углекислый газ, который прореагировал с 20%-ным раствором гидроксида натрия объемом 16,4 мл r = 1,22 г/мл с образованием средней соли. Определите формулу альдегида.
Ответ: С3Н6О.



 - при неполном окислении метана
- при неполном окислении метана




 - прямым окислением этилена:
- прямым окислением этилена: - хлорированием толуола с последующим гидролизом
- хлорированием толуола с последующим гидролизом

 Используется бензальдегид для синтеза красителей, душистых веществ.
Используется бензальдегид для синтеза красителей, душистых веществ. - дегидрированием изопропилового спирта:
- дегидрированием изопропилового спирта:
 Качественной реакцией на ацетон является образование иодоформа при действии на него раствора щелочи и йода:
Качественной реакцией на ацетон является образование иодоформа при действии на него раствора щелочи и йода:
 а) б)
а) б)
 Решение:
Решение: Решение: данное вещество – альдегид, т.к. дает реакцию «серебряного зеркала», непредельное, т.к. обесцвечивает бромную воду, следовательно его формула:
Решение: данное вещество – альдегид, т.к. дает реакцию «серебряного зеркала», непредельное, т.к. обесцвечивает бромную воду, следовательно его формула:
 Решение: данное соединение относится к кетонам, так как при действии МОС образуется третичный спирт. Его структурная формула:
Решение: данное соединение относится к кетонам, так как при действии МОС образуется третичный спирт. Его структурная формула: Уравнения реакций:
Уравнения реакций:
 Осуществите превращения:
Осуществите превращения: Решение:
Решение:
 Решение:
Решение: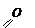

 На уксусный альдегид действуем хлористым этилмагнием:
На уксусный альдегид действуем хлористым этилмагнием:
 Решение:
Решение: I способ:
I способ: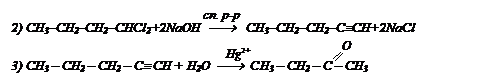
 II способ:
II способ: Решение:
Решение:
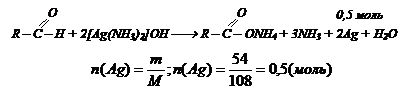
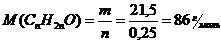
 С аммиачным раствором нитрата серебра взаимодействует альдегид. Пишем уравнение реакции в общем виде:
С аммиачным раствором нитрата серебра взаимодействует альдегид. Пишем уравнение реакции в общем виде:


 12n + 2n + 16 = 58; n=3.
12n + 2n + 16 = 58; n=3. Для восстановления 30,4 г смеси уксусного альдегида и
Для восстановления 30,4 г смеси уксусного альдегида и Решение:
Решение: Определяем количество вступившего в реакцию Н2 пошедшего на два уравнения, и подставляем к фигурной скобке.
Определяем количество вступившего в реакцию Н2 пошедшего на два уравнения, и подставляем к фигурной скобке. С раствором КМnО4 будет вступать в реакцию только уксусной альдегид
С раствором КМnО4 будет вступать в реакцию только уксусной альдегид
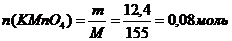 (в уравнение III)
(в уравнение III)

 Определяем массу альдегида: m() = n*M = 0,2*44 = 8,8 (г)
Определяем массу альдегида: m() = n*M = 0,2*44 = 8,8 (г) Определяем массу кетона и его молярную массу:
Определяем массу кетона и его молярную массу: m() = 30,4 – 8,8 = 21,6 (г)
m() = 30,4 – 8,8 = 21,6 (г) Общая формула кетона СnH2nO.
Общая формула кетона СnH2nO. Какие названия соответствуют следующим соединениям:
Какие названия соответствуют следующим соединениям:








 Какие из указанных реакций являются реакцией:
Какие из указанных реакций являются реакцией:
 1. Получение карбонильного соединения.
1. Получение карбонильного соединения.


 3. Гидрирование карбонильных соединений.
3. Гидрирование карбонильных соединений.

 5. Окисление альдегида.
5. Окисление альдегида.

 8. Реакцией Каннициаро.
8. Реакцией Каннициаро.






