Циклоалканами называют предельные циклические углеводорды. Общая формула СnH2n(n ≥ 3). Эти соединения изомерны алкенам.
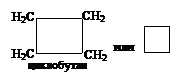
 7.1 Номенклатура.
7.1 Номенклатура.
Изомерия.
Структурная изомерия циклоалканов обусловлена размером цикла, размером, строением боковых цепей и их положением. Например, для С5Н10 возможны изомеры:

Пространственная изомерия (цис-трансизомерия, геометрическая изомерия) обусловлена различным расположением боковых цепей относительно плоскости цикла. Например: в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
7.3 Способы получения. Циклоалканы содержатся в эфирных маслах растений и являются главной составной частью некоторых сортов нефти, откуда и выделяются, или их получают синтетическим путем.
Действием металлов (Zn, Mg) или Na (спиртовой раствор) на дигалогенопроизводные алканов:
Гидрирование ароматических углеводородов (при этом получают циклогексан и его производные):
7.4 Физические свойства. Циклопропан и циклобутан – газы, циклопентан и циклогексан по С10 – жидкости, высшие – твердые вещества. Циклоалканы нерастворимы в воде, их tкип, tпл и плотность выше, чем у соответствующих алканов.
7.5. Химические свойства зависят прежде всего от размера цикла. Малые циклы (С3 – С4) неустойчивы и легко разрываются, протекают реакции присоединения. Циклы (С5 – С7) склонны к реакциям замещения.
Действие галогенов:

Циклопентан, циклогексан вступают в реакцию замещения:
а)
б)
Действие галогеноводородов:
Циклопентан и последующие циклы не взаимодействуют с галогеноводородом.
Гидрирование – протекает с разрывом цикла при нагревании, и чем больше размер цикла, тем выше температура.
С циклогексаном протекает реакция дегидрирования.
 Реакции окисления циклоалканов при действии сильных окислителей приводит к образованию двухосновных карбоновых кислот:
Реакции окисления циклоалканов при действии сильных окислителей приводит к образованию двухосновных карбоновых кислот:
 Реакции изомеризации – при этом происходит сужение или расширение цикла, например:
Реакции изомеризации – при этом происходит сужение или расширение цикла, например:
метилциклобутан циклопентан
Отдельные представители.
Циклопропан С3Н6 – газообразное вещество, tкип. = -340С, применяется как анестезирующее вещество.
Циклогексан С6Н12 – жидкость,tкип. = 810С, применяется в качестве растворителя, для синтеза адипиновой кислоты и капролактама – полупродуктов для производства синтетических волокон найлона и капрона.
7.6 Вопросы для самоконтроля
1. Какие соединения называются циклоалканами? Их общая формула.
2. Чем обусловлена структурная и пространственная изомерии циклоалканов? Приведите примеры изомеров.
3. Напишите графические формулы всех изомерных циклоалканов состава С6Н12.
4. Способы получения циклоалканов.
5. Физико-химические свойства циклоалканов: малых циклов (С3 – С4) и циклов С5. Напишите уравнения реакций.
7.7 Обучающее задание №1
Напишите уравнения реакций, с помощью которых можно получить метилциклопентан. Назовите исходные вещества.
Решение:
 Существуют три варианта синтеза метилциклопентана из дигалогенопроизводных:
Существуют три варианта синтеза метилциклопентана из дигалогенопроизводных:
1) СН2Cl–СН2–СН2–СН2–СНCl–СН3 + Zn → + ZnCl2
 1,5-дихлоргексан
1,5-дихлоргексан
 2) СН2Cl–СН–СН2–СН2–СН2Cl + Zn → + ZnCl2
2) СН2Cl–СН–СН2–СН2–СН2Cl + Zn → + ZnCl2
СН3
2-метил-1,5-дихлорпентан
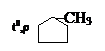
 3) СН2Cl–СН2–СН–СН2–СН2Cl + Zn → + ZnCl2
3) СН2Cl–СН2–СН–СН2–СН2Cl + Zn → + ZnCl2
СН
3
 4) Можно получить его по реакции Вюрца:
4) Можно получить его по реакции Вюрца:
Обучающее задание №2
Составьте уравнения реакций, характеризующие химические свойства метилциклопентана. Укажите условия протекания реакций. Назовите продукты реакций.
Решение: 1) Горение:
С6Н12 + 9О2 → 6СО2 + 6Н2О
2) Термическое разложение:
С6Н12 → 6С + 6Н2
3) Реакции замещения:
 а) галогенирование:
а) галогенирование:
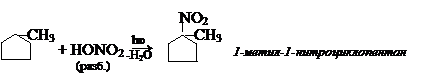 б) нитрование:
б) нитрование:
4) гидрирование:
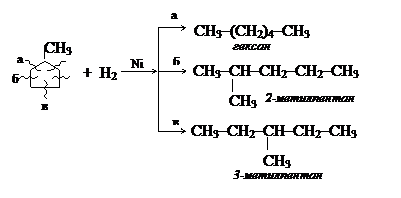
 5) изомеризация (в направлении увеличения устойчивости):
5) изомеризация (в направлении увеличения устойчивости):
Обучающее задание №3
Осуществите следующие превращения: метилциклобутан → циклопентан → пентан → этан.
 Решение: По названиям пишем формулы:
Решение: По названиям пишем формулы:
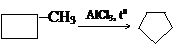 1) Проводим реакцию изомеризации метилциклобутана:
1) Проводим реакцию изомеризации метилциклобутана:
 2) Проводим действие водорода с разрывом цикла:
2) Проводим действие водорода с разрывом цикла:
3) Подвергаем пентан крекингу:
Обучающее задание №4
10 г. циклогексана сожгли в избытке кислорода и полученный СО2 пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 60 г. Определите массовую долю негорючих примесей в циклогексане.
Решение: Напишем уравнение реакции горения циклогексана:
 0,1 0,6
0,1 0,6
С6H12 + 9O2 → 6CO2 + 6H2O (1)
Выделившийся CO2 реагирует с Са(OH)2
 0,6 0,6
0,6 0,6
CO2 + Са(OH)2 → CaCO3 + H2O (2)
Определяем количество CaCO3 по формуле:

 ; (моль)
; (моль)
Подставим 0,6 (моль) в уравнение (2) над CaCO3, следовательно, n(CO2) = 0,6 (моль). Это же значение CO2 подставим в уравнение (1) и определим n(С6H12) = =  (моль). Находим m(С6H12) = n(С6H12)*M(С6H12); m(С6H12) = 0,1*84 = 8,4. Определяем массу примесей:
(моль). Находим m(С6H12) = n(С6H12)*M(С6H12); m(С6H12) = 0,1*84 = 8,4. Определяем массу примесей:
m(примесей) = 10 – 8,4 = 1,6 (г.) Определяем массовую долю примесей по формуле:  ;
;  .
.
Ответ: 16%.
Обучающее задание №5
При сгорании циклоалкана было получено 22 г. оксида углерода (IV). Какой объем кислорода (н.у.) израсходован на сжигание?
Решение: Пишем уравнение реакции в общем виде:
0,5
СnH2n + 1,5nO2 → nCO2 + nH2O
Определим  ;
; 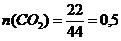 (моль).
(моль).
Подставим в уравнение над CO2 0,5 моль, тогда
n(O2) =  (моль). Находим объем кислорода:
(моль). Находим объем кислорода:
 ;
;  (л.).
(л.).
Ответ: 16,8 (л.)
Обучающее задание №6
Газ, выделившийся при полном сжигании смеси циклопропана и метана, был пропущен через 560 г. раствора NaOH с массовой долей 10% до образования средней соли. Определите объемную долю газов в исходной смеси, если на ее сжигание пошло 24,64 л. кислорода (н.у.).
Решение: Пишем уравнения реакций:
x 2x x
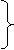
 СH4 + 2O2 → CO2 + 2H2O (1) y 4,5y 1,1 моль 3y 0,7 моль
СH4 + 2O2 → CO2 + 2H2O (1) y 4,5y 1,1 моль 3y 0,7 моль
С3H6 + 4,5O2 → 3CO2 + 3H2O (2)
0,7 моль 1,4 моль
СO2 + 2NaOH → Na2CO3 + H2O (3)
Определяем количество  ;
;
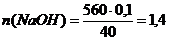 (моль).
(моль).
Подставим в уравнение (3) над NaOH, следовательно, n(CO2) =  (моль). Это количество СО2 выделяется в реакциях(1)и(2).
(моль). Это количество СО2 выделяется в реакциях(1)и(2).
Определим 
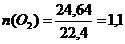 (моль). Это значение n(O2) пишем в уравнении (1) и (2).
(моль). Это значение n(O2) пишем в уравнении (1) и (2).
Обозначим:
n(CН4) = x моль n(О2) в реакции (1) = 2x
n(C3H6) = y моль n(О2) в реакции (2) = 4,5y
n(CH4) = n(CО2) = x моль (в реакции (1)
n(C3H6) = 3n(CО2) = 3y моль (в реакции (2)
Составляем уравнения:


-2
-1,5y = -0,3 y = 0,2 моль 
х = 0,7 – 3*0,2 = 0,1 моль
n(CH4) = 0,1 моль
n(C3H6) = 0,2 моль

 n(смеси) = 0,1 + 0,2 = 0,3(моль)
n(смеси) = 0,1 + 0,2 = 0,3(моль)
Ответ: 33,3% CH4, 66,7% C3H6
Обучающее задание №7
До пропускания газовой смеси, состоящей из этана, циклопропана и аммиака, через воду, ее относительная плотность по водороду была равна 16,1, а после пропускания – 18. Определите массы веществ в исходной смеси.
Решение:
Определим молярные массы смеси:
до пропускания –  ;
;  (г/моль);
(г/моль);
после пропускания –  (г/моль).
(г/моль).
При пропускании смеси через воду растворится NH3:
NH3 + H2O → NH4OH.
В смеси останется С2Н6 и С3Н6, т.к. они в воде не растворяются.
Пусть n(С2Н6) + n(С3Н6) = 1 (моль)
n(С3Н6) = х моль n(С2Н6) = (1 – х) моль

 х = 0,5 (моль);
х = 0,5 (моль);
n(С2Н6) = n(С3Н6) = 0,5 (моль)
До пропускания в смеси был NH3.
n(NН3) = y (моль)
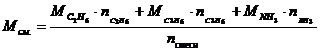
y = 0,25 (моль);
n(NН3) = 0,25 (моль); m(С2Н6) = 30*0,5 = 15 (г.);
m(С3Н6) = 42*0,5 = 21 (г.); m(NН3) = 17*0,25 = 4,25 (г.)
Ответ: m(C2Н6)=15 г; m(C3H6) = 21г; m(NН3)=4,25г.
Обучающее задание №8
Определите массу нитроциклопентана, который образуется при действии 1200 г. 5%-ного раствора азотной кислоты на 56 г. циклопентана, если доля выхода продукта реакции составляет 80% от теоретически возможного.
Решение: Пишем уравнение реакции:
Определяем количество веществ:
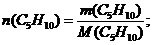
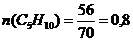 (моль)
(моль)

 (моль)
(моль)
Из уравнения видим, что HNO3 – в избытке, следовательно, расчет ведем по С5Н10: n(C5H9NO2) = 0,8 (моль).
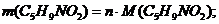 (г.)
(г.)
 (г) – это теоретический выход.
(г) – это теоретический выход.
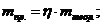
 (г)
(г)
Ответ: 73,6 (г.)
7.8 Контрольные задания
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) 1,3-дибромбутан  Х1
Х1  Х2
Х2  Х3
Х3 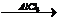 Х4
Х4
 б)
б)  Х1
Х1  Х2
Х2  Х3
Х3
в) 1,4-дибромбутан  циклобутан
циклобутан  бутан
бутан
г) 1,2-диметилциклопропан→циклопентан→пентан →метан;
д) метилциклопропан 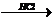 Х1
Х1 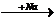 Х2
Х2  бутан → изобутан.
бутан → изобутан.
2. При сжигании 19,6 г. органического вещества образуется 31,36 л. СО2 (н.у.) и 25,2 г. Н2О. Относительная плотность паров органического соединения по водороду равна 28. Установите молекулярную формулу органического вещества.
3. Найдите массу циклогексана, полученного при нагревании 14 г. цинка с 48,8 г. 1,6-дибромгексана.
4. Найдите массу 1,5-дибромпентана, необходимую для получения 280 г. циклопентана, если доля выхода продукта реакции составляет 80%. Ответ: 1150 г.
5. При горении предельного циклического углеводорода образовалось 3,6 г. воды. Вычислите массу СО2, которая образуется при этом. Ответ:8,8 г.
6. Для полного сгорания 5,8 г. смеси метана, циклопропена и пропена, потребовалось 14,56 л. О2. Вычислите объемную долю метана в исходной смеси. Ответ: 50% СН4



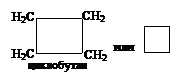
 7.1 Номенклатура.
7.1 Номенклатура.





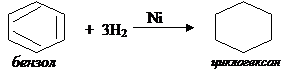


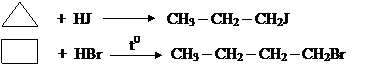


 Реакции окисления циклоалканов при действии сильных окислителей приводит к образованию двухосновных карбоновых кислот:
Реакции окисления циклоалканов при действии сильных окислителей приводит к образованию двухосновных карбоновых кислот: Реакции изомеризации – при этом происходит сужение или расширение цикла, например:
Реакции изомеризации – при этом происходит сужение или расширение цикла, например:

 Существуют три варианта синтеза метилциклопентана из дигалогенопроизводных:
Существуют три варианта синтеза метилциклопентана из дигалогенопроизводных:
 1,5-дихлоргексан
1,5-дихлоргексан 2) СН2Cl–СН–СН2–СН2–СН2Cl + Zn → + ZnCl2
2) СН2Cl–СН–СН2–СН2–СН2Cl + Zn → + ZnCl2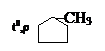
 3) СН2Cl–СН2–СН–СН2–СН2Cl + Zn → + ZnCl2
3) СН2Cl–СН2–СН–СН2–СН2Cl + Zn → + ZnCl2 4) Можно получить его по реакции Вюрца:
4) Можно получить его по реакции Вюрца: а) галогенирование:
а) галогенирование: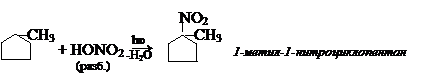 б) нитрование:
б) нитрование: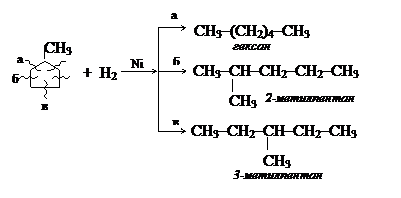
 5) изомеризация (в направлении увеличения устойчивости):
5) изомеризация (в направлении увеличения устойчивости): Решение: По названиям пишем формулы:
Решение: По названиям пишем формулы: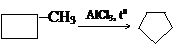 1) Проводим реакцию изомеризации метилциклобутана:
1) Проводим реакцию изомеризации метилциклобутана: 2) Проводим действие водорода с разрывом цикла:
2) Проводим действие водорода с разрывом цикла: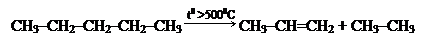
 0,1 0,6
0,1 0,6 0,6 0,6
0,6 0,6
 ; (моль)
; (моль) (моль). Находим m(С6H12) = n(С6H12)*M(С6H12); m(С6H12) = 0,1*84 = 8,4. Определяем массу примесей:
(моль). Находим m(С6H12) = n(С6H12)*M(С6H12); m(С6H12) = 0,1*84 = 8,4. Определяем массу примесей: ;
;  .
. ;
; 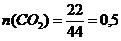 (моль).
(моль). (моль). Находим объем кислорода:
(моль). Находим объем кислорода: ;
;  (л.).
(л.).
 СH4 + 2O2 → CO2 + 2H2O (1) y 4,5y 1,1 моль 3y 0,7 моль
СH4 + 2O2 → CO2 + 2H2O (1) y 4,5y 1,1 моль 3y 0,7 моль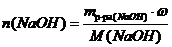 ;
;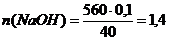 (моль).
(моль). (моль). Это количество СО2 выделяется в реакциях(1)и(2).
(моль). Это количество СО2 выделяется в реакциях(1)и(2).
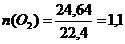 (моль). Это значение n(O2) пишем в уравнении (1) и (2).
(моль). Это значение n(O2) пишем в уравнении (1) и (2).




 n(смеси) = 0,1 + 0,2 = 0,3(моль)
n(смеси) = 0,1 + 0,2 = 0,3(моль) ;
;  (г/моль);
(г/моль); (г/моль).
(г/моль).
 х = 0,5 (моль);
х = 0,5 (моль);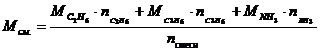


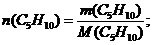
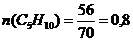 (моль)
(моль)
 (моль)
(моль)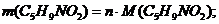 (г.)
(г.) (г) – это теоретический выход.
(г) – это теоретический выход.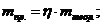
 (г)
(г) Х1
Х1 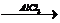 Х2
Х2  Х3
Х3 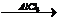 Х4
Х4 б)
б)  Х1
Х1  Х2
Х2  Х3
Х3 циклобутан
циклобутан 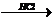 Х1
Х1 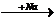 Х2
Х2  бутан → изобутан.
бутан → изобутан.


