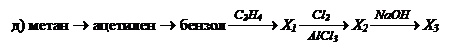Многоатомные спирты – гидроксильные производные углеводородов, содержащие две или более группы ОН. В зависимости от числа гидроксильных групп в молекуле различают двухатомные, трехатомные и многоатомные спирты.
12.1 Номенклатура, изомерия. По систематической номенклатуре к названию алкана углеродной цепи прибавляется окончание – диол, - триол и т.д. и цифрами указывается положение групп ОН. Для простейших спиртов используются травиальные названия.
| СН2ОН – СНОН – СН2ОН
пропантриол-1,2,3
(глицерин)
| |
| СН2ОН – СН2ОН
этандиол-1,2
(этиленгликоль)
| |
Изомерия многоатомных спиртов обусловлена строением углеродной цепи и положением гидроксильных групп:
12.2 Способы получения. Общим способом получения многоатомных спиртов является:
 гидролиз полигалогенопроизводных:
гидролиз полигалогенопроизводных:
 получение из синтез-газа при нагревании под давлением в присутствии катализатора:
получение из синтез-газа при нагревании под давлением в присутствии катализатора:
окислением этиленовых углеводородов:

 гидратацией окиси этилена получается этиленгликоль:
гидратацией окиси этилена получается этиленгликоль:
Глицерин в промышленности получают:
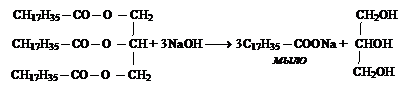 а) омылением жиров:
а) омылением жиров:
б) термическим хлорированием пропилена:
 в) окислением пропилена:
в) окислением пропилена:
12.3 Физическо-химические свойства. Низшие гликоли и глицерин вязкие жидкости, растворимы в воде, кипят при более высокой температуре чем соответствующие им одноатомные спирты.
Многоатомные спирты проявляют свойства одноатомных спиртов. В реакциях может участвовать одна, две и т.д. гидроксильных групп.
 1. Образование гликолятов, глицератов. В отличие от одноатомных спиртов многоатомные спирты легко вступают в реакции не только со щелочными металлами, но и с гидроксидами тяжелых металлов. Например:
1. Образование гликолятов, глицератов. В отличие от одноатомных спиртов многоатомные спирты легко вступают в реакции не только со щелочными металлами, но и с гидроксидами тяжелых металлов. Например:


Эта реакция является качественной на многоатомные спирты.
2. Реакция дегидратации. Они могут быть внутримолекулярные и межмолекулярные.
 а) внутримолекулярная – из одной молекулы спирта выделяется молекула воды:
а) внутримолекулярная – из одной молекулы спирта выделяется молекула воды:
 б) межмолекулярная – из двух молекул спирта выделяется молекула воды:
б) межмолекулярная – из двух молекул спирта выделяется молекула воды:
Этот процесс может продолжаться до образования полимера.
-
 Замена гидроксильных групп на галогены.
Замена гидроксильных групп на галогены.

Действуя PCl5 или SOCl2 можно заменить нагалоген несколько групп ОН.
4. Образование простых эфиров.
 Образование сложных эфиров. Глицерин взаимодействует со смесью концентрированных НNО3 и Н2SО4 образует сложный эфир тринитрат глицерина под названием нитроглицерин.
Образование сложных эфиров. Глицерин взаимодействует со смесью концентрированных НNО3 и Н2SО4 образует сложный эфир тринитрат глицерина под названием нитроглицерин.
Нитроглицерин – маслянистая жидкость, обладающая огромной взрывчатой силой. Взрывается от сотрясения или нагревания. Применяется для производства бездымного пороха и динамита. В виде 1% раствора его применяют в медицине в качестве сосудорасширяющего средства.
6. Реакция окисления. При окислении многоатомных спиртов получается ряд промежуточных продуктов. Например:
Отдельные представители.
Этиленгликоль СН2ОН - СН2ОН – вязкая бесцветная жидкость tкип=1970С, r=1,11 г/мл, сладкая на вкус, смешивается с водой в любых соотношениях, растворяется в спирте, ацетоне, других растворителях. Широко применяется в химической промышленности для изготовления пленок, волокон (лавсан). Водные растворы этиленгликоля используются в качестве антифризов (незамерзающихся жидкостей). 50% водный раствор замерзает при температуре -340С.
Глицерин СН2ОН – СНОН – СН2ОН – вязкая гигроскопичес-кая жидкость сладкого вкуса, tкип=2900С, r=1,26 г/мл. Смешивается с водой в любых соотношениях. Применяется в производстве взрывчатых веществ, полиэфирных полимеров (лаков, эмалей, линолеума, клеев); в парфюмерии, кожевенной, текстильной и пищевой промышленностях.
Вопросы для самоконтроля.
1. Какие спирты называют многоатомными? Приведите примеры, назовите.
2. Способы получения многоатомных спиртов.
3. Физико-химические свойства многоатомных спиртов.
4. Качественная реакция на многоатомные спирты, написать уравнение реакции.
5. Какие продукты получаются при дегидратации этиленгликоля?
6. Какие продукты получаются при окислении этиленгликоля?
7. Применение в промышленности этиленгликоля, глицерина.
 8. Назовите по международной номенклатуре следующие спирты:
8. Назовите по международной номенклатуре следующие спирты:
9. Напишите уравнения реакций получения пропиленгликоля.
10. Напишите структурные формулы:
а) 2-метилпропандиола-1,2; б) 2,3-диметилпентадиола-2,3;
в) бутантриола-1,2,3.
12.6 Обучающее задание №1.
 Охарактеризуйте и назовите по международной номенклатуре следующее соединение:
Охарактеризуйте и назовите по международной номенклатуре следующее соединение:
Решение: это соединение – предельный двухатомный спирт. Название строится следующим образом: основная цепь нумеруется с того конца, к которому ближе расположена группа ОН, т.е. справа. Называем радикал у четвертого С атома и к названию алкана основной цепи прибавляем приставку диол, указывая цифрами местонахождения групп ОН. Называем 4-этилгександиол-1,3.
Обучающее задание №2.
Напишите уравнения реакций для осуществления следующих превращений:
пропан ® пропен ® 3-хлорпропен ® 1,2,3-трихлорпропан ®
® глицерин ® тринитроглицерин.
Решение:

Обучающее задание №3.
Из метана получите глицерин, используя неорганические реагенты.
| СН4 ¾® СН2ОН – СНОН – СН2ОН
| |
Решение:
I способ.
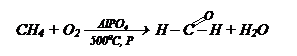 1) Неполное окисление метана СН4:
1) Неполное окисление метана СН4:
2) Синтез Бутлерова – получение глюкозы:
 3) Реакция брожения глюкозы в присутствии сульфита натрия:
3) Реакция брожения глюкозы в присутствии сульфита натрия:
 II способ.
II способ.
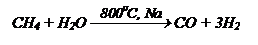 III способ:
III способ:
Обучающее задание №4.
Относительная плотность паров органического вещества по воздуху равна 4,69. При сжигании 47,6 г этого вещества образовалось 77 г СО2 и 37,8 г Н2О. Установите молекулярную формулу органического вещества.
Решение: Определяем молярную массу органического вещества по формуле: М=29Дв; М=29*4,69=136 г/моль.
 Определяем количество молей атомов углерода и водорода и их массы:
Определяем количество молей атомов углерода и водорода и их массы:


 m(С) + m(Н) = 21 + 4,2 = 25,2 г < 47,6 г, следовательно в органическом веществе есть кислород. Определяем массу и количество молей атомов кислорода:
m(С) + m(Н) = 21 + 4,2 = 25,2 г < 47,6 г, следовательно в органическом веществе есть кислород. Определяем массу и количество молей атомов кислорода:
m(О) = 47,6 – 25,2 = 22,4 г.
Определяем соотношение молей атомов элементов, входящих в органическое вещество:
n(С): n(H): n(О) = 1,75: 4,2: 1,4 = 1,25: 3: 1 = 5: 12: 4. Простейшая формула C5Н12О4. Определяем ее молярную массу и сравниваем с молярной массой органического вещества: М(С5Н12О4) = 136 г/моль, следовательно эта формула является истинной.
Ответ: С5Н12О4
Обучающее задание №5.
Какую массу тринитроглицерина можно получить при действии 260 г 80% раствора азотной кислоты на 36,8 г глицерина, если доля выхода продуктов реакции составляет 75% от теоретически возможного.
Решение: Пишем уравнение реакции получения нитроглицерина:

Определяем количество исходных веществ:

Подставляем эти данные в уравнение, из которого видно, что на 0,4 моль глицерина требуется в три раза больше азотной кислоты, т.е. 0,4*3=1,2 моль, следовательно 3,3 > 1,2 азотная кислота в избытке, поэтому расчет продукта реакции ведем по недостатку, т.е. по глицерину. Определяем массу нитроглицерина: m(нгл.) = 0,4*227 = 98 (г); mпр = mтеор*h;
mпр = 90,8*0,75 = 68,1 г. Ответ:68,1 г
Обучающее задание №6.
Смесь этилового спирта и этиленгликоля была обработана избытком натрия, при этом выделилось 3,36 л газа (н.у.). При обработке такой же массы исходной смеси гидроксидом меди массой 4,9 г образовался синий раствор. Установите массовую долю спиртов в исходной смеси.
 Решение: Напишем уравнения реакций взаимодействия спиртов с натрием
Решение: Напишем уравнения реакций взаимодействия спиртов с натрием
2С2Н5ОН + 2Na → 2С2Н5ОNa + Н2 ↑

 Определяем количество водорода:
Определяем количество водорода:
 Это количество выделилось из реакции (I, II).
Это количество выделилось из реакции (I, II).
С
Cu(ОН)2 будет реагировать только этиленгликоль
(III)
 Определяем количество Сu(ОН)2.
Определяем количество Сu(ОН)2.
Подставим 0,05 моль в уравнение (III), тогда n(С2Н6О2) = =2*0,05 = 0,1 (моль). Это количество подставляем в уравнение (II) над С2Н6О2. n(Н2) = 0,1 моль, а так как из уравнения (I, II) выделилось 0,15 молей Н2, следовательно из уравнения (I) n (Н2) = 0,15 - 0,1 = 0,05 моль.
n(С2Н5ОН) = 2*0,05 = 0,1 моль.
Определяем массу спиртов по формуле: m = n*М.
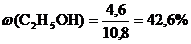
 m(С2Н5ОН) = 0,1*46 = 4,6 г; m(С2Н6О2) = 0,1*62 = 6,2 г. mсм= 4,6+6,2 = 10,8 г.
m(С2Н5ОН) = 0,1*46 = 4,6 г; m(С2Н6О2) = 0,1*62 = 6,2 г. mсм= 4,6+6,2 = 10,8 г.
Ответ: w(С2Н5ОН)=42,6%; w(С2Н6О2)=57,4%.
12.7 Контрольное задание.
| Предложите схемы синтезов:
|
| А. этиленгликоль ¾® этанол
| 1) дегидрирование, окисление, действие Н2О2, восстановление
|
| Б. этиленгликоль ¾® хлористый этил
| 2) гидрогалогенирование, действие КОН(сп.р), тримеризация
|
| В. метан¾® этандиол
| 3) дегидрогалогенирование, действие спиртового раствора щелочи
|
| Г. хлористый этил ¾® этиленгликоль
| 4) дегидратация, окисление
|
| Д. этиловый спирт ¾® бутандиол-2,3
| 5) дегидратация, гидрирование
|
| Е. этанол ¾® этандиол
| 6) дегидратация,гидрирование, гидрохлорирование
|
| Ж. этиленгликоль ¾® ацетилен
| 7) действие спиртового раствора щелочи, окисление
|
| З. этиленгликоль ¾® бензол
| 8) дегидратация, окисление, действие Н2О2, восстановление
|
| И. пропан ¾® глицерин
| 9) дегидрохлорирвание, окисление
|
| К. изопропиловый спирт ¾® глицерин
| 10) реакция С.В. Лебедева, гидрирование, галогенирование, гидролиз
|
| Напишите все указанные уравнения реакций.
|
Контрольные задания.
1. Осуществите превращения:

 б) пропан ¾® пропен ¾® 3-хлорпропен ¾® 1,2,3-трихлорпропан ¾® глицерин;
б) пропан ¾® пропен ¾® 3-хлорпропен ¾® 1,2,3-трихлорпропан ¾® глицерин;
2. Составьте уравнения реакций по схемам:
а) СnН2n+1ОNа ® СnН2n+2О ® С2nН4n-2 ® С2nН4n-1Cl;
б) СnН2n+2О2 ® СnН2nО ® СnН2n+2О ® СnН2n ® СnН2n+2О2
3. Относительная плотность предельного двухатомного спирта по углекислому газу равна 2,045. Выведите молекулярную формулу спирта.
Ответ: С4Н10О2
4. Относительная плотность паров предельного трехатомного спирта по воздуху равна 4,62. Выведите молекулярную формулу спирта. Ответ: С6Н14О3
5. Относительная плотность паров органического вещества по водороду равна 45. При сжигании 10,8 г этого вещества выделилось 10,75 л СО2 и 10,8 г воды. Установите молекулярную формулу органического вещества. Ответ: С4Н10О2
6. При действии натрия на 2,48 г этиленгликоля выделился газ. Определите массу натрия, вступившего в реакцию.
Ответ: 1,84 г
7. Определите массу 90% азотной кислоты и массу глицерина, пошедшей для получения 45,4 г нитроглицерина.
Ответ: 18,4 г С3Н8О3, 42 г НNО3
8. При нитровании 110,4 г глицерина получен тринитроглицерин массой 205 г. Определите выход продукта реакции. Ответ: 75,2%.
9. Какую массу тринитроглицерина можно получить из
18,4 г глицерина и 47,3 г 80% раствора азотной кислоты, если выход продукта реакции составил 70%. Ответ: 31,78 г.
10. Определите объем метана пошедшего на получение
12,4 г этиленгликоля, если выход продукта реакции на стадии дегидрирования и окисления составил по 90%. Ответ: 11 л.
11. 6,8 г этиленгликоля сожгли и продукты сгорания пропустили через раствор гидроксида кальция. При этом выпало 20 г осадка. Определите содержание примеси в исходном спирте.
Ответ: 8,8%
12. Сожгли 9,25 г смеси этиленгликоля и глицерина и продукты реакции, после приведения к нормальным условиям, пропустили через раствор гидроксида бария. Выпало 59,1 г осадка. Рассчитайте массовую долю веществ в исходной смеси.
Ответ: 50,3 % С2Н6О2; 49,7% С3Н8О3
Глава 13. Фенолы.
 Фенолы – гидроксильные производные аренов, в молекулах которых гидроксильная группа связана непосредственно с углеродным атомом бензольного ядра.
Фенолы – гидроксильные производные аренов, в молекулах которых гидроксильная группа связана непосредственно с углеродным атомом бензольного ядра.
Общая формула фенолов Ar – ОН.
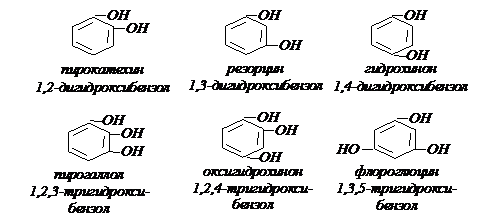
В зависимости от числа групп ОН, связанных с ядром, различают одно – двух – и трехатомные фенолы.

 13.1 Изомерия, номенклатура. Метильному гомологу фенола
13.1 Изомерия, номенклатура. Метильному гомологу фенола  соответствуют три изомера:
соответствуют три изомера:
Изомерия двух – и трехатомных фенолов обусловлена положением гидроксильных групп:
13.2 Способы получения. Фенол и крезолы (о-, м-, п-) получают из каменноугольной смолы. В синтетических методах исходным сырьем служат бензол или кумол.
1. Кумольный способ (1947г.П.Г.Сергеев и д.р.). Из бензола и пропилена получают изопропилбензол (кумол):
 Кумол окисляют кислородом воздуха:
Кумол окисляют кислородом воздуха:
 При нагревании в присутствии Н2SО4 гидропероксид кумола разлагается на два ценных продукта – фенол и ацетон:
При нагревании в присутствии Н2SО4 гидропероксид кумола разлагается на два ценных продукта – фенол и ацетон:
Этот способ является основным промышленным способом получения фенола.
2.Сплавление солей сульфокислот со щелочами:

Этот метод используется в основном для получения многоатомных фенолов:
3.Гидролиз галогенопроизводных:
4.Окислением толуола в присутствии солей меди и магния:
13.3 Физико-химические свойства. Одноатомные фенолы – кристаллические вещества, плохо растворимы в воде. С увеличением числа гидроксильных групп растворимость фенолов увеличивается. Двухатомные фенолы хорошо растворимы в воде. Фенолы – ядовитые вещества.
Химические свойства. Гидроксильная группа и бензольное ядро в фенолах взаимно влияют друг на друга, что обусловливает специфичность свойств фенолов в отличие от спиртов.
Реакции, протекающие с участием группы ОН.
Кислотные свойства фенолов. Влияние бензольного ядра на гидроксильную группу.
 Фенолы, как и спирты, не изменяют окраску индикатора, но кислотные свойства в них выражены сильнее. Объясняется это влиянием бензольного ядра на группу ОН. Неподеленная пара электронов атома кислорода вступает в сопряжение p - электронной системой бензольного ядра. Это приводит к смещению электронной плотности в сторону кольца. В результате связь О – Н еще более поляризуется и легче отщепляется протон водорода:
Фенолы, как и спирты, не изменяют окраску индикатора, но кислотные свойства в них выражены сильнее. Объясняется это влиянием бензольного ядра на группу ОН. Неподеленная пара электронов атома кислорода вступает в сопряжение p - электронной системой бензольного ядра. Это приводит к смещению электронной плотности в сторону кольца. В результате связь О – Н еще более поляризуется и легче отщепляется протон водорода:
Поэтому, в отличие от спиртов, фенолы образуют феноляты не только со щелочными металлами, но и с растворами щелочей:
С6Н5ОН + NаОН ¾® С6Н5ОNа + Н2О
Феноляты, подобно солям слабых кислот и сильных оснований легко гидролизуются:

С6Н5ОNа +Н – ОН С6Н5ОН + NаОН
Следовательно, фенолы – слабые кислоты. Например, фенол слабее угольной кислоты в 3000 раз и поэтому фенолы не разлагают солей угольной кислоты, а Н2СО3 вытесняет фенол из фенолят:
С6Н5ОNа+СО2+Н2О ¾® С6Н5ОН + NаНСО3
 Кислотность фенолов зависит от характера заместителей в ядре. Электроноакцепторные группы (NО2, галогены и др.) усиливают кислотные свойства. Например, тринитрофенол:
Кислотность фенолов зависит от характера заместителей в ядре. Электроноакцепторные группы (NО2, галогены и др.) усиливают кислотные свойства. Например, тринитрофенол:
Является сильной кислотой и называется пикриновой кислотой.
Взаимодействие фенолят с галогенпроизводными, при этом образуются простые эфиры:
Ar – ONa + RX ¾® Ar – O – R + NaX
С6Н5ОNа + СН3J ¾® С6Н5 – О – СН3 + NaJ
 Взаимодействие с галогенангидридами кислот, образуются сложные эфиры:
Взаимодействие с галогенангидридами кислот, образуются сложные эфиры:
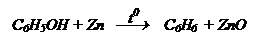 Восстановлени е. При перегонке с Zn (пыль) образуются арены:
Восстановлени е. При перегонке с Zn (пыль) образуются арены:
Реакции бензольного ядра.
1. Реакции электрофильного замещения. Влияние группы ОН на бензольное ядро. Группа ОН являясь заместителем первого рода увеличивают электронную плотность в о- и п- положениях, поэтому рекции замещения с фенолами протекают легче, чем с бензолом.
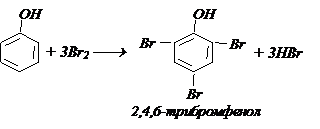 а) Галогенирование. При действии бромной воды образуется белый осадок – реакция качественная на фенол:
а) Галогенирование. При действии бромной воды образуется белый осадок – реакция качественная на фенол:
 При действии хлора, образуются о- п- изомеры:
При действии хлора, образуются о- п- изомеры:
 б) Нитрование. При действии разбавленной азотной кислоты при комнатной температуре образуется о- п- нитрофенолы, а при действии концентрированной кислоты получается тринитрофенол (пикриновая кислота).
б) Нитрование. При действии разбавленной азотной кислоты при комнатной температуре образуется о- п- нитрофенолы, а при действии концентрированной кислоты получается тринитрофенол (пикриновая кислота).
в) Сульфирование - взаимодействие фенола с серной кислотой образуются:
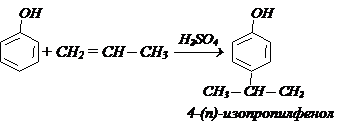 г) Алкилирование – взаимодействие фенолов с алкенами и спиртами в присутствии AlCl3, Н2SО4 образу.тся о- п- изомеры. Например:
г) Алкилирование – взаимодействие фенолов с алкенами и спиртами в присутствии AlCl3, Н2SО4 образу.тся о- п- изомеры. Например:
д) Конденсация фенолов с альдегидами образуются фенолформальдегидные смолы. Например:
е) Гидрирование.
ж)Окисление. В отличие от бензола фенолы окисляются легко. Фенол с FeCl3 дает фиолетовое окрашивание, крезолы – синее. Эти реакции являются качественными на фенолы.
Отдельные представители.
Фенол (карболовая кислота) С6Н5ОН – бесцветное кристаллическое вещество, tпл=43 0С, со специфическим запахом. На воздухе окисляется, розовеет, темнеет. Плохо растворим в холодной воде, хорошо – в горячей, в спирте, эфире, бензоле. Является сильным антисептиком. При попадании на кожу вызывает ожоги. Фенол можно получить также в промышленности циклогексановым методом:

Окислительной конденсацией бензола и уксусной кислоты:
 Фенол используется для получения полимеров, красителей, синтетических волокон, лекарственных и взрывчатых веществ, гирбицидов и др. продуктов.
Фенол используется для получения полимеров, красителей, синтетических волокон, лекарственных и взрывчатых веществ, гирбицидов и др. продуктов.
Крезолы (о- м- п- крезолы) получают из
каменоугольной смолы. Применяются они для получения синтетических смол, красителей, ядохимкатов. Используются в качестве антисептиков.
Двух- и трехатомные фенолы – кристаллические вещества, растворимые в воде. В промышленности получают сплавлением солей сульфокислот, а также:

Многоатомные фенолы используют для синтеза красителей, полимеров, лекарственных веществ.
Пикриновая кислота (2,4,6-тринитрофенол) С6Н2(NО2)3ОН – кристаллическое вещество желтого цвета, tпл=121,8 0С. Применяется в производстве азокрасителей и взрывчатых веществ.
Ароматические спирты.Бензиловый спирт.
С6Н5-СН2ОН – жидкость плохо растворимая в воде, tкип=206 0С. В промышленности получают:
- гидролизом хлористого бензила
| |
| | | С6Н5 – СН2Сl + НОН ¾® С6Н5 – СН2ОН + НСl
| |
 - восстановлением бензальдегида:
- восстановлением бензальдегида:
 Из бензола и оксида этилена получают
Из бензола и оксида этилена получают
b-фенилэтиловый спирт:
Бензиловый спирт проявляет свойства предельных спиров, например:
2С6Н5 – СН2ОН + 2Nа ¾® 2С6Н5 – СН2ОNа + Н2
Легко заменяет группу ОН на галоген:
С6Н5 – СН2ОН + НСl «С6Н5СН2Сl + Н2О
 b-спирты легко теряют воду:
b-спирты легко теряют воду:
Применяется бензиловый спирт в парфюмерии и пищевой промышленности.
Вопросы для самоконтроля.
1. Какие соединения называются фенолами? Их общая формула.
2. Классификация фенолов, изомерия, номенклатура.
3. Способы получения фенолов.
4. Физические свойства фенолов.
5. Химические свойства фенолов. Взаимное влияние функциональных групп.
6. Кислотные свойства фенолов в сравнении с предельными спиртами.
7. Влияние заместителей I и II рода на кислотные свойства фенола.
8. Реакции бензольного ядра. Влияние гидроксильной группы на бензольное ядро.
9. Промышленные способы получения фенола.
10. Напишите уравнения реакций получения двухатомных фенолов.
11. Отличительные свойства бензилового спирта от фенолов.
12. Напишите структурные формулы: а) м- нитрофенола; б) п-изопропилфенола; в) резорцина; г) пикриновой кислоты.
 13. Назовите соединения:
13. Назовите соединения:
14. Напишите уравнения реакций взаимодействия:
а) о-крезола с натрием; б) о-крезола с гидроксидом калия;
в) фенола с H2SО4; г) фенола с этиленом; д) 2,6-диметилфенола с бромной водой.
15. Осуществиете следующие превращения, написав уравнения реакций:

13.6 Обучающее задание №1.
Напишите структурные формулыизомерных ароматических соединений состава С7Н8О и назовите их.

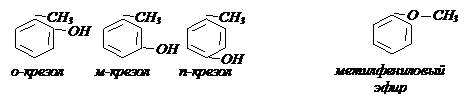 Решение: Так как С7Н8О относится к ароматическим, следовательно в его составе есть бензольное ядро, а в боковой цепи содержится один атом углерода и атом кислорода. Этой формуле будут соответствовать:
Решение: Так как С7Н8О относится к ароматическим, следовательно в его составе есть бензольное ядро, а в боковой цепи содержится один атом углерода и атом кислорода. Этой формуле будут соответствовать:
Обучающее задание №2.
 Осуществите превращения:
Осуществите превращения:
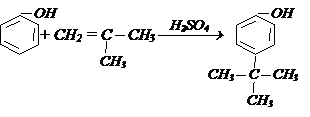 Решение:
Решение:
Обучающее задание №3.
Используя любые неорганические реагенты и катализаторы получите из метана 2,4,6-трибромфенол.
 Решение:
Решение:
 В начале из СН4 необходимо получить бензол:
В начале из СН4 необходимо получить бензол:

 Затем получаем фенол:
Затем получаем фенол:
Обучающее задание №4.
 Имея в наличии известняк и любые неорганические реагенты получите резорцин.
Имея в наличии известняк и любые неорганические реагенты получите резорцин.
Решение:
Обучающее задание №5.
Имеется смесь фенола с этиловым спиртом. К одной половине смеси добавили избыток натрия, выделилось 0,672 л Н2 (н.у.). К другой половине добавили избыток раствора бромной воды, при этом образовалось 6,62 г осадка. Определите массовую долю веществ в исходной смеси.
 Решение: Напишем уравнения реакций. С бромной водой взаимодействует только фенол.
Решение: Напишем уравнения реакций. С бромной водой взаимодействует только фенол.
| |
| | | М(С6Н2ОНВr3) = 331 г/моль
| |
Определяем количество осадка: 
 подставим в уравнение, следовательно n(фен) = 0,02 моль. С натрием взаимодействуют фенол и этанол:
подставим в уравнение, следовательно n(фен) = 0,02 моль. С натрием взаимодействуют фенол и этанол:
Определяем количество Н2 по формуле: 

Из реакции (I) по фенолу определяем в реакции (II) количество водорода: n(Н2) = 0,01 моль. Следовательно, в реакции (III) n(Н2) = 0,03 – 0,01 = 0,02 моль подставим в уравнение (III), тогда n(С2Н5ОН) = 0,02*2 = 0,04 моль. Определяем массы веществ и массу смеси:
m(C6Н5ОН) = nС6Н5ОН*МС6Н5ОН = 0,02*94 = 1,88 г.
m(С2Н5ОН) = nС2Н5ОН*МС2Н5ОН = 0,04*46 = 1.84 г.
mсмеси = mС6Н5ОН + mС2Н5ОН; mсмеси = 1,88 + 1,84 = 3,72 г.

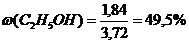
Ответ: 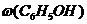 =50,5%;
=50,5%;  =49,5%
=49,5%
Обучающее задание №6.
Фенол массой 32,9 г обработали избытком раствора азотной кислоты, выделилось 70 г пикриновой кислоты. Определите, с каким выходом прошла реакция нитрования.
Решение:напишем уравнение реакции нитрования:
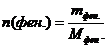
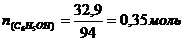
n(С6Н5ОН) = n(осадка) = 0,35 моль
mосадка = n*М(С6Н2(NO2)3ОН); mосадка = 0,35*229 = 80,15 г – это теоретический выход продукта. mпрак = 70 г
 Ответ: 87,3%
Ответ: 87,3%
Обучающее задание №7.
 При действии избытком натрия на фенол выделилось 4,48 л газа (н.у.) при выходе реакции 80%. Определите массу вступившего фенола.
При действии избытком натрия на фенол выделилось 4,48 л газа (н.у.) при выходе реакции 80%. Определите массу вступившего фенола.
Решение:
Определяем  - это практический выход, необходимо определить теоретический выход из формулы:
- это практический выход, необходимо определить теоретический выход из формулы: 
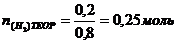
Определяем: n(С6Н5ОН)=0,25*2=0,5моль;
m(С6Н5ОН)=nС6Н5ОН*МС6Н5ОН;
m(С6Н5ОН) = 0,5*94 = 47 г.
Ответ: 47г.
13.7 Контрольные задания.
1. Расположите следующие органические вещества в порядке увеличения кислотных свойств: метиловый спирт; этиленгликоль; этиловый спирт; фенол; глицерин; о-нитрофенол; изопропиловый спирт.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, указав условия протекания реакции:
а) циклогексан ¾® бензол ¾® изопропилбензол ¾® фенол;
 б) карбид кальция ® ацетилен ® бензол ® бромбензол ® фенол ® пикриновая кислота;
б) карбид кальция ® ацетилен ® бензол ® бромбензол ® фенол ® пикриновая кислота;

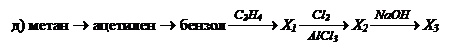
3. Осуществите превращения, используя неорганические реагенты. Укажите условия протекания реакций:
а) карбид алюминия ® о-метилфенол;
б) этана ® м-этилфенол;
в) метана ® трибромфенол;
г) этена ® фенилэтиловый эфир;
д) метана ® п-этилфенол.
4. В четырех пробирках находится фенол, бензол, этиленгликоль, этиловый спирт. Определите с помощью химических реакций эти соединения.
5. Установите молекулярную формулу органического соединения, при сжигании 24,8 его образовалось 31,36 г углекислого газа (н.у.) и 14,4 г воды. Относительная плотность паров органического вещества по водороду равна 62.
Ответ: С7Н8О2
6. При действии на фенол избытка натрия выделилось 6,72 л водорода (н.у.) при выходе реакции 80%. Рассчитайте массу прореагировавшего фенола.
Ответ: 70,5г.
7. Определите массу фенолята натрия, образующегося при действии 13,5 гидроксида натрия на 28,2 г фенола, если выход реакции составил 90%.
Ответ: 31,32
8. На смесь фенола с бензолом массой 200 г. подействовали избытком натрия. Массовая доля бензола в смеси составляет 6%. Определите объем выделившегося газа, если его выход составляет 80%.
Ответ: 17,92 л.
9. Определите массу 10,0%-ного раствора гидроксида натрия, необходимого для нейтрализации фенола, полученного из 60 г бензола, содержащего 22% примесей.
Ответ: 240 г.
10. К 300 г. 1,5%-ного раствора гидроксида калия добавили метилфенол. Вещества вступили в реакцию полностью. Определите массовую долю образовавшегося вещества в полученном растворе.
Ответ: 3,8%
11. При действии на фенол бромной водой, содержащей
4,8 г брома выпал осадок массой 2,5 г. Определите выход продукта реакции.
Ответ: 75,5%
12. На нейтрализацию 7,7 г смеси фенола и уксусной кислоты потребовалось 40 г. 10% раствора гидроксида натрия. При действии на исходную смесь той же массы бромной водой образовалось 16,55 г осадка. Определите массу фенола и массу уксусной кислоты в исходной смеси.
Ответ: 3 г. СН3СООН; 4,7 г фенола.
13. 14,7 г. смеси фенола и гомолога бензола обработали бромной водой, при этом выпало 33,1 г. осадка. Определите формулу арена, если известно, что молярное соотношение фенола к арену равно 2:1. Напишите формулы всех изомеров арена.
Ответ: С8Н10
14. При действии избытка натрия на смесь фенола и этилового спирта выделилось 6,72 л водорода (н.у.). Для полной нейтрализации этой смеси потребовалось 25 мл 40% раствора гидроксида калия (r = 1,4 г/мл). Определите массовую долю веществ в исходной смеси.
Ответ: 40,4% С2Н5ОН; 59,6% С6Н5ОН.
15. Смесь о-крезола и этиленгликоля массой 61,2 г. обработали избытком калия, в результате чего выделилось 20,7 л газа (н.у.). Определите массовые д



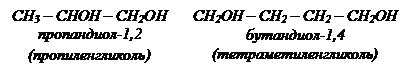

 гидролиз полигалогенопроизводных:
гидролиз полигалогенопроизводных: получение из синтез-газа при нагревании под давлением в присутствии катализатора:
получение из синтез-газа при нагревании под давлением в присутствии катализатора:
 гидратацией окиси этилена получается этиленгликоль:
гидратацией окиси этилена получается этиленгликоль: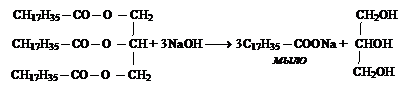 а) омылением жиров:
а) омылением жиров:
 в) окислением пропилена:
в) окислением пропилена: 1. Образование гликолятов, глицератов. В отличие от одноатомных спиртов многоатомные спирты легко вступают в реакции не только со щелочными металлами, но и с гидроксидами тяжелых металлов. Например:
1. Образование гликолятов, глицератов. В отличие от одноатомных спиртов многоатомные спирты легко вступают в реакции не только со щелочными металлами, но и с гидроксидами тяжелых металлов. Например:


 а) внутримолекулярная – из одной молекулы спирта выделяется молекула воды:
а) внутримолекулярная – из одной молекулы спирта выделяется молекула воды: б) межмолекулярная – из двух молекул спирта выделяется молекула воды:
б) межмолекулярная – из двух молекул спирта выделяется молекула воды: Замена гидроксильных групп на галогены.
Замена гидроксильных групп на галогены. 

 Образование сложных эфиров. Глицерин взаимодействует со смесью концентрированных НNО3 и Н2SО4 образует сложный эфир тринитрат глицерина под названием нитроглицерин.
Образование сложных эфиров. Глицерин взаимодействует со смесью концентрированных НNО3 и Н2SО4 образует сложный эфир тринитрат глицерина под названием нитроглицерин.
 8. Назовите по международной номенклатуре следующие спирты:
8. Назовите по международной номенклатуре следующие спирты:
 Охарактеризуйте и назовите по международной номенклатуре следующее соединение:
Охарактеризуйте и назовите по международной номенклатуре следующее соединение:
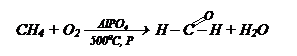 1) Неполное окисление метана СН4:
1) Неполное окисление метана СН4:
 3) Реакция брожения глюкозы в присутствии сульфита натрия:
3) Реакция брожения глюкозы в присутствии сульфита натрия: II способ.
II способ.
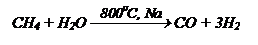 III способ:
III способ:
 Определяем количество молей атомов углерода и водорода и их массы:
Определяем количество молей атомов углерода и водорода и их массы:



 m(С) + m(Н) = 21 + 4,2 = 25,2 г < 47,6 г, следовательно в органическом веществе есть кислород. Определяем массу и количество молей атомов кислорода:
m(С) + m(Н) = 21 + 4,2 = 25,2 г < 47,6 г, следовательно в органическом веществе есть кислород. Определяем массу и количество молей атомов кислорода:



 Решение: Напишем уравнения реакций взаимодействия спиртов с натрием
Решение: Напишем уравнения реакций взаимодействия спиртов с натрием
 Определяем количество водорода:
Определяем количество водорода: Это количество выделилось из реакции (I, II).
Это количество выделилось из реакции (I, II).  Определяем количество Сu(ОН)2.
Определяем количество Сu(ОН)2.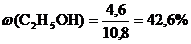
 m(С2Н5ОН) = 0,1*46 = 4,6 г; m(С2Н6О2) = 0,1*62 = 6,2 г. mсм= 4,6+6,2 = 10,8 г.
m(С2Н5ОН) = 0,1*46 = 4,6 г; m(С2Н6О2) = 0,1*62 = 6,2 г. mсм= 4,6+6,2 = 10,8 г.
 б) пропан ¾® пропен ¾® 3-хлорпропен ¾® 1,2,3-трихлорпропан ¾® глицерин;
б) пропан ¾® пропен ¾® 3-хлорпропен ¾® 1,2,3-трихлорпропан ¾® глицерин; Фенолы – гидроксильные производные аренов, в молекулах которых гидроксильная группа связана непосредственно с углеродным атомом бензольного ядра.
Фенолы – гидроксильные производные аренов, в молекулах которых гидроксильная группа связана непосредственно с углеродным атомом бензольного ядра.

 13.1 Изомерия, номенклатура. Метильному гомологу фенола
13.1 Изомерия, номенклатура. Метильному гомологу фенола  соответствуют три изомера:
соответствуют три изомера:

 Кумол окисляют кислородом воздуха:
Кумол окисляют кислородом воздуха: При нагревании в присутствии Н2SО4 гидропероксид кумола разлагается на два ценных продукта – фенол и ацетон:
При нагревании в присутствии Н2SО4 гидропероксид кумола разлагается на два ценных продукта – фенол и ацетон:



 Фенолы, как и спирты, не изменяют окраску индикатора, но кислотные свойства в них выражены сильнее. Объясняется это влиянием бензольного ядра на группу ОН. Неподеленная пара электронов атома кислорода вступает в сопряжение p - электронной системой бензольного ядра. Это приводит к смещению электронной плотности в сторону кольца. В результате связь О – Н еще более поляризуется и легче отщепляется протон водорода:
Фенолы, как и спирты, не изменяют окраску индикатора, но кислотные свойства в них выражены сильнее. Объясняется это влиянием бензольного ядра на группу ОН. Неподеленная пара электронов атома кислорода вступает в сопряжение p - электронной системой бензольного ядра. Это приводит к смещению электронной плотности в сторону кольца. В результате связь О – Н еще более поляризуется и легче отщепляется протон водорода:
 Кислотность фенолов зависит от характера заместителей в ядре. Электроноакцепторные группы (NО2, галогены и др.) усиливают кислотные свойства. Например, тринитрофенол:
Кислотность фенолов зависит от характера заместителей в ядре. Электроноакцепторные группы (NО2, галогены и др.) усиливают кислотные свойства. Например, тринитрофенол: Взаимодействие с галогенангидридами кислот, образуются сложные эфиры:
Взаимодействие с галогенангидридами кислот, образуются сложные эфиры:
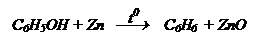 Восстановлени е. При перегонке с Zn (пыль) образуются арены:
Восстановлени е. При перегонке с Zn (пыль) образуются арены: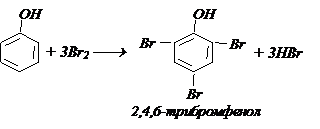 а) Галогенирование. При действии бромной воды образуется белый осадок – реакция качественная на фенол:
а) Галогенирование. При действии бромной воды образуется белый осадок – реакция качественная на фенол: При действии хлора, образуются о- п- изомеры:
При действии хлора, образуются о- п- изомеры: б) Нитрование. При действии разбавленной азотной кислоты при комнатной температуре образуется о- п- нитрофенолы, а при действии концентрированной кислоты получается тринитрофенол (пикриновая кислота).
б) Нитрование. При действии разбавленной азотной кислоты при комнатной температуре образуется о- п- нитрофенолы, а при действии концентрированной кислоты получается тринитрофенол (пикриновая кислота).


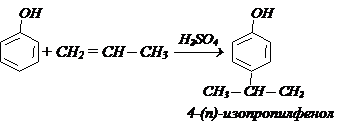 г) Алкилирование – взаимодействие фенолов с алкенами и спиртами в присутствии AlCl3, Н2SО4 образу.тся о- п- изомеры. Например:
г) Алкилирование – взаимодействие фенолов с алкенами и спиртами в присутствии AlCl3, Н2SО4 образу.тся о- п- изомеры. Например: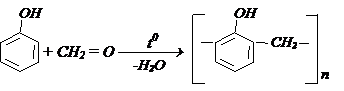



 Фенол используется для получения полимеров, красителей, синтетических волокон, лекарственных и взрывчатых веществ, гирбицидов и др. продуктов.
Фенол используется для получения полимеров, красителей, синтетических волокон, лекарственных и взрывчатых веществ, гирбицидов и др. продуктов.
 - восстановлением бензальдегида:
- восстановлением бензальдегида: Из бензола и оксида этилена получают
Из бензола и оксида этилена получают  b-спирты легко теряют воду:
b-спирты легко теряют воду: 13. Назовите соединения:
13. Назовите соединения:

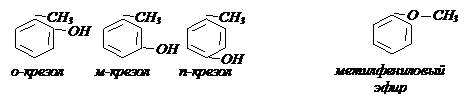 Решение: Так как С7Н8О относится к ароматическим, следовательно в его составе есть бензольное ядро, а в боковой цепи содержится один атом углерода и атом кислорода. Этой формуле будут соответствовать:
Решение: Так как С7Н8О относится к ароматическим, следовательно в его составе есть бензольное ядро, а в боковой цепи содержится один атом углерода и атом кислорода. Этой формуле будут соответствовать: Осуществите превращения:
Осуществите превращения: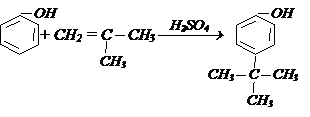 Решение:
Решение:
 Решение:
Решение: В начале из СН4 необходимо получить бензол:
В начале из СН4 необходимо получить бензол:
 Затем получаем фенол:
Затем получаем фенол:
 Имея в наличии известняк и любые неорганические реагенты получите резорцин.
Имея в наличии известняк и любые неорганические реагенты получите резорцин.
 Решение: Напишем уравнения реакций. С бромной водой взаимодействует только фенол.
Решение: Напишем уравнения реакций. С бромной водой взаимодействует только фенол.
 подставим в уравнение, следовательно n(фен) = 0,02 моль. С натрием взаимодействуют фенол и этанол:
подставим в уравнение, следовательно n(фен) = 0,02 моль. С натрием взаимодействуют фенол и этанол:



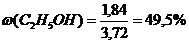
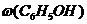 =50,5%;
=50,5%;  =49,5%
=49,5%
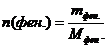
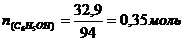
 Ответ: 87,3%
Ответ: 87,3% При действии избытком натрия на фенол выделилось 4,48 л газа (н.у.) при выходе реакции 80%. Определите массу вступившего фенола.
При действии избытком натрия на фенол выделилось 4,48 л газа (н.у.) при выходе реакции 80%. Определите массу вступившего фенола. - это практический выход, необходимо определить теоретический выход из формулы:
- это практический выход, необходимо определить теоретический выход из формулы: 
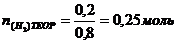
 б) карбид кальция ® ацетилен ® бензол ® бромбензол ® фенол ® пикриновая кислота;
б) карбид кальция ® ацетилен ® бензол ® бромбензол ® фенол ® пикриновая кислота;