Двухосновными карбоновыми кислотами называют соединения, содержащие в молекуле две карбоксильные группы.
Простейшей является щавелевая кислота:
НООС – СООН этандиовая кислота;
НООС – СН2 – СООН малоновая, пропандиовая кислота;
НООС – (СН2)2 – СООН янтарная, бутандиовая кислота;
НООС – (СН2)3 – СООН глутаровая, пентандиовая кислота;
НООС – (СН2)4 – СООН адипиновая, гександиовая кислота.
По систематической номенклатуре они называются следующим образом: к названию углеводорода основной цепи прибавляется окончание диовая и слово кислота. Например:
НООС – СН = СН – СООН
бутендиовая кислота
Способы получения:
 окисление двухатомных спиртов:
окисление двухатомных спиртов:
 омылением динитрилов:
омылением динитрилов:
дегидратация гидроксикислот:
| |
| | | НООС – СНОН – СН2 – СООН ¾® НООС – СН = СН – СООН + Н2О
| |
Физико-химические свойства.
Дикарбоновые кислоты – кристаллические вещества, растворимые в воде, но с увеличением числа атомов углерода в молекуле кислоты растворимость уменьшается. Они более сильные кислоты, чем соответствующие одноосновные. Объясняется это взаимным влиянием друг на друга карбоксильных групп. Чем ближе эти группы расположены, тем сильнее кислота.
 Диссоциация кислот:
Диссоциация кислот:
Двухосновные кислоты вступают в реакции, характерные для одноосновных кислот. Они могут образовывать соли, кислые (вступает в реакцию одна группа СООН) и средние (вступают в реакцию две группы СООН), кислые и средние сложные эфиры, полные и неполные хлорангидриды и др. Например:
Реакции декарбоксилирования. Для кислот, в которых карбоксильные группы находятся в положениях 1,2 (щавелевая кислота) и 1,3 (малоновая кислота) при нагревании выделяют
СО2.
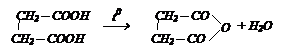 Реакция дегидратации. Дикарбоновые кислоты, содержащие группы СООН в положениях 1,4 (янтарная кислота) и 1,5 (глутаровая кислота) при нагревании выделяют воду, образуя циклические ангидриды.
Реакция дегидратации. Дикарбоновые кислоты, содержащие группы СООН в положениях 1,4 (янтарная кислота) и 1,5 (глутаровая кислота) при нагревании выделяют воду, образуя циклические ангидриды.
Щавелевая кислота НООС – СООН – кристаллическое вещество. Широко распространена в природе как в свободном виде, так и виде солей – оксалатов (K+; Na+; Са2+). Щавелевая кислота и оксалаты щелочных металлов хорошо растворимы в воде, а СаС2О4 - нерастворим. В промышленности щавелевую кислоту получают из формиата натрия:
| 3Н2С2О4 + 2КMnО4 ¾® 6СО2 + 2MnО2 + 2КОН + 2Н2О
| |

Характерными свойствами щавелевой кислоты являются описанная выше способность декарбоксилироваться и ее окисляемость.
Щавелевая кислота применяется при крашении тканей, для удаления ржавчины и накипи, в производстве красителей, в кожевенной и деревообрабатывающей промышленностях.
Малоновая кислота НООС – СН2 – СООН – криталлическое вещество. В промышленности получают действием НСN на хлоруксусную кислоту с последующим гидролизом.
Карбоксильные группы этой кислоты активизируют атомы водорода в группе СН2 и они легко замещаются на щелочные металлы. Наиболее важным соединением этой кислоты является диэтиловый эфир, называемый малоновым эфиром. Взаимодействуя с натрием, последующим действием галогенопроизводных и декарбоксилированием полученных продуктов, малоновая кислота дает возможность получать различные соединения. Например:
Малеиновая и фумаровая кислоты:
НООС – СН = СН – СООН
 Они имеют одну эмпирическую формулу, но имеют различное пространственное строение.
Они имеют одну эмпирическую формулу, но имеют различное пространственное строение.
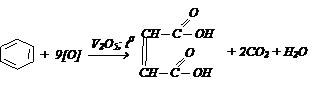 В промышленности малеиновую кислоту получают окислением бензола:
В промышленности малеиновую кислоту получают окислением бензола:
Малеиновая кислота легко переходит в более устойчивую фумаровую кислоту под действием Br2; HNO3. Малеиновая кислота ядовитая, более сильная, хорошо растворима в Н2О, фумаровая мало растворима. Для этих кислот характерны реакции по двойной связи (присоединяют Н2, галогены, галогенводород) и по карбоксильным группам: образуют соли, эфиры, амиды и т.д. При действии Н2 обе кислоты переходят в янтарную кислоту:

 Это доказывает их одинаковое химическое строение. Но только из малеиновой кислоты получается малеиновый ангидрид – активное соединение, что доказывает ее цис-форму:
Это доказывает их одинаковое химическое строение. Но только из малеиновой кислоты получается малеиновый ангидрид – активное соединение, что доказывает ее цис-форму:
Малеиновый ангидрид используется в производстве полиэфирных полимеров, в качестве отвердителя эпоксидных смол, для получения фармацевтических препаратов.
Адипиновая кислота НООС – (СН2)4 – СООН – белое кристаллическое вещество, хорошо растворимое в спирте, трудно в холодной воде. В промышленности получают:
 - окислением циклогексана:
- окислением циклогексана:
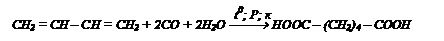 - из бутадиена оксосинтезом:
- из бутадиена оксосинтезом:
Используется для получения синтетического волокна найлона, как заменитель лимонной и винной кислот, в производстве пластмасс.



 окисление двухатомных спиртов:
окисление двухатомных спиртов: омылением динитрилов:
омылением динитрилов: Диссоциация кислот:
Диссоциация кислот:

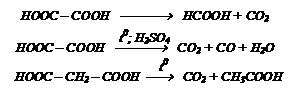
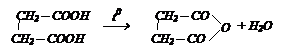 Реакция дегидратации. Дикарбоновые кислоты, содержащие группы СООН в положениях 1,4 (янтарная кислота) и 1,5 (глутаровая кислота) при нагревании выделяют воду, образуя циклические ангидриды.
Реакция дегидратации. Дикарбоновые кислоты, содержащие группы СООН в положениях 1,4 (янтарная кислота) и 1,5 (глутаровая кислота) при нагревании выделяют воду, образуя циклические ангидриды.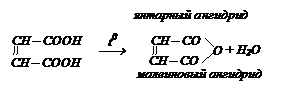

 Характерными свойствами щавелевой кислоты являются описанная выше способность декарбоксилироваться и ее окисляемость.
Характерными свойствами щавелевой кислоты являются описанная выше способность декарбоксилироваться и ее окисляемость.

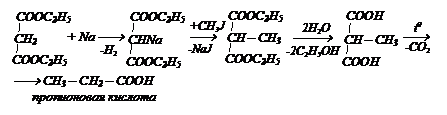
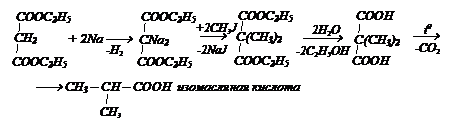
 Они имеют одну эмпирическую формулу, но имеют различное пространственное строение.
Они имеют одну эмпирическую формулу, но имеют различное пространственное строение.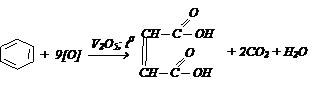 В промышленности малеиновую кислоту получают окислением бензола:
В промышленности малеиновую кислоту получают окислением бензола:
 Это доказывает их одинаковое химическое строение. Но только из малеиновой кислоты получается малеиновый ангидрид – активное соединение, что доказывает ее цис-форму:
Это доказывает их одинаковое химическое строение. Но только из малеиновой кислоты получается малеиновый ангидрид – активное соединение, что доказывает ее цис-форму: - окислением циклогексана:
- окислением циклогексана: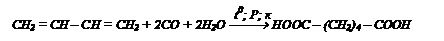 - из бутадиена оксосинтезом:
- из бутадиена оксосинтезом:


