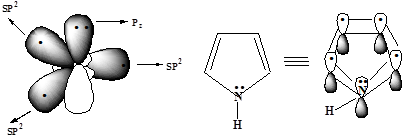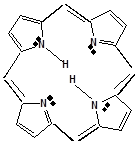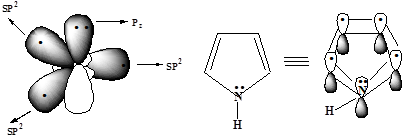
3. Общая π-электронная плотность пиррола включает в себя 4n+2 = 6 р-электронов
В фуране и тиофене ароматический секстет также включает неподеленную пару электронов негибридизованной p-АО кислорода или серы соответственно. В имидазоле и пиразоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару π-электронов, а пиридиновый - один p-электрон.

Ароматичностью обладает также пурин, представляющий собой конденсированную систему двух гетероциклов - пиримидина и имидазола.
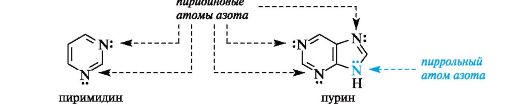
Делокализованное электронное облако в пурине включает 8 π-электронов двойных связей и неподеленную пару электронов атома N=9. Общее число электронов в сопряжении, равное десяти, соответствует формуле Хюккеля (4n + 2, где п = 2).
Гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью. Неудивительно, что именно они служат структурными единицами важнейших биополимеров - нуклеиновых кислот.
Системы, имеющие пиррольный азот называют p-избыточными или суперароматическими системами. Наличие такой системы сильно влияет на реакционную способность пиррола
В природных соединениях ароматический пиррольный цикл часто встречается в различных многоядерных соединениях, из которых наиболее важное значение имеет порфиновое ядро, входящее в состав гемоглобина и хлорофилла
ПОРОФИН
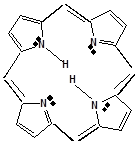
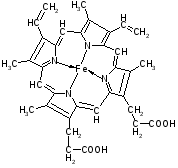
Гемоглобин –сложный белок, состоит из белковая часть – глобин, небелковая часть – гемм.
Гемм – ароматическая плоская структура, содержащая Fe, который связан 6 координационными связями с одной стороны с глобином, с другой с атомами азота пирральных колец гемма, 1-с атомом азота гистидина, 1 – с молекулой кислорода.

Поляризация связей. Электронные эффекты – индуктивный и мезомерный как причина неравномерного распределения электронной плотности и возникновения реакционных центров в молекуле. Электронодонорные и электроноакцепторные заместители.
Одно из положений теории А.М. Бутлерова свидетельствует о взаимном влиянии атомов.Наиболее сильное взаимное влияние оказывают атомы непосредственно связанные друг с другом. Природу и механизм этого влияния можно объяснить с помощью теории электронных смещений. Существует два вида электронных смещений – 1)смещение электронной плотности в простых σ-связях и 2)смещение электронной плотности по сопряженной системе.
Индуктивный (индукционный) эффект – это смещение электронной плотности в простых или σ-связях, который возникает в силу различной электроотрицательности атомов. Обозначается индуктивный эффект буквой I.
Можно сказать, индуктивный эффект – это передача электронного влияния заместителя по цепи σ-связей
Индуктивный эффект по знаку может быть (+I) – положительный и (-I) –отрицательный в зависимости от того электронодонорные или электроноакцепторные свойства проявляют данный атом или атомная группа.
Электронодонорным называется такой заместитель, благодаря которому происходит повышение электронной плотности в цепи.
Электроноакцепторным называется такой за0меститель, благодаря которому происходит понижение электронной плотности в цепи.
Для изображения такого смещения используют (→) стрелку на σ-связи.
В молекулах углеводородов связь ковалентная неполярная т.е. электронная плотность в молекулах распределена равномерно. Рассмотрим индуктивный эффект на примере 1-хлорбутана в сравнении его с н-бутаном.
Н3С – СН2 - СН2 – СН3 Н3С – СН2 - СН2 – СН2 – Cl
Молекула н-бутана неполярна, т.к. электроотрицательность углерода и водорода приблизительно одинаковы, все атомы углерода находятся в sp3-гибридизации, т.е. и их электроотрицательность тоже одинакова, поэтому никакого смещения электронной плотности не происходит.
Введение в молекулу хлора приводит к тому, что молекула становится полярной, т.к. хлор более электроотрицательный элемент, чем углерод.
δ + δ+ δ+ δ+ δ-
Н3С → СН2 → СН2 → СН2 → – Cl
δ+ <δ+ <δ[D1] + <δ+
Уменьшение электронной плотности на атоме 1 приводит к тому что он проявляя электроакцепторные свойства «оттягивает» на себя электроны σ-связи от соседнего атома углерода, тот в свою очередь оттягивает электронную плотность на себя и т.д. Таким образом поляризация связи С-Cl вызывает элекронную асимметрию.
В основе оценки индуктивнго эффекта (+I, -I) лежит электроотрицательность элементов, в качестве стандарта служит атом водорода, индуктивный эффект которого равен 0.
Атомы и атомные группы, обладающие электроноакцепторными свойствами т.е. способные притягивать электроны, проявляют отрицательный индуктивный эффект (-I), а атомы или атомные группы, способные отталкивать от себя электронную плотность проявляют положительный индуктивный эффект (+I).
δ+ δ- δ- δ+
R - СН2 → Х R - СН2 - Н R - СН2 ← У
Х – акцепторная группа Стандарт У – донорная группа
(-I) (I = 0) (+I)
Отрицательным индуктивным эффектом обладают:
Х = -NO2, -OH, - NH2, -COH, -COR. –COOH, -SO3H, -OR, -SR, -SH, -Hal
Положительным индуктивным эффектом обладают:
У = алкильные группы (-CH3, -C2H5 и т.д.)
Особенности индуктивного эффекта:
1) Индуктивный эффект заместителей распространяется всегда в одном направлении.
2) Индуктивный эффект постепенно затухает, вызывая поляризацию максимум 3-4 связей.
Отрицательный индуктивный эффект атомов и атомных групп определяется их электроотрицательностью, с увеличением электроотрицательности усиливается и индукционное влияние заместителей. Его удобно рассматривать в пределах одного периода в ПСЭ.
В ряду алкильных радикалов, наибольшей электроноотталкивающей способностью, т.е. наибольшим +I эффектом обладают третичные радикалы, затем вторичные, наименьший +I эффект проявляют первичные радикалы.
CH3 CH3
| |
H3C – C - > H3 C – CH2 – CH - > H3C – CH2 – CH2 – CH2 -
|
CH3
Увеличение +I эффекта наблюдается с увеличением углеродной цепи в ряду предельных углеводородов:
- СН3< - C2H5< - C3H7< - C4H9
Все ненасыщенные и ароматические заместители оказывают –I эффект. Его относительная сила изменяется в следующем порядке:
- С ≡ СН >> -CH = CH2
Это связано с различной ЭО атомов углерода
Csp > Csp>Csp
уменьшение электроотрицательности
Относительную силу индуктивного влияния заместителей можно оценить, сравнивая некоторые свойства соединений лишь в ряду одного класса.
Хорошо иллюстрирует действие –I эффекта замещенные карбоновые кислоты:
O
║
HaL ← CH2 ← C ← O ← H
Чем более ЭО элементом является заместитель, тем сильнее должна стать кислота, ч то и наблюдается.
КИСЛОТА К 10-5
CH3 ← COOH 1,75
FCH2 ← COOH 260
ClCH2 ← COOH155
BrCH2 ← COOH 138
ICH2 ← COOH 75
Накопление электроотрицательных заместителей приводит к возрастанию –Iэффекта:
FCH2 ← COOH 260
F2CH ← COOH 5700
F3C ← COOH 58800
Удаление заместителя, вызывающего –I эффект, от карбоксильнай группы приводит к его снижению:
CH3 – CH2 – CH2 – COOH 1,5
CH3 – CH2 – CH – COOH 139
|
Cl
CH3 – CH – CH2 – COOH 8,9
|
Cl
CH2 – CH2 – CH2 – COOH 3
|
Cl
МЕЗОМЕРНЫЙ ЭФФЕКТ
Мезомерный эффект связан с сопряженной системой.
Влияние заместителя, передаваемое по сопряженной системе π-связей с перераспределением электронной плотности называется
Мезомерным эффектом (обозначают М).
Мезомерный эффект имеет место под влиянием заместителя, являющегося участником этой сопряженной системы. Для того чтобы заместитель сам входил в сопряженную систему, он должен иметь либо двойную связь (π-, π- сопряжение) либо гетероатом с неподеленной парой
( р, π -сопряжение).