Определение понятия болезнь
Болезнь - это сложная качественно новая реакция организма на действие чрезвычайного раздражителя, возникающая вследствие расстройства взаимодействия его с окружающей средой и характеризуется:
- нарушением функций и морфологических структур организма, регуляции функций и жизнедеятельности;
- расстройством взаимодействия организма с окружающей средой, т.е. снижением приспосабливаемости;
- ограничением работоспособности и социально-полезной деятельности.
Стадии развития болезни и их исходы
В развитии болезни можно различить три следующие стадии:
1. Начало болезни. Иногда его называют латентным периодом развития болезни. Некоторые авторы разделяют эту стадию на а) предболезнь и б) заболевание.
2. Стадия собственно болезни.
3. Исход болезни.
Предболезнь (т.е. переход от здоровья к болезни) - это снижение функциональной активности некоторых саногенетических механизмов или их комплексов, ведущее к расстройству саморегуляции и ослаблению резистентности организма. Предболезнь формируется под действием факторов внешней среды, но, в ряде случаев, с опосредованием через внутреннюю среду организма.
В развитии предболезни можно выделить некоторые общие патогенетические варианты:
1) наследственное (врожденное) состояние предболезни;
2) в ряде случаев на организм начинает действовать патогенный фактор, не способный (из-за малой интенсивности) и (или) достаточности защитных сил организма вызвать развитие болезни. Однако, при длительном воздействии он постепенно может приводить к снижению саногенетических механизмов - например, запыленность, загазованность, вибрация;
3) чаще встречается иная ситуация, когда состояние предболезни обусловлено действием одного причинного фактора (N1), вызвавшего в организме ограничение возможности компенсаторно-приспособительных реакций, и на этом фоне может действовать какой-то другой фактор (N2), который приведет к развитию определенного заболевания. Хронический стресс может привести к снижению активности или дезинтеграции системы иммунного надзора - состояние предболезни - и на этой основе возможно развитие различных заболеваний - инфекции, опухоли, аутоиммунные болезни.
Преморбидная стадия. Отличается возникновением специфических, обычно единичных, симптомов, предопределяющих общую направленность развивающейся патологии - кардиологическую, пульмонологическую, гастроэнтерологическую.
Донозологическое состояние. Проявляется усугублением расстройств поражаемого органа, что приводит к нарастанию числа специфических синдромов, сочетание которых позволяет определить возможный нозологический диагноз.
Различают следующие исходы болезни: 1) выздоровление полное и неполное; 2) переход в хроническую форму; 3) смерть.
Выздоровление — восстановление нарушенных функций больного организма, его приспособление к существованию в окружающей среде и (для человека) возвращение к трудовой деятельности. В этом смысле выздоровление называют реабилитацией. При этом имеется в виду как возвращение выздоровевшего человека к прежней трудовой деятельности, так и переквалификация его в связи с изменением состояния (новым качеством) здоровья.
При полном выздоровлении в организме не остается следов тех расстройств, которые были при болезни. При неполном выздоровлении сохраняются в разной степени выраженности нарушения функций отдельных органов и их регуляции. Одним из выражений неполного выздоровления является рецидив (возврат) болезни, а также переход ее в хроническое состояние.
Роль социальных факторов в развитии болезни.
Основные принципы патогенетической терапии травматического шока
Обезболивание
Восстановление ОЦК, рН биол жидк буф р-рами, солевыми р-рами
Противошоковая терапия
Введение глюкокортикоидов, АКТГ, кортизона
Наложить шину, обработать рану
ИВЛ при термин стадии
Действие повышенного барометрического давления. Этиология и патогенез кессонной болезни
Патогенез ожоговой болезни
Ожоговая оолезнь г—разносторонние функциональные - нарушения внутренних органов и систем целостного организма, обусловленные обширными1 (более 10—15 % поверхности тела) и глубокими ожогами. В развитии ожоговой болезни выделают четыре периода:
1) ожоговый шок (см. разд. 3.2.3);
2) общую токсемию — результат аутоинтоксикации продуктами распада тканей, образующимися на месте ожога (денатурированный белок, биологически активные амины, полипептиды и др.), и выработки специфических ожоговых аутрантител. Кроме того, в коже животных и человека обнаружен ожоговый аутоантиген, отсутствующий у здоровых и в тканях с другим характером повреждения (Н. А. Федоров, С. В. Скуро-вич);
3) септикотксемию (присоединение инфекции);
4) реконвалесценцию.
Патогенез лучевой болезни
Лучевая болезнь. При внешнем равномерном облучении организма в зависимости от дозы ионизирующей радиации возникают поражения от едва уловимых реакций со стороны отдельных систем до острых форм лучевой болезни. При облучении в дозах 1—ДХр развивается типичная форма острой лучевой болезни, при которой наиболее четко проявляются основные патогенетические закономерности клинического формирования ее отдельных периодов, имеет место преимущественное поражение костного мозга {кост-нр-мозговой синдром). В диапазоне доз ДО— 20 Гр возникает кишечная, при дозах, 20 80 Гр — токсемическая (сосудистая) и при дозах выше 80 Гр — церебральная формы лучевой болезни.
Типичную форму острой лучевой болезни по тяжести поражения, определяемой поглощенной дозой излучения, подразделяют на четыре группы: I — легкой степени (1— 2 Гр); II — средней степени (2—4 Гр); III —# тяжелой степени (4—6 Гр); IV — крайне тяжелой степени (свыше 6 Гр).
В ее течении выделяют четыре фазы: 1) первичной острой реакции; 2) мнимого клинического благополучия (скрытая фаза); 3) разгара болезни; (4) восстановления.
Фаза первичной острой реакции организма деловека-жозникаетв зависимости от. дозьг6 в первые.„минуты, или часы после облучения. В это время характерно некоторое возбуждение, головная боль, общая слабость. Затем наступают /(испеп-сичтекйё расстройства (тошнота, рвота, потеря аппетита), со стороны укроти — кратковре-менныйнейтрофильный лейкоцитоз со сдвигом цлево, абсолютная лимфопения.
Клинические проявления болезни — это не только следствие прямого повреждающего действия ионизирующей радиации радиочувствительных систем, но и свидетельство ранних нарушений. нервно-регулятор-ных и гуморальных взаимоотношений. На-блюдаются повышенная возбудимость нервной системы, связанная с ней лайилЖббть (неустойчивость) вегетативных функций — колебания артериального давления, ритма сердца и т. д. Активация гипофиз-адрена-лЪвой системы приводит к усиленной секреции гормонов коры надпочечников, что в данной ситуации может иметь приспособи-тельное значение. При дозах 8 — 10 Гр наблюдается развитие шокоподобного состояния с падением артериального давления, кратковременной потерей сознания, повышением температуры тела, развитием поноса, нервно-рефлекторными нарушениями.
Фаза мнимого клинического благополучия характеризуется включением в патолотический процесс защитных механизмов организма. В связи с этим самочувствие больных становится удовлетворительным, проходят клинически видимые признаки болезни. Длительность скрытой фазы зависитдт дозы облучения, и колеблется При сравнительно небольших дозах (до 1 Гр) начальные легкие функциональные реакции не переходят в развернутую клиническую картину и заболевание ограничивается затухающими явлениями начальных реакций. При очень тяжелых формах поражения (дозы более 10 Гр) скрытая фаза вообще отсутствует. Однако в это время нарастает поражение системы крови: в перифрической крови йрогрёссйруётл1Шфсйёния: на фоне лейкопении, снижается содержание ретйкулоцитов и тромбоцитов. В костном мозге' развивается опустошение (аплазия). Могут наблюдаться атрофия гонад, подавление ранних стадий сперматогенеза, развитие изменений в тонком к1шечнике _и
Фаза разгара болезни характеризуется тем, что самочувствие больных вновьрезко ухудшается, нарастает сла--1?8сть7 повышается температура тела, появ-ляются ровоточршость исррвоизлияния в кожу, слизистые оболочки, желудочно-кишечный тракт, мозг, сердце и легкие. В результате нарушения обмена веществ и диспепсических расстройств (потеря аппетита и поносы) резко снижается--масса тела. На первый план выходит поражение системы крови. Развиваются глубокая лёйко-пения, тромбЪцитопения,' выраженная анемия; увеличивается скорость Г оседания эритроцитов (СОШ1_ в крстном__мозге — картина опустошения с начальными признаками регенерации. Наблюдаются гипопротеинемия, гипоальбуминемия, повышение содержания остаточного азота и снижение уровня хлоридов. Угнетается иммунитет, в результате чего развиваются инфекционные -осложнения, аутоинфекция и аутоинтоксикация. Продолжительность фазы выраженных клинических проявлений от несколмшх-Ддей до 2—3 нед. При облучении в дозе свыше 2ДГТр~бёз проведения лечебных мероприятий возможен смертельный исход.
Фаза восстановления характеризуется постепенной нормализацией нарушенных функций, общее состояние больных заметно улучшается. Снижается до нормы температура тела, исчезают геморрагические и диспепсические проявления, со 2—5-го мес нормализуется функция потовых и сальных желез, возобновляется рост волос. Происходит постепенно восстановление показате-/ лей крови и обмена веществ. Период восстановления рхватывает_3— 6 „мес, в тяжелых случаях лучевого поражения может затягиваться на 1—3 года, при этом возможен переход болезни в хроническую форму. С Кишечная форма острой лучевой болезни гвозникает при облучении лабораторных жи-вотных в дозах 10—20 Гр, вызывающих 41 т яерть на 3—5-е сут после облучения. При!%*вскрытии животных всегда констатируют гибель основной массы кишечного эпителия, оголение ворсин, их уплощение и деструк-,цию. У человека при облучении в дозах 10— 20 Гр смерть чаще наступает на 7—10-е сут. Основными признаками болезни являются тошнота, рвота, кровавый понос/повы-, шение температуры тела, могут наблюдаться полная паралитическая непроходимость кишечника и вздутие живота. Развиваются геморрагия и глубокая, лейкопения с полным отсутствием лимфоцитов в периферической крови, а также картина, сепсиса. Причиной смерти при кишечной форме острой лучевой болезни являютбя дегидратация органйзмаопровождаюаяся поте-рей'~злеТ4тролйт6в_1 белка, развитие необратимого шока, связанного с действием токсических веществ микробного и тканевого происхождения.
Токсемическая форма характеризуется выраженными гемодинамическими нарушениями главным образом в кишечнике и печени, парезом сосудов, тахикардией, кровоизлияниями, тяжелой интоксикацией и меннгьнь1ми_симптомами (отек мозга). Наблюдается олигурия и гипёразотемйя вследствие поражения почек. Смерть наступает, на 4—-7-е сут.
Церебральная форма острой лучевой болезни возникает при облучении в дозах выше 80 Гр. Смерть при этом наступает через 1—3 дня после облучения, а при действии очень больших доз (150—200 Гр) смертельный исход может иметь место даже в ходе самого облучения (смерть под лучом) или через несколько минут — часов после воздействия а также при локальном облучении головы в дозах 100—300 Гр. Эта. форма лучевого поражения характеризуется развитием судорожно-паралитического синдрома, нарушением крово- и лЙмфбОраиёния в центральной нервной системе, сосудистого* тонуса и терморегуляции. НесколькЬ позднее появляются функциональные нарушения пищеварительной и мочевыделительнои систем, происходит, прогрессивное снижение кровяного давления. Причиной смерти при церебральной форме острой лучевой болезни являются тяжелые и необратимые нарушения централь ной нервной системы, характеризующиеся*' значительными структурными изменениями, гибелью клеток коры головного мозгаииней-ронов™ Ддёр гипоталамуса. В поражении нервной системы главную роль играют непосредственное повреждающее действиеио-йизйр'уюЩей Ъадиаций на ткань, а также первичные радиотоксины в виде Нгдру-гих веществ,*'о§разующ1хся за счет деисле ния ненасыщенных жирных кислот и фенолов. Единичные наблюдения последствии облучения людей в дозах, превышающих 100 Гр, свидетельствуют о вознйкноведищмних расстройств регуляции высшей нервной деятельности кровообращения * к Дыхания коже. Неврологическая симптоматика постепенно сглаживается. Хроническая лучевая болезнь розникает при длительном облучении организма в малых, но превышающих допустимые дозах. Выделяют два основных варианта болезни: обусловленной внешним общим или местным облучением, а также в результате поступления в организм равномерно и неравномерно распределяющихся радиоактивных нуклидов.
Заболевание отличается постепенным развитием и длительным волнообразным течением, сроки возникновения и характер изменений при этом определяются интенсивностью и суммарной дозой облучения. Начальный период заболевания характеризуется 'развитием нестойкой лейкопении, признаками астениз'ации, вегетативно-сосудистой неустойчивостью и др. Развернутому периоду заболевания свойственна недостаточность физиологической регенерации наиболее радиочувствительных тканей в срчетании с функциональными изменениями в деятельности нервной и сердечно-сосудистой систем. Период восстановления характеризуется сглаживанием деструктивных и отчетливым преобладанием репаративных процессов в наиболее радиопоражаемых тканях. По тяжести хроническую лучевую болезнь, обусловленную общим облучением, подразделяют на три группы: легкой (I), средней (II) и тяжелой (III) степени.
Хроническая лучевая болезнь I степени (легкая) характеризуется нерезко выраженными нервно-регуляторными нарушениями в деятельности различных органов и систем, умеренной нестойкой лейкопенией и тромбо-цитопенией. При хронической лучевой болезни II степени (средней) тяжести присоединяются функциональные нарушения нервной, сердечно-сосудистой и пищеварительной систем. Прогрессируют лейкопения и лимфопения, количество тромбоцитов уменьшено; в костном мозге — явления гипо-плазии кроветворения.
При хронической лучевой болезни III степени (тяжелой) развиваются анемия, явления выраженной гипоплазии кроветворения, атрофические процессы в слизистой желудочно-кишечного тракта, присоединяются инфекционно-септические осложнения, геморрагический синдром и нарушения кровообращения. Крайне тяжелые формы встречаются редко, при этом у больных развиваются поносы и кахексия.
Клиническую картину хронической лучевой болезнй, обусловленной внутренним облучением, формирует поражение одного или нескольких критических органов, в которых депонируются поступившие в организм радиоактивные нуклиды.
Отдаленные последствия действия радиации могут развиться как после общего, так и местного облучения организма спустя ряд лет и носят неопухолевый или опухолевый характер.
К неопухолевым формам в первую очередь относят сокращение продолжительности жизни, гипопластические состояния в кроветворной ткани, слизистых оболочках органов пищеварения, дыхательных путей, в ко-, же и других органах; Склеротические процессы (цирроз печени, нефросклероз, атеро-.склероз, лучевые катаракты и др.), а также дисгормональные состояния (ожирение, гипо-1 физарная кахексия, несахарное мочеизнурение).
Одной из частых форм отдаленных последствий-лучевых поражений является развитие опухолей в критических органах при облучении инкорпорированными излучателями (а- и р-излучение), а также радиационные лейкозы.
Нарушения при гипоксии.
Изменения обмена веществ раньше всего возникает со стороны углеводного и энергетического обмена. Во всех случаях гипоксии первичным сдвигом является дефицит макроэргов. Усиливается гликолиз, это приводит к падению содержания гликогена, нарастанию пирувата и лактата. Избыток молочной, пировиноградной и других органических кислот способствует развитию метаболического ацидоза. Возникает отрицательный азотистый баланс. В результате расстройств липидного обмена развивается гиперкетонемия.
Нарушается обмен электролитов и в первую очередь процессы активного перемещения и распределения ионов на биологических мембранах, возрастает количество внеклеточного калия.
Последовательность изменений в клетке: повышение проницаемости клеточной мембраны > нарушение ионного равновесия > набухание митохондрий > стимуляция гликолиза > уменьшение гликогена > подавление синтеза и усиление распада белков > деструкция митохондрий > эргастоплазмы, внутриклеточного сетчатого аппарата > жировая декомпозиция клетки разрушение мембран лизосом > выход гидролитических ферментов - аутолиз и полный распад клетки.
Основные теории старения
Представляют интерес теории, которые ведущее место в возникновении старости приписывают различным интоксикациям. Большой известностью пользуется теория И. И. Мечникова, который полагал, что люди стареют преждевременно в результате хронического отравления организма образующимися в кишечнике продуктами гнилостного распада в связи с деятельностью патогенной микрофлоры кишечника. В соответствии с этим замена кишечной микрофлоры бактериями брожения при использовании в пищу простокваши должна предупреждать старение.
Огромное значение в борьбе за долголетие И. И. Мечников придавал гигиене, выдвигая принцип «ортобиоза», правильного образа жизни, основанного на трудолюбии и умеренности. Он полагал, что старческая атрофия есть результат дисгармоничного ослабления жизнестойкости отдельных элементов живого организма, а именно в старости «благородные элементы» (нервная и железистая ткани) ослабевают в неизмеримо большей степени, чем соединительно-тканные структуры. Последние фагоцитируют ослабевшие в результате интоксикации элементы, происходит склерозирование сосудов и внутренних органов. Таким образом, И. И. Мечникову принадлежит идея'о сложных, противоречивых взаимоотношениях тканей в организме в процессе старения.
В отличие от И. И. Мечникова А. А. Бо-гомолец считал, что старение начинается" с соединительной ткани. Нарушение трофической функции соединительной ткани приводит к появлению признаков старости. А. А. Богомолец полагал, что старение связано с необратимыми изменениями тканевых коллоидов и изменениями лабильности белковых молекул, что приводит к ослаблению реактивности клеток физиологической системы соединительной ткани. В__ц_елях профилактики преждевременной старости он рекомендовал переливание крови и применение антиретикулярной • цитотоксической сыворотки (АЦС), изменяющей состояние коллоидов организма. Многие исследователи объясняли возникновение старческой дряхлости эндокринной недостаточностью организма, связанной как с недостаточной, так и с избыточной функцией половых желез. Получили также распространение представления о старости как о полигландулярном синдроме с преимущественным нарушением функций щитовидной, половых желез, гипофиза и надпочечников.
В настоящее время установлено, что. в старости изменяется эндокринная ситуация организма в целом. В этот период возникает значительная дисгармония в ранее хорошо сбалансированной работе желез внутренней секреции. Дисгармония в функционировании системы эндокринных желез характеризуется резким снижением инкреции одних из них (тимуса, половых желез), сохранением на достаточном уровне, хотя несколько сниженном, активности других (большинства) и даже повышением инкреции третьих (прежде всего гонадотропных гормонов гипофиза).
Некоторые авторы связывают внутренние причины старения с нарушением и прстоянства внутренней среды, вызванными изменением функций центрального ре'гулятора гомеостаза —'гипоталамуса (повышением ги-поталамического порога к регулирующим воздействиям).
Существует гипотеза, согласно которой основной причиной старения следует считать некомпенсируемую гибель клеток по причине ухудшения питания в процессе роста клеток вдали от сосудистого русла или вследствие нарушения регуляции их роста. Утверждается, что в стареющем организме наблюдается системное, происходящее во многих тканях уменьшение количества функционирующих клеток. В первую очередь это касается нервной системы (в особенности гипоталамуса), иммунной системы и желез внутренней секреции.
В последнее время внимание ученых приковывает проблема молекулярных механизмов старения организма. Исследуются причины и механизмы возрастных изменений биосинтеза белка. А. В. Нагорным и его учениками выдвинута «теория затухающего самообновления протоплазмы» в онтогенезе. Эта теория объясняет старение организма неравномерностью непрерывного самообновления протоплазмы клеток в различных тканях и системах, угасанием биосинтеза ферментов и структурных белков, накоплением «ошибок» биосинтеза белков.
Одной из современных гипотез, претендующих на объяснение механизма старения, является свободнорадикальная теория, связывающая причины возрастания изменений с накоплением молекулярных повреждений свободными радикалами и продуктами пере-кисного окисления лигоадов. С этих позиций в процессе старения ведущая роль приписывается активным формам кислорода и подчеркивается защитное значение энзима суперокеиддисмутазы и других антиокислительных ферментов.
Особое значение в определении продолжительности жизни человека имеют генетические факторы. Есть основания считать, что первичная программа продолжительности жизни и долголетия записана в ге-номе. «Печатью возраста» на геноме клетки называют запрограммированные изменения макромолекулярного состава хроматина и тончайшей структуры синтезирующего нуклеиновые кислоты и белки аппарата клетки.
Согласно развиваемой в настоящее время генетической теории старения пусковым механизмом старения клетки является химическая модификация ДНК в результате действия на нее внутриклеточных метаболитов и ДНК-азы. В последующем в месте повреждения образуется ковалентная связь («сшивка») ДНК с белком, РНК и, возможно, другими локализованными вблизи поврежденных генов молекулами. В результате необратимо нарушается способность оп ределенных участков ДНК к осуществлению основных функций, происходит «спонтанная инактивация генов». Таким образом, генотип определяет продолжительность жизни при помощи контроля за степенью устойчивости клеточных структур к повреждающему действию факторов внешней среды, а также путем активной регуляции биохимических процессов, приводящих клетки к поврежде- нию и гибели.
При старении повреждаются все основные молекулярн.о-генетические структуры и процессы. По современным представлениям молекулярно-генетические нарушения выступают как основная причина возрастных изменений клетки и старения организма. Несмотря на то, что старение неизбежно, задача медицины заключается в том, чтобы замедлить темпы развития, увеличить период активной жизни человека.
II. ТИПИЧЕСКИЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ:
Причины стаза
• Ишемия и венозная гиперемия. Они приводят к стазу вследствие существенного замедления кровотока (при ишемии в связи со снижением притока артериальной крови, при венозной гиперемии в результате замедления или прекращения её оттока) и создания условий для образования и/или активации веществ, обусловливающих склеивание форменных элементов крови, формирования из них агрегатов и тромбов.
• Проагреганты — факторы, вызывающие агрегацию и агглютинацию форменных элементов крови.
Патогенез стаза
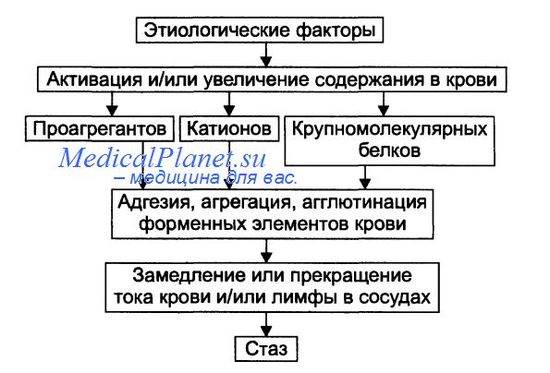
На финальном этапе стаза всегда происходит процесс агрегации и/или агглютинации форменных элементов крови, что приводит к сгущению крови и снижению её текучести. Этот процесс активируют проагреганты, катионы и высокомолекулярные белки.
Все разновидности стаза подразделяют на первичные и вторичные.
• Первичный (истинный) стаз. Формирование стаза первично начинается с активации форменных элементов крови и выделения ими большого количества проагрегантов и/или прокоагулянтов. На следующем этапе форменные элементы агрегируют, агглютинируют и прикрепляются к стенке микрососуда. Это и вызывает замедление или остановку кровотока в сосудах.
• Вторичный стаз (ишемический и застойный).
+ Ишемический стаз развивается как исход тяжёлой ишемии в связи со снижением притока артериальной крови, замедлением скорости её тока, турбулентным его характером. Это и приводит к агрегации и адгезии клеток крови.
+ Застойный (венозно-застойный) вариант стаза является результатом замедления оттока венозной крови, сгущения её, изменения физико-химических свойств, повреждения форменных элементов крови (в частности, в связи с гипоксией). В последующем клетки крови адгезируют друг с другом и со стенкой микрососудов.
Проявления стаза
При стазе происходят характерные изменения в сосудах микроциркуляторного русла:
• уменьшение внутреннего диаметра микрососудов при ишемическом стазе,
• увеличение просвета сосудов микроциркуляторного русла при застойном варианте стаза,
• большое количество агрегатов форменных элементов крови в просвете сосудов и на их стенках,
• микрокровоизлияния (чаще при застойном стазе).
В то же время проявления ишемии или венозной гиперемии могут перекрывать проявления стаза.
Последствия стаза
При быстром устранении причины стаза ток крови в сосудах микроциркуляторного русла восстанавливается и в тканях не развивается каких-либо существенных изменений.
Длительный стаз приводит к развитию дистрофических изменений в тканях, нередко — к гибели участка ткани или органа (инфаркт).
Медиаторы воспаления
Клеточные:
Гистамин (из гранул тучных клеток) – местное расширение сосудов, повышение их проницаемости, особенно венул.
Серотонин (из тромбоцитов, хромаффинных клеток слизистой оболочки пищеварительного канала) – спазм посткапиллярных венул, повышение проницаемости стенки сосудов.
Лизосомальные ферменты (гранулоциты, тканевые базофилы, макрофаги) – вторичная альтерация, хемотаксис.
Катионные белки (нейтрофильные гранулоциты) – повышение проницаемости стенки сосудов.
Простогландины (арахидоновая кислота) – проницаемость сосудов, отек, хемотаксис.
Тромбоксан (тромбоциты) – агрегация тромбоцитов, вазоконстрикция, свертывание крови.
Простациклин (эндотелиоциты) – дезагрегация тромбоцитов, расширание сосудов.
Лейкотриены (лейкоциты) – хмеотаксис, сокращение гладких мышц, отек.
Гуморальные медиаторы:
Кинины (альфа-глобулины крови) – расширение капилляров, увеличение проницаемости, боль, зуд.
Система комплемента (плазма крови) – хемотаксис, цитолиз.
12. Модуляторы воспаления. Механизмы их образования и действия.
Модуляторы воспаления = медиаторы воспаления.
Все медиаторы воспаления или их неактивные предшественники образуются в различных клетках организма. Тем не менее их подразделяют на клеточные и плазменные.
Клеточные медиаторы высвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в которых они синтезировались и накопились.
Плазменные медиаторы образуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но не в активном состоянии, а в виде предшественников. Эти вещества активируются под действием различных промоторов преимущественно в плазме крови. Они становятся физиологически дееспособными и поступают в ткани.
Медиаторы воспаления
Клеточные:
Гистамин (из гранул тучных клеток) – местное расширение сосудов, повышение их проницаемости, особенно венул.
Серотонин (из тромбоцитов, хромаффинных клеток слизистой оболочки пищеварительного канала) – спазм посткапиллярных венул, повышение проницаемости стенки сосудов.
Лизосомальные ферменты (гранулоциты, тканевые базофилы, макрофаги) – вторичная альтерация, хемотаксис.
Катионные белки (нейтрофильные гранулоциты) – повышение проницаемости стенки сосудов.
Простогландины (арахидоновая кислота) – проницаемость сосудов, отек, хемотаксис.
Тромбоксан (тромбоциты) – агрегация тромбоцитов, вазоконстрикция, свертывание крови.
Простациклин (эндотелиоциты) – дезагрегация тромбоцитов, расширание сосудов.
Лейкотриены (лейкоциты) – хмеотаксис, сокращение гладких мышц, отек.
Гуморальные медиаторы:
Кинины (альфа-глобулины крови) – расширение капилляров, увеличение проницаемости, боль, зуд.
Система комплемента (плазма крови) – хемотаксис, цитолиз.
С-реактивный белок - Белок острой фазы, чувствительный индикатор повреждения тканей при воспалении, некрозе, травме.
Получил свое название из-за способности вступать в реакцию преципитации с С-полисахаридом пневмококков (важный механизм ранней защиты организма от инфекции). С-реактивный белок стимулирует иммунные реакции, в том числе фагоцитоз, участвует во взаимодействии Т- и В-лимфоцитов, активирует систему комплемента по классическому типу. Синтезируется преимущественно в гепатоцитах.
Уровень С-реактивного белка быстро и многократно (в сотни раз) увеличивается при воспалениях различной природы и локализации, паразитарных инфекциях, травмах и опухолях, сопровождающихся воспалением и некрозом тканей. Концентрация остальных острофазных белков редко увеличивается более чем в 3-5 раз от значений нормы. Синтез С-реактивного белка растет уже через 4-6 часов после начала воспалительного процесса (до увеличения количества гранулоцитов), достигает пика через 1-2 дня, при успешном выздоровлении его уровень быстро снижается, поскольку полупериод циркуляции в крови С-реактивного белка составляет 6 часов. По диагностической значимости сопоставим с СОЭ, но уровень С-реактивного белка растет и снижается быстрее. Концентрация С-реактивного белка в крови имеет высокую корреляцию с активностью заболевания, стадией процесса. С переходом заболевания в хроническую стадию уровень С-реактивного белка снижается до полного его исчезновения и вновь возрастает при обострении процесса. После неосложненного оперативного вмешательства величина этого показателя возрастает, но в послеоперационном периоде он быстро нормализуется. При любых заболеваниях или после операции присоединение бактериальной инфекции, будь то местный процесс или сепсис, сопровождается повышением уровня С-реактивного белка. Уровень С-реактивного белка при вирусной и спирохетной инфекции возрастает незначительно, поэтому его высокие значения в сыворотке крови при отсутствии травмы обычно указывают на наличие бактериальной инфекции. На уровень С-реактивного белка не оказывают особого влияния изменения гормонального статуса, в том числе и во время беременности. Определение С-реактивного белка ценно в диагностике сепсиса у новорожденных.
Относительно новая область применения этого показателя - оценка риска развития атеросклероза и связанных с ним осложнений. Разработанные в последнее время высокочувствительные методы определения С-реактивного белка (чувствительность <0.5 мг/л), используемые в данное время в практике нашей лаборатории, могут улавливать изменение С-реактивного белка не только в условиях острого, но также и хронического, низкой степени выраженности, эндогенного воспаления. Показано, что повышение С-реактивного белка в интервале концентраций <10 мг/л и пограничных с верхней границей нормы значений свидетельствует о повышенном риске развития атеросклероза и может быть показателем дестабилизации атеросклеротической бляшки, а также показателем риска первого инфаркта, тромбоэмболии. Вероятность сердечно-сосудистых осложнений у таких пациентов возрастает при наличии параллельно других факторов риска (повышенный уровень холестерина, фибриногена, гомоцистеина и др.).
Стадии развития фагоцитоза
Важнейшей функцией лейкоцитов в очаге воспаления является фагоцитоз - т.е. захват, убиение и переваривание бактерий, а так же переваривание продуктов распада тканей и клеток собственного организма.
В ходе фагоцитоза различают 4 стадии:
1) стадия приближения фагоцита к объекту;
2) стадия прилипания фагоцита к объекту;
3) стадия поглощения фагоцитом объекта;
4) стадия внутриклеточных превращений поглощенного объекта.
Первая стадия объясняется способностью фагоцитов к хемотаксису.
В механизмах прилипания и последующего поглощения фагоцитом объекта большую роль играют опсонины - антитела и фрагменты комплемента, плазменные белки и лизоцим. Установлено, что определенные участки молекул опсонинов связываются с поверхностью атакуемой клетки, а другие участки той же молекулы - с мембраной фагоцита.
Механизм поглощения не отличается от прилипания - захват осуществляется путем постепенного обволакивания фагоцитом микробной клетки, т.е. по-существу путем прогрессирующего прилипания поверхности фагоцита к поверхности микроба до тех пор, пока весь объект не будет "обклеен" мембраной фагоцита. В следствие этого поглощаемый объект оказывается внутри фагоцита, заключенным в мешок, образованный частью мембраны фагоцитирующей клетки. Этот мешок называется фагосома. Образование фагосомы начинает стадию внутриклеточных превращений поглощенного объекта внутри фагосомы, т.е. вне внутренней среды фагоцита.
Основная часть внутриклеточных превращений поглощенного при фагоцитозе объекта связана с дегрануляцией - т.е.переходом содержимого цитоплазматических гранул фагоцитов внутрь фагосомы. В этих гранулах у всех облигатных фагоцитов содержится большое количество биологически активных веществ преимущественно ферментов, которые убивают и затем переваривают микробы и другие поглощенные объекты. В нейтрофилах имеется 2-3 вида гранул, которые содержат лизоцим - растворяющий микробную стенку, лактоферрин - белок, связывающий железо и тем самым оказывающий бактериостатические действие, миелопероксидазу, нейтральные протеазы, кислые гидролазы, белок, связывающий витамин В12 и другие. Как только образуется фагосома, к ней вплотную подходят гранулы. Мембраны гранул сливаются с мембраной фагосомы и содержимое гранул поступает внутрь фагосомы.
Как уже говорили, нейтрофилы - первые лейкоциты, инфильтрирующие зону воспаления. Они обеспечивают эффективную защиту от бактериальных и грибковых инфекций. Если же рана не инфицирована, то содержание нейтрофилов в ней быстро снижается и через 2 суток в очаге воспаления преобладают макрофаги. Как и нейтрофилы, воспалительные макрофаги - это подвижные клетки, защищающие организм с помощью фагоцитоза от различных инфекционных агентов. Они также способны секретировать лизосомальные ферменты и кислородные радикалы, но отличаются от нейтрофилов рядом качеств, которые делают эти клетки особенно важными на более поздних этапах острого воспаления и в механизмах заживления ран:
1. Макрофаги живут гораздо дольше (месяцы, а нейтрофилы - неделю).
2. Макрофаги способны распознавать, а затем поглощать и разрушать поврежденные и нежизнеспо








