

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
Топ:
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
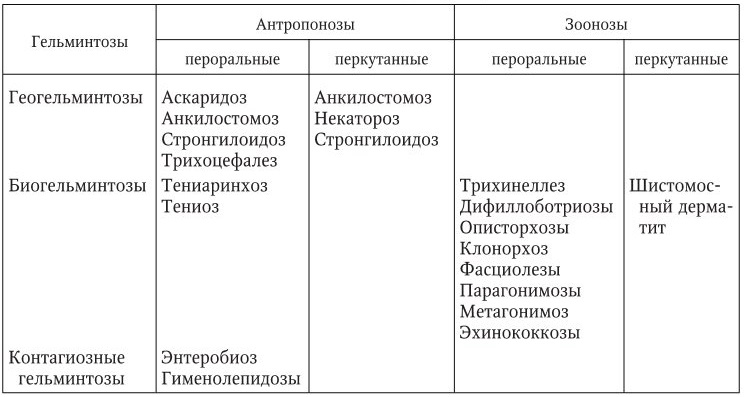
В развитии инвазионного процесса различают ряд последовательных фаз, характеризующихся определенной симптоматикой.
Острая или ранняя фаза инвазии обусловлена внедрением возбудителя и паразитированием личинок, вызывающих аллергическую реакцию немедленного и замедленного типов на антигены личиночных стадий. Симптомы аллергоза наиболее демонстративны при заражении трематодами и нематодами, личинки которых часто совершают сложную миграцию по различным отделам человеческого организма (кровь, печень, легкие, серозные оболочки и др.). Продолжительность этой фазы инвазии составляет 2 – 4 нед. Сходная, но более тяжелая клиническая картина может наблюдаться в случаях заражения человека мигрирующими личинками зоонозных гельминтов, не достигающими половой зрелости в человеческом организме (симптомокомплекс larva migrans).
Латентная фаза развивается вслед за острой и определяется постепенным созреванием молодого гельминта, локализовавшегося в тропном для него органе. Хроническая фаза инвазии определяется паразитированием зрелого гельминта с образованием пропагативных стадий (яиц, личинок). При этом вначале в связи с высокой репродуктивной способностью червей наблюдаются наиболее выраженные патологические проявления, постепенно стихающие по мере снижения активности гельминта в позднем периоде этой фазы инвазии. Гельминты оказывают на организм хозяина токсическое, аллергенное, иммуносупрессивное, конкурентное трофическое воздействие и нередко вызывают механическое повреждение различных тканей и органов.
Клинические проявления хронической фазы инвазии в значительной мере определяются видом паразита и его тропностью к различным системам организма, характером возникающих осложнений, а также интенсивностью инвазии (числом паразитирующих гельминтов). Продолжительность хронической фазы гельминтозов связана с длительностью жизни червей и колеблется от нескольких недель до многих лет.
|
|
Исходами инвазии после изгнания или гибели паразита могут быть как полное выздоровление, так и разнообразные резидуальные проявления, иногда инвалидизирующие пораженного человека.
Диагноз инвазии гельминтами основывается на анализе комплекса эпидемиологических и клинико‑лабораторных данных и требует подтверждения методами специфической диагностики – паразитологическим, серологическим и иммунологическим.
Паразитологические методы исследования предполагают обнаружение гельминтов, их личинок или яиц в тканях, экскретах или секретах организма. В острой фазе инвазии, в случаях низкой интенсивности инвазии, а также для обнаружения гельминтов, пропагативные стадии которых не выделяются во внешнюю среду, применяют серологические тесты (РСК, ИФА, РПГА и др.) или иммунологические методы (кожные аллергические пробы и др.), разработанные для ряда инвазий (эхинококкозы, цистицеркоз, трихинеллез и др.).
Борьба с гельминтозами достигается осуществлением комплекса мероприятий – дегельминтизации (лечение инвазированных), девастации (уничтожение различных стадий паразитов во внешней среде), санитарно‑ветеринарными, санитарно‑просветительными и др.
Кишечные гельминтозы
Из группы кишечных гельминтозов наибольшее значение для нашей страны имеют аскаридоз, анкилостомидозы, стронгилоидоз, трихинеллез, трихоцефалез, энтеробиоз, тениаринхоз, тениоз, гименолепидозы, дифиллоботриозы, метагонимоз.
Аскаридоз
Этиология. Возбудитель – Ascaris lumbricoides – крупная нематода (длина самок 20 – 40 см, самцов – 15 – 25 см) с заостренным на концах телом, покрытым плотной кутикулой. Хвостовой конец тела самца загнут в брюшную сторону. Яйца аскарид размером (0,05 – 0,07) % (0,04 – 0,05) мм покрыты плотной шероховатой оболочкой.
|
|
Эпидемиология. Аскаридоз – пероральный геогельминтоз, антропоноз. Окончательный хозяин и единственный источник инвазии – человек, в тонкой кишке которого паразитируют половозрелые аскариды. Откладываемые самкой яйца выделяются с фекалиями и созревают до инвазионной стадии в почве при высоком содержании кислорода, влажности не менее 8 % в течение 12 – 16 сут. Оптимальной температурой для развития яиц в почве является 24 °C.
Заражение человека происходит в теплое время года с пищевыми продуктами и водой, содержащими инвазионные яйца аскарид. Восприимчивость к инвазии всеобщая, дети поражаются чаще, чем взрослые. В результате повторных заражений формируется относительный иммунитет. Аскаридоз распространен в мире исключительно широко.
Патогенез и патологоанатомическая картина. В ранней фазе инвазии вышедшие из яиц личинки аскарид проникают через стенку тонкой кишки в бассейн воротной вены и гематогенно мигрируют в печень (к 5 – 6‑му дню инвазии), затем в легкие (к 8 – 10‑му дню), совершая в них две линьки. Из альвеол они проникают в ротоглотку и после заглатывания со слюной к 14 – 15‑му дню достигают тонкой кишки, где после двух линек становятся половозрелыми. Общая продолжительность периода от инвазирования до первой кладки яиц составляет 10 – 12 нед. Продолжительность жизни аскариды – около года.
В ранней, миграционной фазе аскаридоза развиваются интоксикация и сенсибилизация организма человека продуктами обмена личинок, наиболее выраженные в периоды линек, когда осуществляется тесный контакт гельминта с тканями человека. В меньшей степени эти факторы выражены в хронической фазе инвазии, усиливаясь в случае резорбции продуктов распада погибших паразитов. Большое место в патогенезе занимают механические травмы кишечной стенки, сосудов печени, легких мигрирующими личинками. Зрелые гельминты также могут повреждать стенку кишки (вплоть до перфорации) и мигрировать в организме человека, что приводит к крайне неблагоприятным последствиям.
При условии массивной инвазии развивается витаминная и алиментарная недостаточность.
Инвазия аскаридами способствует нарушению кишечного эубиоза, вследствие иммуносупрессивного эффекта оказывает неблагоприятное воздействие на течение дизентерии, брюшного тифа, сальмонеллеза, вирусного гепатита, туберкулеза и других болезней.
|
|
Клиническая картина. Проявления аскаридоза в ранней фазе болезни отличаются полиморфизмом, варьируют от латентных, стертых до тяжелых клинических форм. При манифестных формах признаки заболевания появляются в первые дни инвазии: недомогание, снижение активности и работоспособности, слабость, раздражительность, потливость, головная боль, повышение температуры (от субфебрильной до 38 – 40 °C). Нередко наблюдаются артралгии, миалгии, кожный зуд и уртикарная экзантема.
У некоторых больных в период миграции личинок в печень возникают боли в правом подреберье, чувство дискомфорта в животе, гепатомегалия, сопровождающиеся нерезкими нарушениями функциональных проб печени.
Для клинической картины ранней фазы инвазии особенно характерно поражение легких (синдром Леффлера). Появляется кашель, чаще сухой, иногда со скудной мокротой и примесью крови, он может иметь астматическую окраску. Выявляются одышка и боли в груди, особенно сильные при возникновении плеврита, выслушивается большое количество разнообразных хрипов, однако притупление перкуторного звука выявляется сравнительно редко. При повторной рентгеноскопии легких обнаруживаются множественные «летучие инфильтраты» Леффлера, которые быстро меняют конфигурацию и, исчезая в одном месте, появляются в другом.
Нередко выявляются симптомы повреждения сердечно‑сосудистой системы (тахикардия, снижение артериального давления и др.). Гемограмма характеризуется выраженной эозинофилией (до 4 – 60 %, иногда выше) при нормальном количестве лейкоцитов или небольшом лейкоцитозе. Иногда можно наблюдать гиперлейкоцитоз и лейкемоидные реакции эозинофильного типа, СОЭ обычно нормальная, иногда повышена до 20 – 40 мм/ч.
Хроническая фаза аскаридоза (кишечная) может протекать бессимптомно, но обычно наблюдаются умеренно выраженные симптомы нарушения функции желудочно‑кишечного тракта. Тяжелые формы инвазии развиваются весьма редко. У больных снижается аппетит, они худеют, жалуются на боли в животе, часто схваткообразные и довольно сильные, тошноту, рвоту, иногда появляется диарея или запор и их чередование. Дети становятся капризными, плохо спят, быстро утомляются, задерживается их психомоторное развитие и снижается интеллект. У взрослых снижается работоспособность.
|
|
В гемограмме в этой фазе аскаридоза изменений, как правило, нет, иногда обнаруживается небольшая эозинофилия.
Осложнения. Большая часть осложнений аскаридоза связана с повышением двигательной активности зрелых аскарид. Особенно часто они попадают в червеобразный отросток, вызывая острый аппендицит. Заползание гельминтов в желчные протоки может вызвать желчную колику и обтурационную желтуху, гнойный холецистит, восходящий холангиогепатит, абсцесс печени, перитонит. Проникновение аскарид в протоки поджелудочной железы вызывает тяжелый панкреатит. Возможны непроходимость кишечника, перфорация его стенок, заползание аскарид по пищеводу в глотку, а затем в дыхательные пути с развитием асфиксии. Описаны единичные случаи обнаружения аскарид в правом желудочке сердца, легочной артерии, околоносовых пазухах.
Прогноз. В подавляющем большинстве случаев благоприятный, при развитии осложнений существенно ухудшается.
Диагностика. В ранней фазе опорными моментами диагностики являются симптомы поражения легких в сочетании с высокой эозинофилией крови. Изредка в мокроте таких больных можно обнаружить личинки аскарид. Предложены сероиммунологические реакции с антигенами, приготовленными из личинок. В хронической фазе инвазии решающим в диагностике является обнаружение в кале яиц аскарид с применением методов обогащения. Диагностика облегчается при отхождении гельминтов с экскрементами. Иногда поставить диагноз помогает рентгеноскопия кишечника. Предложены методы определения в моче летучих жирных кислот, которые выделяют аскариды в процессе жизнедеятельности. Лечение. Для лечения аскаридоза используют албендазол (немозол) взрослым и детям старше 2 лет 400 мг однократно, мебендазол (вермокс, антиокс) – взрослым и детям старше 2 лет 100 мг два раза в сутки в течение 3 дней (600 мг на курс), карбендацим (медамин) взрослым и детям из расчета 10 мг/кг/сут в три приема в течение 3 дней, минтезол (син. тиабендазол), назначаемый в суточной дозе 50 мг/кг в 2 – 3 приема на протяжении 5 – 7 дней.
В хронической фазе можно использовать левамизол (декарис) в разовой (и курсовой) дозе 150 мг взрослым и 2,5 – 5,0 мг/кг детям. Препарат назначается после ужина, перед сном, без предварительной подготовки. Пирантел (комбантрин), назначаемый во время еды, однократно в дозе 10 мг/кг, обеспечивает эффективность более 90 %. В случае полиинвазии, включающей аскаридоз, показан антигельминтик широкого спектра действия – мебендазол (вермокс). Также известен способ дегельминтизации с помощью кислорода, который вводят через зонд.
|
|
Ранее в лечении аскаридоза использовали пиперазин и его соли (адипинат, сульфат, гексагидрат, цитрат, фосфат). Препарат эффективен против половозрелых и неполовозрелых (юных) гельминтов. Назначается взрослым до 1 г 3 – 4 раза в день, детям по 80 мг/кг/сут в течение двух дней.
Контроль эффективности лечения проводят через 2 нед. после окончания курса терапии. Для этого исследуют кал трижды с интервалом в 2 нед.
Профилактика. Складывается из комплекса мероприятий санитарного и лечебного порядка. Используют мероприятия по охране окружающей среды от фекального загрязнения, тщательное мытье овощей и фруктов в проточной воде, соблюдение мер личной гигиены.
Анкилостомидозы
Название «анкилостомидозы» объединяет 2 вида инвазии – анкилостомоз и некатороз.
Этиология. Возбудители – нематоды семейства Ancylostomatidae: Ancylostoma duodenale (кривоголовка) и Necator americanus (некатор), имеющие сходное строение. Размер самки A. duodenale – (10 – 13) % (0,4 – 0,6) мм, самца – (8 – 11) % (0,4 – 0,5) мм, размеры самки N. americanus – (7,7 – 13,5) % (0,38 – 0,45) мм, самца – (5,2 – 10) % (0,18 – 0,24) мм. Яйца обоих видов овальные, с тонкой прозрачной оболочкой, трудноразличимы.
Эпидемиология. Анкилостомидозы – антропонозы, геогельминтозы. Источник инвазии зараженный человек, в проксимальных отделах тонкой кишки которого паразитируют взрослые гельминты, откладывающие яйца. Последние с фекалиями попадают в почву, где при температуре выше 14 – 16 °C (оптимум 27 °C и более), достаточной влажности и хорошей аэрации через 2 – 3 дня в них созревают, и затем вылупляются личинки, достигающие через 7 – 15 дней инвазионной стадии. Инвазионная личинка способна сохранять жизнеспособность в почве 7 – 15 нед. Заражение происходит перкутанно, через неповрежденную кожу при контакте ее с почвой и растениями (преимущественно при некаторозе), и перорально, при употреблении загрязненных продуктов питания (преимущественно при анкилостомозе и редко при некаторозе).
Восприимчивость – всеобщая. Наибольшему риску заражения подвержены сельскохозяйственные рабочие, шахтеры, лица, занятые на земельных работах, а также дети.
Главные очаги инвазии расположены в районах с жарким климатом, однако возможно формирование очагов анкилостомидоза в зонах умеренного и даже холодного климата – в условиях глубоких шахт с постоянной довольно высокой температурой и влажностью. В России очаги анкилостомидозов имеются в южных районах (45° с. ш. и 30° ю. ш.). Регистрируются также завозные случаи анкилостомидозов, особенно часто – некатороза.
Патогенез и патологоанатомическая картина. При пероральном заражении личинки проникают в толщу слизистой оболочки тонкой кишки, затем, через 3 – 4 дня, возвращаются в ее просвет, где созревают через 4 – 5 нед. (A. duodenale) или через 8 – 10 нед. (N. americanus), превращаясь в половозрелых гельминтов, выделяющих яйца.
При перкутанном заражении личинки проделывают сложную миграцию: по кровеносной системе попадают в легкие, затем в ротоглотку, откуда заглатываются, попадают в желудок и кишечник. Зрелые особи анкилостом живут в организме человека 5 – 6 лет, некатора – 10 – 15 лет. Анкилостомиды – истинные гематофаги, питаются только кровью, прикрепляясь к слизистой оболочке на 1 – 3 мин и затем меняя место фиксации. В патогенезе ранней инвазии главным является токсикоаллергическое воздействие паразитарных метаболитов, развитие хронической железодефицитной анемии, обусловленной особенностями питания анкилостомид (потеря крови на одну анкилостому составляет 0,15 – 0,3 мл в сутки, на одного некатора 0,05 – 0,1 мл). Имеет значение также травматизация слизистой оболочки верхних отделов тонкой кишки, нервно‑рефлекторные влияния на другие отделы желудочно‑кишечного тракта, возможно присоединение микробной флоры.
Клиническая картина. При перкутанном заражении в первые дни (даже часы) в месте проникновения личинок развивается аллергический дерматит, более тяжелый при повторных заражениях. В последующем развиваются симптомы поражения легких (эозинофильные инфильтраты), бронхит, ларингит, часто возникает лихорадка. Симптомы связанные с миграцией личинок в организме, обнаруживаются в течение 2 – 3 нед., затем исчезают.
Ранняя фаза анкилостомидозов обычно сопровождается высокой эозинофилией (до 30 – 60 % и более).
При пероральном заражении указанные симптомы не выражены.
В хронической фазе анкилостомидозов развивается симптомокомплекс дуоденита, перидуоденита и еюнита; больных беспокоит тошнота, иногда отмечаются рвота, наклонность к диарее, характерны боли в эпигастральной области, напоминающие боли при язвенной болезни двенадцатиперстной кишки. Постепенно развивается железодефицитная анемия с соответствующими клиническими и гематологическими проявлениями. Степень тяжести анемии зависит от интенсивности и длительности инвазии, вида гельминта (более выраженная при анкилостомозе, чем при некаторозе), характера питания больного и преморбидного фона.
Прогноз. В большинстве случаев благоприятный. Однако инвазии анкилостомами и некатором снижают трудоспособность взрослого населения и отрицательно сказываются на развитии детей.
Диагностика. Диагноз устанавливается при обнаружении в свежем кале или дуоденальном содержимом яиц анкилостомид. Исследование фекалий проводится методом большого мазка, методами обогащения (Фюллеборна, Калантарян, Като и др.). Яйца анкилостом и некаторов неразличимы, таким образом, при обнаружении яиц ставят диагноз – анкилостомидоз. Для уточнения диагноза ВОЗ рекомендует метод культивирования личинок в пробирке на фильтровальной бумаге (метод Harada – Mori).
Лечение. Для лечения анкилостомидозов используют албендазол (немозол) взрослым и детям старше 2 лет 400 мг однократно. С успехом применяются пирантел (комбантрин) в суточной дозе 10 – 20 мг/кг во время еды в течение 2 дней; мебендазол (вермокс) по 100 мг 2 раза в день в течение 3 дней; левамизол (декарис) по 2,5 – 5 мг/кг (разовая доза, она же – курсовая) перед сном, при отсутствии эффекта – повторный курс через неделю; тиабендазол (минтезол) по 25 мг/кг 2 раза в день после еды в течение 2 дней; нафтамон (алькопар) по 5,0 г натощак в течение 2 – 3 дней, медамин по 0,2 г 3 раза в день в течение 3 дней. При выраженной анемии назначают пероральные и парентеральные препараты железа, фолиевую кислоту, протеины, в особо тяжелых случаях показаны гемотрансфузии.
Контроль эффективности лечения проводят через 3 – 4 нед. после окончания терапии 3‑кратным исследованием фекалий с интервалом в 30 дней. В случае анкилостомоза после лечения больного наблюдают ежемесячно в течение 1 года. Профилактика. Включает в себя комплекс мер по выявлению и лечению инвазированных анкилостомидами, а также санитарно‑эпидемиологические мероприятия по оздоровлению почвы, шахт и подземных сооружений, защите их от фекального загрязнения.
Личинки нескольких видов анкилостом животных могут активно проникать через кожные покровы человека и вызывать в них воспалительную реакцию. Дальнейшего развития паразита в данном случае не происходит (см. подразд. «Синдром мигрирующих личинок (Lavra migrans)»).
Стронгилоидоз
Этиология. Возбудитель – Strongyloides stercoralis – имеет сложный цикл развития с возможным чередованием паразитических и свободноживущих поколений половозрелых червей.
Паразитическая самка представляет собой бесцветную, полупрозрачную нитевидную нематоду размером 2,2 % (0,03 – 0,07) мм; свободноживущая самка меньших размеров – 1,0 % 0,06 мм. Свободноживущие и паразитические самцы сходны по строению и размерам тела 0,7 % (0,04 – 0,05) мм.
Вышедшие из яйца рабдитовидные личинки очень малы (0,225 % 0,16 мм), с превращением их в филяриевидную стадию они становятся крупнее (0,55 % 0,017 мм).
Эпидемиология. Стронгилоидоз – геогельминтоз, антропоноз.
Источником инвазии является инвазированный человек, с фекалиями которого выделяются рабдитовидные личинки гельминтов. При благоприятных условиях в почве эти личинки образуют поколение свободноживущих червей, из яиц которых выходят рабдитовидные личинки, дающие начало новому поколению свободноживущих гельминтов или превращающиеся в инвазионные для человека филяриевидные личинки (непрямой путь развития). При неблагоприятных условиях среды, в частности в странах с умеренным климатом, выделяемые с фекалиями человека рабдитовидные личинки через 12 – 48 ч превращаются в инвазионные филяриевидные личинки (прямой путь развития). Последние могут сформироваться непосредственно в тонкой кишке, обусловливая аутоинвазию.
Заражение человека происходит в результате внедрения филяриевидных личинок перкутанным путем или перорально, однако и в последнем случае филяриевидные личинки активно внедряются в слизистые оболочки полости рта и пищевода. Восприимчивы к инвазии люди всех возрастов. Вопросы иммунитета изучены мало.
Стронгилоидоз распространен в странах с тропическим климатом, встречается в Грузии, Азербайджане, Молдавии, на Украине и изредка в южных районах России.
Патогенез и патологоанатомическая картина. В ранней стадии инвазии проникшие в организм человека филяриевидные личинки мигрируют с током крови, последовательно попадая в правые отделы сердца и легкие. В бронхах и трахее после двух линек, на что уходит более 2 нед., личинки превращаются в юных самок и самцов, которые через глотку попадают в желудок и тонкую кишку. В хронической фазе инвазии, спустя 28 – 30 дней после внедрения филяриевидной личинки, сформировавшаяся самка откладывает до 50 зрелых яиц, из которых выходят рабдитовидные личинки. Последние выделяются во внешнюю среду или могут превращаться в филяриевидные личинки, внедряющиеся в кишечную стенку или кожу перианальной области с развитием аутоинвазии. В случаях иммунодефицита макроорганизма численность паразитов может стать весьма значительной, возникает внекишечная локализация личинок с полиорганными поражениями (диссеминация), что обусловливает тяжелое и неблагоприятное течение болезни.
В патогенезе инвазии большое значение, особенно в ранней, миграционной фазе, имеет сенсибилизация организма человека продуктами обмена паразитов. Особенности прикрепления и паразитирования взрослых самок гельминта приводят к значительным механическим повреждениям тонкой кишки. Миграция личинок делает механический фактор патогенеза еще более значительным. В желудочно‑кишечном тракте, преимущественно в пилорическом отделе желудка, двенадцатиперстной и тощей кишке, отмечается отек, эозинофильная инфильтрация, кровоизлияния, эрозии и нередко изъязвления слизистой оболочки. В случаях иммунодефицита (СПИД и другие заболевания) вследствие большей численности гельминтов очаги поражения выявляются в различных органах и тканях (в печени, поджелудочной железе, миокарде, головном мозге и его оболочках и др.).
Клиническая картина. При экспериментальном заражении людей инкубационный период составляет 17 дней. Течение инвазии длительное, с периодами ремиссии и обострений, при повторных аутоинвазиях болезнь может продолжаться неопределенно долго.
В ранней фазе болезни развивается картина аллергоза: больные жалуются на слабость, раздражительность, головные боли, кожный зуд, полиморфные экзантемы. У многих больных повышается температура тела до субфебрильных, а иногда и фебрильных цифр. При значительной инвазии развиваются симптомы бронхита и эозинофильной летучей пневмонии, точнее аллергических летучих инфильтратов в легких. Нередко все эти признаки инвазии носят эфемерный характер и ранняя фаза стронгилоидоза проходит незамеченной.
В клинической картине хронической (кишечной) фазы стронгилоидоза выделяют несколько форм.
Желудочно‑кишечная форма инвазии проявляется главным образом симптомами хронического гастрита с пониженной секрецией, энтероколита, а иногда и дуоденита с симуляцией клинической картины язвенной болезни двенадцатиперстной кишки. Нередко можно выявить признаки дискинезии желчного пузыря и желчных путей, что делает клиническую картину инвазии еще более разнообразной.
Токсико‑аллергическая форма клинически характеризуется наличием уртикарной сыпи, ползучих линейных высыпаний, сильного зуда и расстройствами нервной системы; может возникать тромбоцитопения.
Смешанная форма включает в себя все или некоторые симптомы других вариантов течения стронгилоидоза. Возможны серьезные осложнения: язвенные поражения кишечника, перфоративный перитонит, некротический панкреатит, миокардит, менингоэнцефалит и др.
Для стронгилоидоза характерна эозинофилия крови, которая особенно высока в ранней фазе инвазии и при токсико‑аллергической форме в поздней фазе болезни (до 70 – 80 %). Нередко в гемограмме выявляются лейкемоидные реакции эозинофильного типа. Может быть увеличение СОЭ до 40 – 60 мм/ч.
Прогноз. В большинстве случаев благоприятный, но при тяжелых формах, повторных аутоинвазиях и наличии интеркуррентных болезней может стать неблагоприятным.
Диагностика. Предполагает обнаружение личинок в фекалиях методом Бермана и в дуоденальном содержимом. В материале могут обнаруживаться как рабдитовидные, так и филяриевидные личинки. Исследуются свежевыделенные фекалии, собранные предпочтительно после приема слабительного. Применяется метод культивирования личинок в пробирке (по Harada – Mori). Перед микроскопированием личинок обязательно необходимо убить нагреванием. Больного стронгилоидозом обследуют на ВИЧ‑инфекцию.
Лечение. Для лечения стронгилоидоза показана гипосенсибилизирующая терапия. В кишечной фазе назначают ивермектин в дозе 200 мкг/кг однократно, албендазол (немозол) по 400 мг в день за один прием на протяжении 3 сут (взрослым и детям старше 2 лет), карбендацим (медамин) взрослым и детям из расчета 10 мг/кг/сут в три приема в течение 3 – 5 дней, тиабендазол (минтезол) в суточной дозе 25 – 50 мг/кг через 30 мин после еды в течение 2 дней. При тяжелом течении стронгилоидоза показаны повторные курсы терапии со сменой препаратов. Также важно осуществлять коррекцию запоров.
Контроль эффективности лечения проводят через 1 мес. после лечения 3‑кратным исследованием фекалий с интервалом в 1 – 2 дня, а затем ежемесячно в течение 3 мес.
Профилактика. Складывается из проведения комплекса мероприятий лечебного и санитарного порядка. Высокая способность личинок стронгилоидов к проникновению через кожу объясняет запрет на сдачу кала на анализ в лаборатории в спичечных коробках.
Трихинеллез
Этиология. Возбудитель – Trichinella spiralis – мелкая нематода. Длина тела половозрелой самки – 1,5 – 0,8 мм (до оплодотворения) и 4,4 мм (после оплодотворения), самца не превышает 2 мм. Самка живородяща и отрождает личинки длиной 0,09 – 0,11 мм, которые в мышцах хозяина увеличиваются до 0,8 – 1,0 мм в длину, закручиваются в спираль и к 3 – 4‑й неделе инкапсулируются.
Эпидемиология. Трихинеллез – пероральный биогельминтоз, зооноз. В природных очагах источником инвазии являются дикие животные: волки, лисицы, енотовидные собаки, барсуки, кабаны, медведи и др., которые заражаются главным образом в результате хищничества и поедания трупов павших инвазированных животных. В антропоургических очагах источником возбудителей служат домашние животные (свиньи, кошки, собаки), грызуны и другие животные, которые заражаются при поедании продуктов убоя, пищевых отходов и падали, содержащих личинки трихинелл. Человек заражается при употреблении в пищу недостаточно термически обработанного мяса инвазированных животных, в особенности кабанов, медведей, тюленей, свиней, а также конины. Один и тот же организм служит для трихинелл и окончательным и промежуточным хозяином.
Восприимчивость человека к трихинеллезу высокая. После перенесенной инвазии остается непродолжительный и ненапряженный иммунитет. Возможны повторные заболевания, которые обычно протекают легко. Нередко трихинеллез выявляется в виде групповых вспышек часто семейного характера.
Трихинеллез широко распространен во всех климатических поясах.
Патогенез и патологоанатомическая картина. Заглатываемые с мясом личинки трихинелл в желудке и тонкой кишке человека освобождаются от капсулы, через 1 – 1,5 ч внедряются в слизистую оболочку, в подслизистую основу кишки и через сутки становятся половозрелыми. После копуляции на 3 – 4‑е сутки и в течение 10 – 30, иногда до 50 дней самки откладывают личинки (одна самка производит от сотни до 2000 юных трихинелл), которые заносятся кровью в поперечнополосатую мускулатуру, где задерживаются, увеличиваются в размерах, закручиваются в спираль и инкапсулируются. К 17 – 18‑му дню развития личинка становится инвазионной для нового хозяина. Инкапсулированные личинки могут жить в организме хозяина 10 – 40 лет. Постепенно капсулы кальцифицируются, личинки в них погибают.
Основой патогенеза является сенсибилизирующее действие продуктов обмена и гибели паразитов на организм человека, что приводит к выраженным аллергическим реакциям, которые усугубляются процессами аутосенсибилизации при деструкции тканей хозяина. В мышцах вокруг гельминтов формируются капсулы. Характерны аллергические васкулиты, иногда тяжелые и распространенные, а также инфильтраты того же генеза во внутренних органах больного. Известно, что личинки подвида T. pseudospiralis не образуют капсул, однако у человека они встречаются редко.
Клиническая картина. Инкубационный период продолжается 5 – 30 дней и более, обычно 10 – 25 дней, при этом короткая инкубация наблюдается при тяжелых, а продолжительная – при легких формах. В начале болезни нередко наблюдаются симптомы энтерита.
Кардинальными признаками трихинеллеза считаются отеки век и лица, миалгии, лихорадка, высокая эозинофилия крови. Отеки век и лица в сочетании с конъюнктивитом, часто являющиеся первыми проявлениями болезни, возникают и развиваются в течение 1 – 5 дней, сохраняясь при легких и средней тяжести формах болезни 1 – 2, реже 3 нед. При тяжелых формах они развиваются медленнее, держатся дольше и могут рецидивировать. Распространение отеков на шею, туловище, конечности прогностически неблагоприятно.
Миалгии появляются и нарастают параллельно развитию отеков и могут быть очень интенсивными, вплоть до болевых контрактур. Чаще всего боли возникают в глазных, жевательных мышцах, мышцах шеи, икроножных, поясничных и др. Миалгии, как правило, отсутствуют в покое и возникают при малейшем движении и пальпации мышц. Отеки и миалгии обычно сопровождаются лихорадкой, чаще ремиттирующего, реже постоянного или интермиттирующего типа. В легких случаях болезни лихорадка не выражена.
Исключительную диагностическую ценность имеет эозинофилия крови, обычно достигающая максимума (50 – 60 % и более) на 3 – 4‑й неделе болезни. Одновременно выявляется лейкоцитоз (до 10 – 30 % 109/л). Уменьшение количества эозинофильных лейкоцитов в разгар заболевания является плохим прогностическим признаком.
Наряду с описанными кардинальными проявлениями болезни у больных трихинеллезом наблюдаются плохое самочувствие, бессонница, головная боль, беспокойство или, напротив, депрессия, отмечаются боли в животе, тошнота, разнообразные высыпания на коже. Общая продолжительность заболевания колеблется от 1 – 2 до 5 – 6 нед.
При интенсивной инвазии и недостаточной реактивности организма трихинеллез протекает крайне тяжело, длительно и сопровождается серьезными поражениями внутренних органов, часто приводящими больного к гибели (миокардиты с острой сердечной недостаточностью, пневмонии, менингоэнцефалиты). Описаны трихинеллезные гепатиты, нефрит, системный васкулит и тромбофлебиты, тромбоцитопения с геморрагическими проявлениями. В связи с широким использованием кортикостероидных препаратов для лечения трихинеллеза у некоторых больных инвазия принимает хроническое течение, связанное, по‑видимому, с нарушением капсулообразования вокруг личинок, их гибелью и формированием воспалительных фокусов в мышечной ткани. Все это может поддерживать сенсибилизацию и аутосенсибилизацию организма длительное время. Больные жалуются на слабость, боли в сердце и скелетных мышцах, быструю утомляемость, которые сохраняются годами.
Прогноз. Летальность при тяжелых формах трихинеллеза остается довольно высокой, достигая во время отдельных вспышек 10 – 30 %.
Диагностика. Выявление манифестных форм строится на основании эпидемиологических данных (употребление в пищу свинины или мяса диких животных, а также групповой характер заболеваемости) и клинической картины заболевания. Решающим в диагностике может стать исследование мяса (компрессионная трихинеллоскопия), которое употреблялось заболевшими лицами. Используют некоторые сероиммунологические тесты: ИФА, РНГА, реакцию кольцепреципитации (положительная со 2 – 3‑й недели заболевания), РСК на холоду (с 4 – 5‑й недели), реакцию микропреципитации живых личинок (выявляется в более ранние сроки, чем первые две).
Кожная аллергическая проба выявляет инвазию со 2‑й недели заболевания, она может быть положительной спустя 5 – 10 лет после заболевания и практически не используется. При кортикостероидной терапии проба может быть отрицательной. Иногда диагноз подтверждают, изучая биоптат мышц человека, обычно дельтовидных (трихинеллоскопия).
Лечение. Лечение больных трихинеллезом проводят в стационаре. Для лечения взрослых и детей старше 2 лет применяют албендазол (немозол) – 400 мг 2 раза в день в течение 8 – 14 дней или альтернативный препарат мебендазол (вермокс) по 200 – 400 мг 3 раза в день в течение 3 дней, затем по 400 – 500 мг 3 раза в день в течение 10 дней. Менее выраженный эффект оказывает тиабендазол (минтезол), назначаемый по 25 мг/кг/сут в 2 – 3 приема в течение 5 – 10 дней. Терапию следует начинать как можно раньше, в первые 2 – 3 нед. инвазии.
Купирование токсико‑аллергических проявлений, усиливающихся на фоне дегельминтизации в результате распада личинок, осуществляют с помощью глюкокортикостероидов (преднизолон по 30 – 90 мг/сут в зависимости от степени тяжести) в течение 10 – 14 дней. Удлинение курса гормонотерапии требует повторного назначения вермокса. По показаниям проводится дезинтоксикационная и симптоматическая терапия. У ряда больных в периоде реконвалесценции могут возникать рецидивы, требующие повторного назначения антигельминтиков и гипосенсибилизирующих средств. Следует помнить, что глюкокортикостероиды могут не только искажать клиническую картину трихинеллеза, но и продлевать период ларвопродукции гельминта.
Реконвалесценты трихинеллеза подлежат диспансеризации в течение 6 мес., а при наличии остаточных проявлений их наблюдают на протяжении года.
Профилактика. Основные мероприятия по профилактике трихинеллеза направлены на разрыв эпидемиологических и эпизоотологических звеньев в круговороте трихинелл. Большое значение в борьбе с трихинеллезом имеет обязательное исследование мяса на наличие трихинелл. Мясо и мясные продукты, содержащие личинки паразита, исключаются из продажи и подлежат технической утилизации. В местах содержания свиней должна проводиться эффективная дератизация. Не допускается кормление свиней отходами животноводства. Известно, что личинки трихинелл достаточно устойчивы к нагреванию. Для обеззараживания мяса его следует варить кусками, не более 7 см в диаметре, в течение не менее 2,5 ч.
Трихоцефалез
Этиология. Возбудитель – Trichocephalus trichiurus – власоглав. Тело червя состоит из волосовидного головного и толстого хвостового отдела; длина тела самок – 3,5 – 5,5 см, самцов – 3 – 4,4 см. Хвостовой конец у самцов спиралевидно закручен. Яйца размером (0,047 – 0,054) % (0,022 – 0,023) мм желтовато‑коричневого цвета, по форме напоминают бочонок, имеют на полюсах пробки. Яйца власоглава более устойчивы к факторам окружающей среды, чем яйца аскарид.
Эпидемиология. Трихоцефалез – пероральный геогельминтоз, антропоноз. Окончательный хозяин и источник инвазии – человек, в толстой, преимущественно в слепой, кишке которого паразитируют зрелые черви, откладывающие яйца. Последние с экскрементами попадают в почву, где при благоприятных условиях в течение 20 – 24 дней в них развиваются инвазионные личинки.
Заражение трихоцефалезом происходит в результате заглатывания яиц, содержащих инвазионную личинку, при употреблении загрязненных овощей, фруктов и ягод, воды, а также при заносе яиц в рот грязными руками. Восприимчивость к трихоцефалезу всеобщая.
Трихоцефалез широко распространен на земном шаре, преимущественно во влажных районах тропического, субтропического и умеренного климата.
Патогенез и патологоанатомическая картина. В кишечнике из яиц выходят личинки, которые внедряются в ворсинки слизистой оболочки тонкой кишки; спустя 3 – 10 су<
|
|
|

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!