Трипсин вырабатывается в виде профермента трипсиногена. Активация трипсиногена происходит при участии фермента энтеропептидазы, выделяемого клетками кишечника. Она отщепляет N-концевой гексапептид трипсиногена, в результате образуется активный трипсин. Основное количество трипсиногена активируется трипсином, т. е. путем аутоактивации. Остальные проферменты поджелудочной железы – химотрипсиноген, проэластаза и прокарбокспептидаза - активируются трипсином и тоже путем частичного протеолиза; в результате образуются функционально активные ферменты – эндопептидазы химотрипсин, эластаза иэ кзопептидазы карбоксипептидазы А и В. Они наиболее активны в слабощелочной среде (рН
7,2-7,8).
Действие ферментов панкреатического сока также относительно избирательно: трипсин гидролизует связи, образованные СООН-группами арг, лиз; химотрипсин – тир, фен, три, лей, илей, вал. Эластаза поджелудочной железы гидролизует эластин. Карбоксипептидаза А разрывает преимущественно пептидные связи, образованные С-концевыми ароматическими аминокислотами или аминокислотами с гидрофобными радикалами, а карбоксипептидаза В - С-концевыми лизином и аргинином.
Последний этап переваривания - гидролиз небольших пептидов. Он происходит под действием ферментов экзопептидаз, которые синтезируются клетками тонкого кишечника в активной форме. Аминопептидазы гидролизуют пептидные связи, образованные любой N-концевой аминокислотой. Дипептидазы гидролизуют пептидные связи в образовавшихся дипептидах.
Последовательное действие пептидгидролаз лишает белки видовой специфичности и обеспечивает практически полное расщепление белков до аминокислот.
Продукты гидролиза белков всасываются в пищеварительном тракте в основном в виде свободных аминокислот при участии белков-переносчиков. Аминокислоты, подобно глюкозе, всасываются с ионами Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану энтероцита в кровь.
94. Общие пути обмена аминокислот. Дезаминирование, трансаминирование. Использование определения активности трансаминаз в клинической практике.
Превращения аминокислот под действием микрофлоры кишечника
Все превращения аминокислот, вызванные деятельностью микроорганизмов кишечника, получили общее название «гниение белков в кишечнике». В кишечнике образуются ядовитые продукты обмена - сероводород H2S, метилмеркаптан CH3SH, амины, крезол, фенол, скатол и индол.
В печени они подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой и выделяются с мочой.

Количество индикана, выделившегося с мочой, характеризует, с одной стороны, скорость гниения белков в кишечнике; с другой стороны, может отражать функциональную активность печени.
Реакции по аминогруппе
1. Дезаминирование аминокислот. Во всех случаях NH2-rpyппa аминокислоты освобождается в виде аммиака.
Восстановительное дезаминирование:
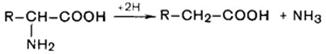 .
.
Гидролитическое дезаминирование (серин, треонин, цистеин):
 .
.
Гистидин подвергается внутримолекулярному дезаминированию:
 ®
®  .
.
Преобладающим является окислительное дезаминирование.

С наибольшей скоростью дезаминируется глутаминовая кислота под действием фермента глутаматдегидрогеназы. Коферментами глутаматдегидрогеназы являются НАД+ или НАДФ+. Сначала глутамат ферментативно окисляется в иминоглутарат, а затем иминокислота без участия фермента гидролизуется с образованием α-кетоглутарата и аммиака.

В печени и почках имеется оксидаза L-аминокислот. Коферментом оксидазы L-аминокислот является ФМН или ФАД. Они выполняют роль переносчика водорода с аминокислоты непосредственно на кислород.
2. Трансаминирование аминокислот -реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту. БольшинствоL-аминокислот дезаминируется в организме путем трансаминирования (переаминирования) с α-кетоглутаровой кислотой:
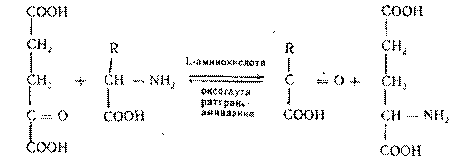
Ферменты - аминоферазы, или трансаминазы. Они содержатся практически во всех органах (таблица 1), но наиболее активно реакции трансаминирования протекают в печени. Их кофермент - пиридоксальфосфат (производное витамина В6). Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию. А. Е. Браунштейн для подобного непрямого пути дезаминирования аминокислот предложил термин трансдезаминирование.
Для клинических целей наибольшее значение имеют аспартат-аминотрансфераза (АсАТ) и аланин-аминотрансфераза (АлАТ), катализирующие перенос аминогруппы с аспартата и аланина на a-кетоглутарат:
аспартат + α-кетоглутарат ® оксалоацетат + глутамат
аланин + α-кетоглутарат ® пируват + глутамат
В сыворотке крови здоровых людей активность этих аминотрансфераз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу аминотрансфераз из очага поражения в кровь. Уже через 3-5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке крови резко повышается (в 20-30 раз). Уровень АлАТ в крови в большей степени повышается при заболеваниях печени.






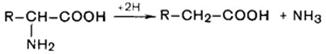 .
. .
. ®
®  .
.





