Второй закон термодинамики, как и первый, связан с тепловыми процессами. Он устанавливает возможность, направление и глубину протекания самопроизвольных процессов.
Существует несколько различных, но эквивалентных формулировок второго закона термодинамики: 1)любая изолир с-ма, представл сама себе изм-ся в направл, обладающим максим-й термодин вероятн-ю, т.е. быстро или медленно, но всякая система стремится к состоянию равновесия; 2)теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому; 3)невозможен периодический процесс, единственным результатом которого является превращение теплоты в работу. Суть второго начала состоит в том, что оно определяет направление самопроизвольного протекания процессов, в том числе и химических реакций.
Для описания таких переходов существует термодинамическая функция системы - энтропия.
Энтропия – это функция состояния системы, являющаяся мерой её неупорядоченности. Энтропия S – число микросостояний с-мы через которые оно может себя реализовать: S=klnW данное ур-е явл-ся матем выраж 2-го з-на термодинам.
Энтропия при обратимом процессе есть отношение общего количества тепла ΔQ величине абсолютной температуры Т (то есть тепло, переданное системе, при постоянной температуре). При необратимом процессе справедливо неравенство: ∆S >∆Q/T
То есть в изолированной системе самопроизвольно протекают только те процессы, которые сопровождаются увеличением энтропии.
Изменение энтропии в различных изопроцессах рассчитывается: Изобарный процесс: ∆S = nCp*ln(T2/T1)
Изохорный процесс: ∆S = nCv*ln(T2/T1)
Изотермический процесс: ∆S = nR*ln(V2/V1)
Адиабатный процесс: ∆S = 0 Второй закон термодинамики в виде  , записанный для равновесных процессов, позволяет вычислить не абсолютное значение энтропии, а только разность энтропий в двух состояниях системы.
, записанный для равновесных процессов, позволяет вычислить не абсолютное значение энтропии, а только разность энтропий в двух состояниях системы.  . Расчет изменения энтропии в необратимых процессах. Запишем равенство и неравенство Клаузиуса для обратимого и необратимого процесса:
. Расчет изменения энтропии в необратимых процессах. Запишем равенство и неравенство Клаузиуса для обратимого и необратимого процесса:
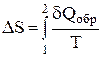 ;
; 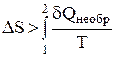 (12)
(12)
Пусть система из состояния 1 в состояние 2 перейдет двумя путями - обратимым и необратимым. Поскольку энтропия есть функция состояния, то ее изменение не зависит от пути перехода системы из одного состояния в другое, т.е. DSнеобр = DSобр = S2 - S1 (13)
Поэтому для нахождения изменения энтропии реального необратимого процесса нужно разбить его на стадии, которые проводятся обратимо, вычислить для них изменения энтропии по соответствующим уравнениям для обратимых процессов, а затем просуммировать изменения энтропии DS для всех стадий.
DS1 = DS2 + DS3 + DS4. (14) Изменение энтропии при изотермическом расширении (сжатии) идеального газа. Ранее из объединенного первого и второго закона термодинамики для обратимых процессов было показано, что
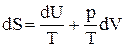 , (22)но dU = СVdT; для 1 моля идеального газа справедливо уравнение Менделеева-Клапейрона pV = RT, следовательно
, (22)но dU = СVdT; для 1 моля идеального газа справедливо уравнение Менделеева-Клапейрона pV = RT, следовательно 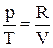 . Поэтому получим:
. Поэтому получим: 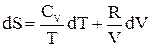 (23) При T = const dT = 0, следовательно,
(23) При T = const dT = 0, следовательно, 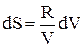 . Проинтегрируем последнее выражение:
. Проинтегрируем последнее выражение: 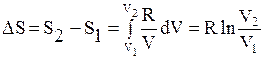 . (24)
. (24)
Так как при постоянной температуре для идеального газа справедлив закон Бойля-Мариотта: р1V1 = р2V2, то  , следовательно,
, следовательно, 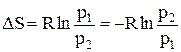 . (25)
. (25)
Изменение энтропии в химической реакции. (изотермич изм-е конц-и р-ра) Рассмотрим изменение энтропии в химической реакции: nАА + nВВ  nDD + nЕЕ
nDD + nЕЕ
Изменение энтропии DrS в результате одного пробега реакции будет равно: 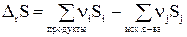 (29 Изменение энтропии в про-сах фазового перехода
(29 Изменение энтропии в про-сах фазового перехода  где
где 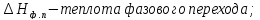 Т – абсолютная температура фазового перехода. В общем случае обратимого процесса при постоянном объеме, когда изменение внутренней энергии равно
Т – абсолютная температура фазового перехода. В общем случае обратимого процесса при постоянном объеме, когда изменение внутренней энергии равно 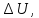 или при постоянном давлении, когда изменение энтальпии равно
или при постоянном давлении, когда изменение энтальпии равно 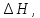 изменение энтропии равно:
изменение энтропии равно: 
Данные формулы справедливы, если принять, что теплоемкости вещества не зависят от температур, что справедливо в узком температурном интервале.
Изменение энтропии при нагревании или охлаждении вещества в пределах одного агрегатного состояния рассчитывается:
Т2
ΔS = ∫(Ср/Т)dT
Т1 Если теплоемкость вещества не зависит от температуры, то получаем формулы для изобарного и изохорного процессов.
При фазовом переходе изменение энтропии равно: ΔSф.п. = ΔHф.п./Тф.п.
где ΔHф.п. – изменение энтальпии при фазовом переходе, Тф.п. - температура фазового перехода.
Энтропия - является функцией состояния, то есть это величина аддитивная, общее изменение энтропии вещества равно сумме изменения энтропий для всех процессов (нагревание, плавление, растворение, конденсация и т.п.)
ΔSобщ = ∑Si





 , записанный для равновесных процессов, позволяет вычислить не абсолютное значение энтропии, а только разность энтропий в двух состояниях системы.
, записанный для равновесных процессов, позволяет вычислить не абсолютное значение энтропии, а только разность энтропий в двух состояниях системы.  . Расчет изменения энтропии в необратимых процессах. Запишем равенство и неравенство Клаузиуса для обратимого и необратимого процесса:
. Расчет изменения энтропии в необратимых процессах. Запишем равенство и неравенство Клаузиуса для обратимого и необратимого процесса: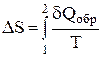 ;
; 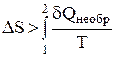 (12)
(12)
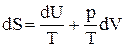 , (22)но dU = СVdT; для 1 моля идеального газа справедливо уравнение Менделеева-Клапейрона pV = RT, следовательно
, (22)но dU = СVdT; для 1 моля идеального газа справедливо уравнение Менделеева-Клапейрона pV = RT, следовательно 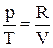 . Поэтому получим:
. Поэтому получим: 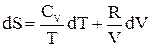 (23) При T = const dT = 0, следовательно,
(23) При T = const dT = 0, следовательно, 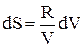 . Проинтегрируем последнее выражение:
. Проинтегрируем последнее выражение: 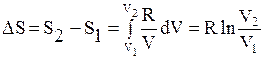 . (24)
. (24) , следовательно,
, следовательно, 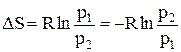 . (25)
. (25) nDD + nЕЕ
nDD + nЕЕ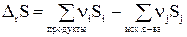 (29 Изменение энтропии в про-сах фазового перехода
(29 Изменение энтропии в про-сах фазового перехода  где
где 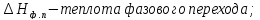 Т – абсолютная температура фазового перехода. В общем случае обратимого процесса при постоянном объеме, когда изменение внутренней энергии равно
Т – абсолютная температура фазового перехода. В общем случае обратимого процесса при постоянном объеме, когда изменение внутренней энергии равно 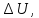 или при постоянном давлении, когда изменение энтальпии равно
или при постоянном давлении, когда изменение энтальпии равно 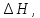 изменение энтропии равно:
изменение энтропии равно: 


